采后茉莉酸甲酯处理对桃果实青霉病及细胞壁降解酶的影响
李灿婴,张丽华,葛永红,*,董柏余,漆倩涯(.渤海大学食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁锦州03;.甘肃农业大学食品科学与工程学院,甘肃兰州730070)
采后茉莉酸甲酯处理对桃果实青霉病及细胞壁降解酶的影响
李灿婴1,张丽华1,葛永红1,*,董柏余2,漆倩涯2
(1.渤海大学食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁锦州121013;2.甘肃农业大学食品科学与工程学院,甘肃兰州730070)
以桃果实为试材,研究了采后不同浓度茉莉酸甲酯(MeJA)处理对损伤接种桃果实扩展青霉(Penicillium expansum)病斑扩展的影响,并分析了最佳浓度MeJA处理后桃果实细胞壁降解酶活性的变化。同时研究离体条件下MeJA对P.expansum菌丝生长和孢子萌发的影响。结果表明,100 μmol/L MeJA对桃果实P.expansum的病斑抑制效果最好,并且显著(p≤0.05)抑制了菌丝生长和孢子萌发。100 μmol/L MeJA处理明显抑制了桃果实多聚半乳糖醛酸酶(PG)、果胶甲酯酶(PME)、果胶甲基反式消除酶(PMTE)、多聚半乳糖醛酸反式消除酶(PGTE)和β-葡萄糖苷酶活性。由此表明,MeJA抑制桃果实青霉病的发生与延缓果实软化有关。
茉莉酸甲酯,细胞壁降解酶,桃果实,青霉病
桃属蔷薇科(Rosaceae)桃属(Amygdalus Linn.)植物,果实肉质细腻,营养丰富。桃属于跃变型果实,具有明显的呼吸和乙烯释放高峰,乙烯的释放加速了果实的衰老软化,极易受到Penicillium expansum,Monilinia fructicola,Rhizopus stolonifer,Botrytis cinerea等的侵染而腐烂[1]。目前,有效的控制方法是采后处理过程中避免机械损伤和采用化学杀菌剂处理,但由于杀菌剂残留、环境污染及诱导病原物产生抗药性等问题,开发新型的安全有效采后病害防治技术是当前生产中亟待解决的问题[2-3]。
采后果肉的软化与导致细胞壁结构改变和组织凝结力下降的多糖解聚程度和糖分变化有关,其中果胶酶类和纤维素酶的变化是导致软化的主要原因[4]。因此,有效的抑制细胞壁降解酶的活性,是抑制果实衰老和提高抗病性的关键。茉莉酸甲酯(methyl jasmonate,MeJA)是天然存在于高等植物中的内源生长调节因子,在调控植物生长发育、抗逆反应和次生代谢产物的合成等方面具有重要作用,外源应用还能够诱导植物的抗病性[5]。研究发现,MeJA单独或与其他诱抗剂、生防菌结合处理能够抑制苹果[6]、樱桃番茄[7]、梨[8]、樱桃[9]、枇杷[10-11]等果实的采后病害,且抗病性的提高与诱导果实体内病程相关蛋白积累、苯丙烷代谢途径增强、活性氧代谢及防卫基因表达密切相关[7,9,12-14]。此外,采后MeJA处理能够降低桃果实冷害的发生,并且抑制果实可溶性固形物含量的下降[15],保持较高含量的还原糖、总糖、总酸和抗坏血酸[16]。但有关外源MeJA处理对桃果实青霉病的控制及跟果实软化相关的细胞壁降解酶活性的影响还鲜见报道。
本研究以桃果实为试材,采后用MeJA处理,研究离体条件下MeJA对P.expansum孢子萌发和菌丝生长的影响及对桃果实损伤接种P.expansum的控制效果,并探讨MeJA处理对细胞壁降解酶活性的影响,以期为MeJA在采后衰老和病害控制中的应用提供理论依据。
1 材料与方法
1.1材料与仪器
实验用桃果实(八成熟) 采自兰州安宁区,选取无损伤、质地优良的桃果实,纸箱包装后当天运回实验室处理;Penicillium expansum从自然发病的桃果实分离、纯化后马铃薯葡萄糖琼脂(PDA)培养基上25~27℃培养;茉莉酸甲酯(MeJA)西亚试剂研究中心,纯度为95%。
UV-2450/2550型紫外可见分光光度计日本岛津;H-1850R型低温离心机长沙湘仪离心机仪器有限公司;WYX-A型微型旋涡混合器上海跃进医疗器械厂。
1.2实验方法
1.2.1离体条件下MeJA对P.expansum孢子萌发的影响参照邓惠文等[17]的方法并修改。用接种环挑少许培养7 d的P.expansum,加入到含有0、50、100、200 μmol/L的MeJA的马铃薯葡萄糖培养基(PB)中,25℃恒温培养,当对照孢子萌发率达到90%以上时,统计不同浓度处理孢子萌发情况,每个处理随机观察3个以上视野,每个视野数100个孢子。孢子萌发率(%)=萌发孢子数/孢子总数×100。
1.2.2离体条件下MeJA对P.expansum菌丝生长的影响参照邓惠文等[17]的方法并修改。用消毒的镊子将制好的菌饼(直径为5 mm)反接到含有0、50、100、200 μmol/L MeJA的培养基上,25℃恒温培养。待空白对照菌落接近培养皿边缘时用十字交叉法测定菌落直径。
1.2.3孢子悬浮液的配制参照邓惠文等[17]的方法,使孢子悬浮液的终浓度为1×105孢子/mL。
1.2.4损伤接种参照邓惠文等[17]的方法并修改。选取大小一致,无机械损伤和病虫害的桃果实,分别用50、100、200 μmol/L MeJA浸泡10 min,清水处理为对照,晾干2 h后在果实赤道部位等距离刺孔4个(深约3 mm,直径约4 mm),等孔中汁液晾干后分别取10 μL P.expansum孢子悬浮液接入孔内。稍作晾干后入包装箱,室温贮藏观察发病率,十字交叉法测定病斑直径。每处理用果实15个,重复3次。
1.2.5取样参照范存斐等[18]的方法并修改。MeJA和清水处理果实于第0、1、2、3、4、5 d取皮下1~5 mm处果肉组织3 g,铝箔纸包裹,经液氮速冻后-80℃冰箱中保存待用。每处理每次用果实15个。
1.2.6细胞壁降解酶的提取果胶甲酯酶(PME)、多聚半乳糖醛酸酶(PG)、β-葡萄糖苷酶、多聚半乳糖醛酸反式消除酶(PGTE)和果胶甲基反式消除酶(PMTE)的提取均参照杨志敏等[19]方法。
1.2.7细胞壁降解酶活性的测定
1.2.7.1PG和PME酶活性的测定PG活性测定参照曹建康等[20]方法并修改。取两支试管,加入1.0 mL 50 mmol/L乙酸-乙酸钠缓冲液(pH5.5)和500 μL 10 g/L多聚半乳糖醛酸,37℃预热5 min后,两支试管中分别加入500 μL粗酶液和灭活酶液。混匀后37℃保温1 h,然后加入1.5 mL 3,5-二硝基水杨酸(DNS),煮沸5 min后迅速冷却至室温,按DNS法在540 nm下测定吸光度。PG活性以每小时每克组织样品在37℃催化底物水解生成半乳糖醛酸的质量表示(mg/h/g)。
PME活性测定参照Hagerman等[21]方法并修改。取一支试管加入4 mL 5 g/L果胶溶液、300 μL 0.01%溴麝香草酚兰,加入300 μL酶液后,立即测定620 nm下吸光度值,反应2 min后再次测定吸光度值。以每分钟每克组织(鲜重)在酶促反应体系中吸光度值增加1为1个酶活单位,表示为ΔOD620/min/g。
1.2.7.2PGTE和PMTE酶活性测定参照杨志敏等[19]方法并改进,取两支试管,分别加入4.0 mL 50 mmol/L Gly-NaOH缓冲液(pH9.0)、1.0 mL 3 mmol/L CaCl2、300 μL 1 g/L多聚半乳糖醛酸或果胶,在30℃下预保温5 min,然后向一支试管中加入100 μL酶液,立即测定反应混合物在232 nm处的吸光度;另一支试管中也加入100 μL酶液,然后在30℃保温10 min,冷却后立即在232 nm处测定反应后的吸光度值。PGTE和PMTE活性以30℃下每分钟每克组织在酶促反应下催化底物释放1 μmol不饱和醛酸反应量表示。
1.2.7.3β-葡萄糖苷酶活性的测定参照曹建康等[20]方法。取两支具塞试管,每支试管分别加入1.5 mL 10 g/L的水杨苷溶液,37℃预热5 min后,其他步骤同PG活性测定。β-葡萄糖苷酶活性以每小时每克组织样品在37℃催化水杨苷水解形成还原糖的质量表示,即mg/h/g。
1.3数据分析
全部3次重复的实验数据,用Microsoft Excel 2007计算平均值并作图,采用SPSS 16.0统计软件进行LSD分析。
2 结果与分析
2.1离体条件下MeJA对P.expansum菌丝生长和孢子萌发的影响
不同浓度MeJA处理均显著(p≤0.05)抑制了P.expansum的菌丝生长(图1A)和孢子萌发(图1B),并且随着MeJA浓度的增加抑制效果增加,但是更高浓度的MeJA并没有提高抑制效果,其中以100 μmol/L MeJA对P.expansum菌丝生长和孢子萌发的抑制效果最好。
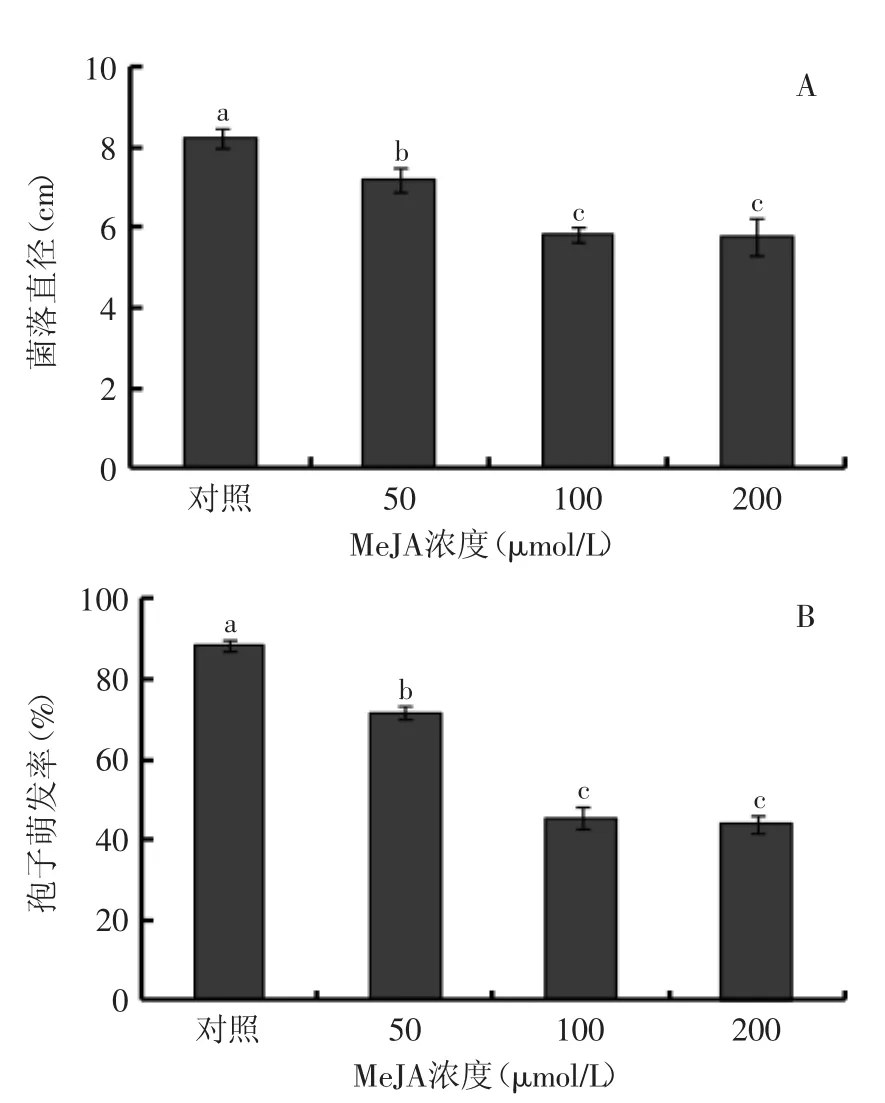
图1 MeJA对P.expansum菌丝生长(A)和孢子萌发(B)的影响Fig.1 Effect of MeJA on mycelia growth(A)and spore germination(B)of P.expansum
2.2MeJA处理对桃果实青霉病的控制
MeJA处理后2 h损伤接种P.expansum,果实贮藏5 d后,发病率达到100%,与对照相比,MeJA处理显著(p≤0.05)抑制了病斑的扩展,其中以100 μmol/L MeJA对P.expansum的抑制效果最好,抑制率达27.5%, 200 μmol/L MeJA没有进一步提高抑制效果(图2)。
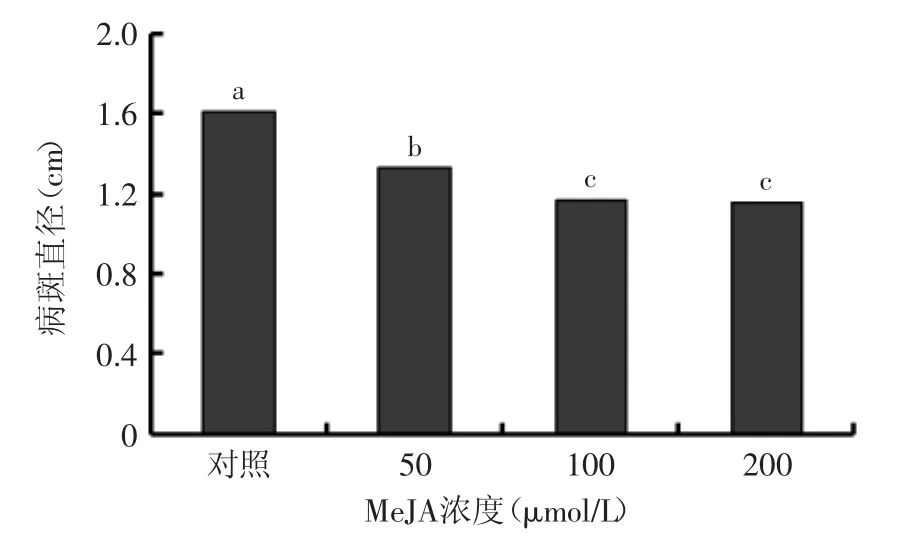
图2 不同浓度MeJA处理对桃果实损伤接种P.expansum病斑直径的影响Fig.2 Effect of MeJA at different concentrations on lesion diameter in peach fruit inoculated with P.expansum
2.3MeJA处理对桃果实细胞壁降解酶活性的影响
2.3.1对果实PME和PG活性的影响整个贮藏期间,对照和处理果实PME和PG活性的变化趋势基本一致,呈先升高后降低的趋势,但MeJA处理显著降低了桃果实PME和PG活性(图3)。对照果实PME活性在贮藏第2 d达到最大,而MeJA处理果实没有明显的活性高峰出现(图3A)。对照处理果实PG活性在第2 d出现高峰,其活性高出MeJA处理31.5%,而MeJA处理果实PG活性在第3 d达到最大(图3B)。
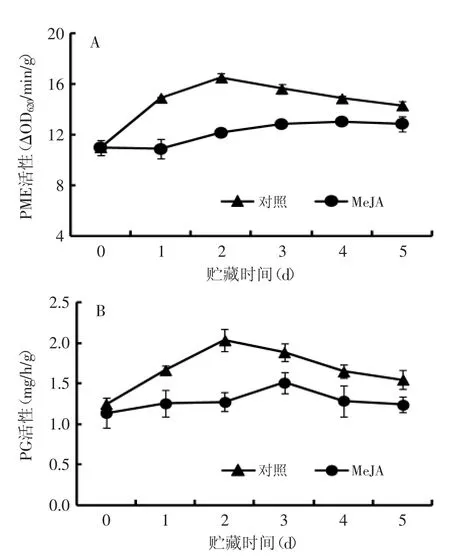
图3 采后MeJA处理对桃果实PME(A)和PG(B)活性的影响Fig.3 Effect of postharvest MeJA treatment on PME(A)and PG(B)activity in peach fruit
2.3.2对果实PMTE和PGTE活性的影响随着贮藏时间的延长,对照和MeJA处理桃果实PMTE和PGTE活性呈先升高后下降趋势,并且MeJA处理果实的酶活性明显低于对照果实(图4)。同时,PMTE活性高峰出现的时间不同,对照果实在贮藏第2 d出现,而MeJA处理果实推迟1 d出现(图4A),而PGTE活性高峰均出现在贮藏第3 d,对照果实的PGTE活性高出MeJA处理果实23.8%(图4B)。
2.3.3对果实β-葡萄糖苷酶活性的影响对照和MeJA处理果实在整个贮藏期间β-葡萄糖苷酶活性的变化趋势基本一致,均呈先升高后下降趋势,在贮藏第3 d达到峰值,但MeJA处理果实的酶活性明显低于对照果实(图5)。
3 讨论
本研究发现,离体条件下不同浓度的MeJA对P.expansum孢子萌发和菌丝生长具有显著的抑制作用。研究发现,离体条件下MeJA处理抑制了Colletotrichum acutatum、Botrytis cinerea、Monilinia fructicola、Alternaria alternata的孢子萌发和菌丝生长[7,9,13,22]。由此表明,MeJA对果蔬病原物具有直接的抑菌作用。本研究还发现,采后不同浓度MeJA处理能够有效抑制桃果实损伤接种P.expansum的病斑扩展,其中以100 μmol/L MeJA处理效果最佳。研究报道,采前200 μmol/L MeJA喷洒或采后浸泡处理均降低了损伤接种甜樱桃M.fructicola的病斑扩展[9],采前50 μmol/L MeJA喷洒降低了芒果果实贮藏期间炭疽病的发生和损伤接种C.gloeosporioides的病斑扩展[23]。采后10 μmol/L MeJA浸泡处理显著降低了枇杷果实损伤接种C.acutatum的发病率和病斑直径[13],而能够有效降低柑橘果实损伤接种P.digitatum的病情指数和病斑直径的MeJA浓度为100 μmol/L[24],降低番茄果实损伤接种B.cinerea的病斑直径的浓度为10 mmol/L[22]。以上结果表明,对于不同果实不同病害的防治,MeJA的有效浓度是不相同的,由于物种之间的生物学差异较大,因此在外源使用MeJA防治果蔬采后病害时,需要摸索最佳的浓度以获得良好的效果。
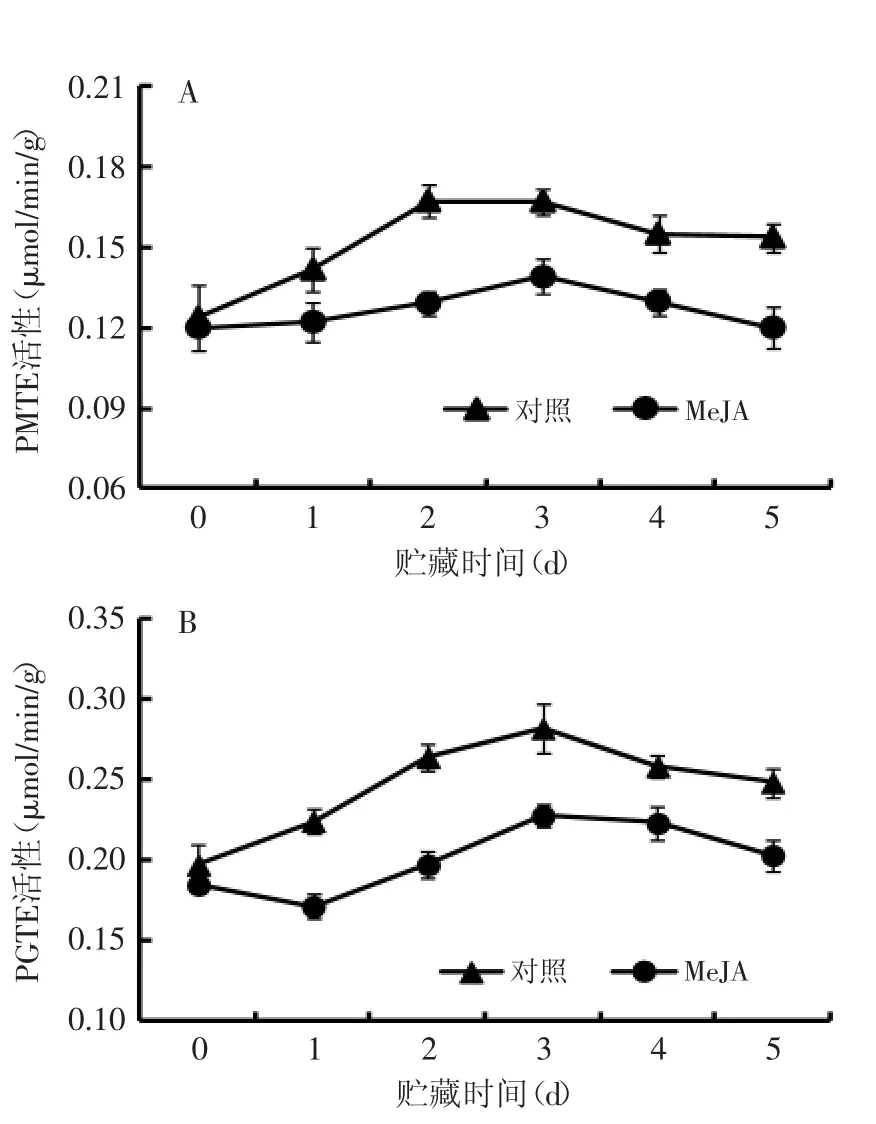
图4 采后MeJA处理对桃果实PMTE(A)和PGTE(B)活性的影响Fig.4 Effect of postharvest MeJA treatment on the activity of PMTE(A)and PGTE(B)in peach fruit
果实细胞壁主要由果胶物质、纤维素、半纤维素等物质构成,贮藏过程中这些物质的降解导致细胞壁中层结构变化,大量细胞壁结构丧失,从而引起果实的软化[25]。果胶物质是细胞壁中胶层的主要成分,阐明贮藏过程中果胶物质的变化及相关酶活性的变化对揭示桃果实软化机理具有重要意义。本实验发现,外源MeJA处理抑制了桃果实PME、PG、PGTE、PMTE和β-葡萄糖苷酶活性的升高,从而延缓了果实的软化,并由此提高了果实抗病性。PG是第一个被认为在果实软化过程中起作用的水解酶,随着果实的成熟,PG活性不断增加,本实验结果也证明了这一点。PG的作用底物是多聚半乳糖醛酸,它们在细胞内高度甲酯化,而甲酯化的多聚半乳糖醛酸只有在去甲酯化后才能被PG酶分解。本结果表明,贮藏过程中PME先逐渐升高后下降,且变化趋势与PG一致。外源MeJA处理抑制了果实PME和PG活性的升高。闫根柱等[26]研究发现,乙烯吸收剂(高锰酸钾)处理抑制了梨果实PME和PG活性的升高,使果胶物质降解受限,从而延缓了果实的软化。纤维素和半纤维素的降解与果实的软化也密切相关,其中纤维素酶活性的高低决定了这些物质的分解速度。
β-葡萄糖苷酶属于纤维素酶类,可水解非还原性末端的β-D-糖苷键,同时释放β-D-葡萄糖。本实验发现,桃果实贮藏后期β-葡萄糖苷酶活性明显升高,加速了果实的软化。同时,外源MeJA处理明显抑制了β-葡萄糖苷酶活性的升高。已有研究报道,低温贮藏、气调贮藏可明显抑制葡萄、桑果果实中纤维素酶的活性[27-28]。本研究探讨了外源MeJA处理对桃果实主要细胞壁降解酶活性的影响,初步确定了细胞壁降解酶在果实软化过程中发挥主要作用,并且果实软化的延缓与提高抗病性密切相关。但有关主要细胞壁降解酶的同工酶种类、在采后成熟衰老过程中的变化及MeJA对其酶量和活性的调控作用仍需进一步研究。
4 结论
离体条件下,MeJA对P.expansum孢子萌发和菌丝生长具有明显的抑制作用,外源MeJA处理能够有效控制桃果实青霉病的发生,并且抑制了果实细胞壁降解酶活性。由此表明,MeJA提高桃果实的抗病性与延缓果实软化有关,即延缓了细胞壁降解活性的升高。
[1]Liu H X,Jiang W B,Bi Y,et al.Postharvest BTH treatment induces resistance of peach(Prunus persica L.cv.Jiubao)fruit to infection by Penicillium expansum and enhances activity of fruit defense mechanisms[J].Postharvest Biology and Technology,2005,35:263-269.
[2]Tripathi P,Dubey N K.Exploitation of natural products as an alternative strategy to control postharvest fungal rotting of fruit and vegetables[J].Postharvest biology and Technology,2004,32(3):235-245.
[3]Droby S,Wisniewski M,Macarisin D,et al.Twenty years of postharvest biocontrol research:it is time for a new paradigm?[J]Postharvest biology and Technology,2009,52:137-145.
[4]李富军,张新华.果蔬采后生理与衰老控制[M].2004:41-42.
[5]Batool K,Khosrow M K,Mohammad J A.Effects of methyl jasmonate treatment on alleviation of cadmium damages in soybean[J].Journal of Plant Nutrition,2010,33:1016-1025.
[6]李灿婴,葛永红,朱丹实,等.采后茉莉酸甲酯处理对富士苹果青霉病和贮藏品质的影响[J].食品科学,2015,36(2):255-259.
[7]Chen J P,Zou X,Liu Q,et al.Combination effect of chitosan and methyl jasmonate on controlling Alternaria alternata and enhancing activity of cherry tomato fruit defense mechanisms[J]. Crop Protection,2014,56:31-36.
[8]Zhang H Y,Ma L C,Turner M,et al.Methyl jasmonate enhances biocontrol efficacy of Rhodotorula glutinis to postharvest blue mold decay of pears[J].Food Chemistry,2009,117:621-626.
[9]Yao H J,Tian S P.Effects of pre-and post-harvest application of salicylic acid or methyl jasmonate on inducing disease resistance of sweet cherry fruit in storage[J].Postharvest Biology and Technology,2005,35:253-262.
[10]Cao S F,Zheng Y H,Wang K T,et al.Effect of yeast antagonist in combination with methyl jasmonate treatment on postharvest anthracnose rots of loquat fruit[J].Biological Control,2009,50:73-77.
[11]Cao S F,Cai Y T,Yang Z F,et al.Effect of MeJA treatment on polyamine,energy status and anthracnose rot of loquat fruit[J]. Food Chemistry,2014,145:86-89.
[12]Tang W L,Zhu S J,Li L L,et al.Differential expressions of PR1 and chitinase genes in harvested bananas during ripening,and in response to ethephon,benzothiadizole and methyl jasmonate[J].Postharvest Biology and Technology,2010,57:86-91.
[13]Cao S F,Zheng Y H,Yang Z F,et al.Effect of methyl jasmonate on the inhibition of Colletotrichum acutatum infection in loquat fruit and the possible mechanisms[J].Postharvest Biology and Technology,2008,49:301-307.
[14]Sun D Q,Lu X H,Hu Y L,et al.Methyl jasmonate induced defense responses increase resistance to Fusarium oxysporum f. sp.cubense race 4 in banana[J].Scientia Horticulturae,2013, 164:484-491.
[15]Meng X H,Han J,Wang Q,et al.Changes in physiology and quality of peach fruits treated by methyl jasmonate under low temperature stress[J].Food Chemistry,2009,114:1028-1035.
[16]冯磊,郑永华,汪峰,等.茉莉酸甲酯处理对冷藏水蜜桃品质的影响[J].食品科学,2003,24(9):135-139.
[17]邓惠文,毕阳,葛永红,等.采后BTH处理及粉红单端孢(Trichothecium roseum)挑战接种对厚皮甜瓜果实苯丙烷代谢活性的诱导[J].食品工业科技,2013(1):323-326.
[18]范存斐,毕阳,王云飞,等.水杨酸对厚皮甜瓜采后病害及苯丙烷代谢的影响[J].中国农业科学,2012,45(3):584-589.
[19]杨志敏,毕阳,李永才,等.马铃薯干腐病菌侵染过程中切片组织细胞壁降解酶的变化[J].中国农业科学,2012,45(1):127-134.
[20]曹建康,姜微波,赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社.2007.
[21]Hagerman A E,Austin P J.Continuous spectrophotometric assay for plant pectin methyleasterase[J].Journal of Agricultural and Food Chemistry,1986(34):440-444.
[22]Zhu Z,Tian S P.Resistant responses of tomato fruit treated with exogenous methyl jasmonate to Botrytis cinerea infection[J]. Scientia Horticulturae,2012,142:38-43.
[23]弓德强,谷会,张鲁斌,等.杧果采前喷施茉莉酸甲酯对其抗病性和采后品质的影响[J].园艺学报,2013,40(1):49-57.
[24]Guo J,Fang W W,Lu H P,et al.Inhibition of green mold disease in mandarins by preventive applications of methyl jasmonate and antagonistic yeast Cryptococcus laurentii[J]. Postharvest Biology and Technology,2014,88:72-78.
[25]张鹏龙,陈复生,杨宏顺,等.果实成熟软化过程中细胞壁降解研究进展[J].食品科技,2010,35(11):62-66.
[26]闫根柱,赵迎丽,王亮,等.乙烯吸收剂对丰水梨果实软化和细胞壁代谢的影响[J].中国农学通报,2013,29(19):170-174.
[27]罗自生.MA贮藏对桑果细胞壁组分和水解酶活性的影响[J].果树学报,2003,20(3):214-217.
[28]陈发河,吴光斌,冯作山.葡萄贮藏过程中落粒与离区酶活性变化及植物生长调节物质的关系[J].植物生理与分子生物学学报,2003,29(2):133-140.
Effect of jasmonic acid methylester treatment on blue mould and cell wall degrading enzymes activities in peach fruit
LI Can-ying1,ZHANG Li-hua1,GE Yong-hong1,*,DONG Bo-yu2,QI Qian-ya2
(1.College of Food Science and Technology,Bohai University,Food Safety Key Lab of Liaoning Province;National&Local Joint Engineering Research Center of Storage,Processing and Safety Control Technology for Fresh Agricultural and Aquatic Products,Jinzhou 121013,China;2.College of Food Science and Engineering,Gansu Agricultural University,Lanzhou 730070,China)
Peach fruit were used as materials to study the effects of jasmonic acid methylester(MeJA)treatment on blue mould of peach fruit and mycelia growth and spore germination of Penicillium expansum to screen the optimal concentration.The effect of MeJA treatment on cell wall degrading enzymes activities were also investigated in this paper.The results indicated that 100 μmol/L MeJA was the best concentration to control blue mould of peach fruit,and significantly(p≤0.05)inhibited mycelia growth and spore germination of P.expansum.The results also showed that the activity of cell wall degrading enzymes including polygalacturonase(PG),pectin methylesterase(PME),pectin methyl-trans-eliminase(PMTE),polygalacturonic acid transeliminase(PGTE)and β-glucosidase were inhibited by 100 μmol/L MeJA treatment.In conclusion,postharvest MeJA inhibited blue mould of peach fruit was related to delay fruit soft.
jasmonic acid methylester(MeJA);cell wall degrading enzymes;peach fruit;blue mould
TS255.3
A
1002-0306(2015)20-0326-05
10.13386/j.issn1002-0306.2015.20.058
2015-02-02
李灿婴(1981-),女,硕士,助理实验师,研究方向:果蔬采后生物学与技术,E-mail:cora_51@163.com。
葛永红(1979-),男,博士,副教授,研究方向:果蔬采后生物学与技术,E-mail:geyh1979@163.com。
国家自然科学基金(31401554);甘肃省自然科学基金(1308RJZA247)。
——α-葡萄糖醛酸酶的研究进展*

