锂离子电池正极材料LiFeO2的研究进展
杨瑞明,张英杰,董 鹏,夏书标
(1.昆明理工大学材料与科学工程学院,云南昆明650093;2.曲靖师范学院物理与电子工程学院,云南曲靖650011;3.昆明理工大学冶金与能源工程学院,云南昆明650093)
LiCoO2是目前商用锂离子电池中应用最广泛的正极材料,但其价格昂贵且其中的钴对环境有害,促使人们研究开发新型正极材料。研究具有与LiCoO2相似岩盐结构的LiMO2(M=Fe,Ni,Mn等)材料成为研究热点。LiNiO2的合成条件比较苛刻而且安全性能差;LiMnO2虽然资源丰富,价格低廉且污染小,但是使用时容易发生Jahn-Teller效应致使容量快速衰减[1-2]。由于Fe是地球上资源最丰富且无毒的金属,LiFeO2作为一种LiMO2系列的正极材料,具有与LiCoO2相似的岩盐结构,已经成为人们广泛关注的正极材料之一。该材料具有较高的理论比容量,可达283 mAh/g,环境友好,成本低廉,有望成为最有潜力的下一代锂离子电池正极材料[3-5]。本文对LiFeO2的结构、制备方法、电化学性能、掺杂改性等进行了总结,并对其未来的发展方向和应用前景进行了展望。
1 LiFeO2的结构和性能特点
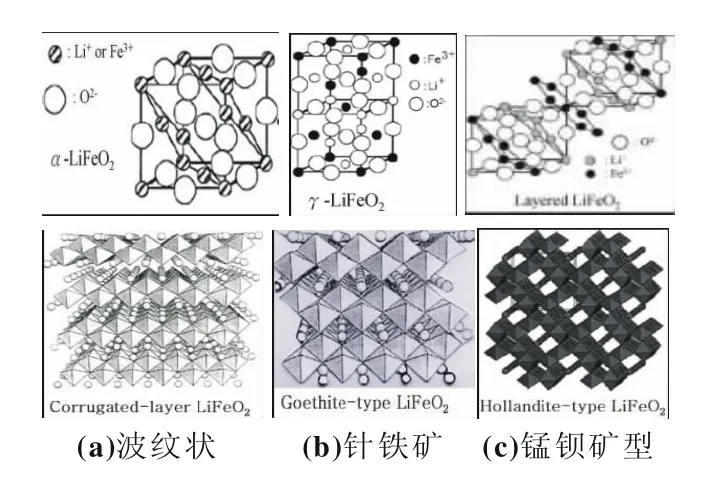
图1 不同晶体结构的LiFeO2
LiFeO2属于有序的α-NaFeO2岩盐结构,LiFeO2依据不同的制备方法,可以得到不同晶体结构的LiFeO2,如图1所示[6]。LiFeO2主 要的 存 在 形 式 有 :α-LiFeO2[7-12],β-LiFeO2[12-15],γ-LiFeO2[12-13],波纹状 LiFeO2[16-20],针铁矿 LiFeO2[21],锰钡矿型LiFeO2[22],四面体型t-LiFeO2[23]。α-LiFeO2属于Fm3m空间群,为阳离子无序的立方岩盐结构,其NaCl型晶体结构中的Li+与Fe3+共同占据晶格的顶角和面心位置,阻碍了Li+离子的扩散,导致Li+很难脱出和嵌入,致使容量不高。γ-LiFeO2属于I41/amd空间群,为四方结构,是由Li+与Fe3+在八面体位的有序化导致对称性由立方降低为四方所致,在这个有序化过程中会形成中间相β-LiFeO2。β-LiFeO2属C2/c空间群,属于中间过渡相。层状LiFeO2结构具有α-NaFeO2型层状结构的LiFeO2(R3m),阳离子有序排列,Li+与Fe3+交替占据在由O2-立方密堆积形成的八面体空位。波纹层状LiFeO2属Pmnm空间群,为正交晶体结构,O2-面心立方密堆积(CCP)排列,Li+与Fe3+对交替排列于阳离子层中,结构对称性降低。针铁矿型LiFeO2属于Pbnm空间群,与α-FeOOH结构相似,都是正交晶体结构。锰钡矿型LiFeO2属于I4/m空间群,为四方晶体结构,具有与β-FeOOH相似的晶体结构,LiFeO2中氧原子在中心的FeO6八面体构成了隧道结构。四面体型t-LiFeO2属于Pna21空间群,LiFeO2由LiO4和FeO4四面体组成,在O2-密堆积平面以Z字排列。
具有电化学活性的LiFeO2电化学性能比较特别,与Li-CoO2等传统正极材料不同,主要是其充放电反应机理不同,在充放电过程中,LiFeO2具有独特的首次充放电曲线,如图2所示[10]。首次充放电曲线与后续曲线显著不同,放电容量明显大于充电容量。首次充电电压平台高于4 V,对应于Fe3+/Fe4+氧化还原电对,首次放电时电压突降至3 V,随后的放电容量集中于1.5~3.5 V。对于导致这个特殊现象的原因,目前普遍的看法有两个:一是首次充电时发生了结构转变,Morales J.等[11]通过X射线衍射光谱法(XRD)研究发现,α-LiFeO2在首次充放电过程中伴随着Li+的脱嵌,同时发生了结构的变化,Li+脱出后发生了结构重组,少量的Fe3+被氧化成Fe4+,Fe4+从八面体的4a位迁移到四面体的8c位,阻挡了锂离子的扩散通道,在充电过程中,随着Li+的脱出,Fe3+逐渐被氧化成Fe4+;二是Fe4+很不稳定,极易和电解液反应从而被还原成Fe3+,故电极材料中只存在少量的Fe4+,Tabuchi M等[14]通过原位X射线吸收近边结构(XANES)进一步验证了脱嵌锂时发生的可逆嵌锂反应:Li1-xFeO2↔LiFeO2+xLi+e-,Li+在四面体8c位自由脱嵌;在放电过程中,Fe4+被还原成Fe3+,但Fe3+可以继续被还原成Fe2+,导致第一次的嵌锂量远远大于第一次的脱锂量,故首次放电容量大于充电容量。通过X射线光电子能谱(XPS)研究证实,在充电过程中有Fe4+和Fe3+生成,但是大部分的吸收峰与Fe3+的吸收峰一致,而在放电过程中明显地出现了Fe2+的吸收峰,说明对LiFeO2体系的主要贡献来自Fe2+/Fe3+氧化还原电对,而不是Fe3+/Fe4+电对[24]。
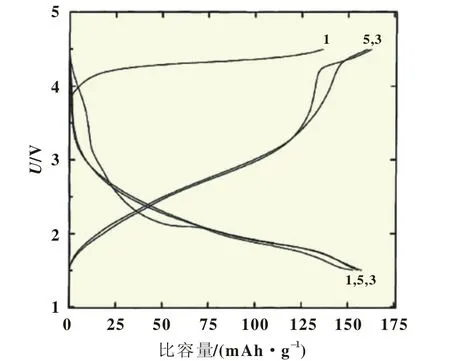
图2 LiFeO2的充放电曲线
2 LiFeO2的制备和改性
2.1 高温固相法
固相法是一种传统的制粉工艺,虽然存在效率低、易混入杂质等缺点,但是由于制备工艺简单、成本低廉,仍是合成锂离子正极材料常用的方法。对于LiFeO2材料,采用600℃以上的高温固相合成,一般只能得到无电化学活性的立方岩盐结构α-LiFeO2,而具有电化学活性的α-LiFeO2、针铁矿LiFeO2、锰钡矿型LiFeO2、波纹状LiFeO2都是在低温下合成。
Ualakhov V R等[10]采用高温固相法把Li2CO3与Fe2O3混合后826℃下空气气氛中锻烧24 h,得到非电化学活性的α-LiFeO2。Lee Y.T.等[25]在200~800℃的温度范围合成了化合物 LixFeyOz,XRD测试表明,在 200℃时 LixFeyOz是由α-LiFe5O8、β-LiFe5O8和少量的α-LiFeO2组成,电化学测试表明,在1.5~4.5 V该混合物的初始放电比容量达到了215 mAh/g,经过40次电化学循环后其容量保持率达到了95%。在800℃时得到单一相的α-LiFeO2,且在同样的测试条件下其放电比容量只有5 mAh/g。一方面是由于高温时颗粒聚集比较严重,颗粒粒径为700~800 nm,低温时颗粒分散则较好,粒径只有100~200 nm;另一方面是由于200℃时混合物中的LiFe5O8在10次循环后形成了四面体型LiFeO2,而四面体型的LiFeO2可能在循环过程中起到结构稳定的作用。
2.2 低温合成方法
合成LiFeO2材料的低温合成方法,工作温度一般在600℃以下,多数在200℃以下进行,主要的方法有:水热法、溶剂热法、低温固相法、离子交换法、低温熔盐法。如Morales J等[11]采用低温熔盐法,把α-FeOOH、LiNO3和LiOH的盐混合物(摩尔比为1∶2∶2)在空气中250℃煅烧3 h,得到α-LiFeO2正极材料,在1.5~4.5 V范围内放电比容量达150 mAh/g。Matsumura T.等[22]以LiOH·H2O和β-FeOOH为原料,在2-乙氧基乙醇中合成了h-LiFeO2,在1.5~4.5 V电压范围内,经过多次循环后其放电比容量仍能够保持150 mAh/g左右。隧道型h-LiFeO2结构中的孔道为Li+的扩散提供了良好的通道,保证其迅速地脱嵌,使电极材料表现出良好的电化学性能。
2.3 改性
为了解决LiFeO2材料循环过程易发现相变形成尖晶石相的LiFe5O8,从而导致容量衰减较快、不可逆容量大等问题,人们尝试用各种阳离子(如Mn,Ni,Co)掺杂,形成固熔体,通过调节不同的掺杂比例来改善其电化学性能。
Alcántara R等[26]用LiOH、Fe2O3和Co3O4在800℃下烧结24 h,制备得到LiCo0.9Fe0.1O2正极材料,阳离子无序度高,有1/3的Fe出现在Li位,Fe3+阻碍了Li+的扩散,导致极化增大,放电比容量小,仅为80 mAh/g,循环性能也差。Suresh P等[27]以NaFe0.9Co0.1O2为前驱体用离子交换法制备α-NaFeO2型层状LiFe0.9Co0.1O2正极材料,初始放电比容量可达205 mAh/g,经过30次循环,比容量保持在190 mAh/g,估计是掺杂的Co元素起到了稳定层状结构的作用,从而提高了循环性能。Lee Y S等[28]为了解决LiFeO2材料电压平台低、循环性能差等问题,用LiOH·H2O、γ-FeOOH和γ-MnOOH在350℃下低温烧结15 h,制备出LiFeO2-LiMnO2固熔体(含少量的β-LiFe5O8杂相),发现随着LiMnO2增多,循环性能提高,容量明显增大,含50% LiMnO2的样品放电比容量可达140 mAh/g。这表明LiMnO2的引入对提高电压平台、容量、循环性能是有利的。日本国家先进工业科学和技术研究所的Tabuchi M[29-32]对LiFeO2-Li2MnO3固熔体进行了深入的研究,并取得了较好的结果,他们采用低温共沉淀-水热反应-高温热处理的三步法制备工艺,即以Fe(NO3)3、MnCl2和LiOH为原料,低温(-10℃)进行氢氧化物共沉淀,然后通气鼓泡,再加入LiOH、氧化剂KClO3、矿化剂KOH于220℃进行水热反应,制备得到Li1+x(FeyMn1-y)1-xO2固熔体前驱体,然后将前驱体与LiOH在550~850℃间高温热处理得到最终产物。研究结果表明,当0.3≤y≤0.5时,产物的结构为富铁的纳米畴(立方岩盐结构)和富锰的纳米畴(层状岩盐结构)共生的两相结构,层状相越多,容量越高。研究结果表明,层状结构成分越多,材料粉体粒径越小,比表面积越大,Li/ (Fe+Mn)比越高,材料容量就越高。随着Fe量增加,初始容量在减小,然而由于抑制了由层状岩盐相向尖晶石相的转变,充放电效率和循环性得到改善。因此,严格控制 Li1+x-(FeyMn1-y)1-xO2固熔体材料的制备条件非常重要。其中当0.3≤y≤0.5时,850℃下热处理材料具有较高的比容量(>220 mAh/g)和良好的循环稳定性。
3 展望
LiFeO2材料因具有容量高、价格低廉、电化学性能好等优点,引起了很多研究人员的关注,但目前的研究尚不成系统,对材料结构及性能的研究尚不成熟,未来的研究重点包括:(1)对材料的结构进行深入研究,进一步掌握材料在循环过程中容量衰减的机理;(2)优化合成工艺,寻求合成纯相材料的最佳条件;(3)改善容量衰减快、循环性能差的缺点,如寻求合适的制备方法、调整金属阳离子掺杂类型及比例、材料表面包覆等;(4)在提高材料充放电容量和循环性能上寻求出路,如缩小材料粒径、提高颗粒比表面积、材料特殊形貌等;(5)设计与材料相匹配的高电压(5 V)电解液,以减少其中被还原的Fe4+。
因此,探索新的制备方法,改进工艺参数,调节固熔体成分和比例,对材料进行包覆和共混改性,进一步提高LiFeO2材料的稳定性和电化学性能仍是今后的研究热点。
[1] 吴宇平,万春荣,姜长印,等.锂离子二次电池[M].北京:化学工业出版社,2002:12-22.
[2] 郭炳焜.锂离子电池[M].长沙:中南大学出版社,2002:95-105.
[3] 王兆翔,陈立泉.锂离子电池正极材料研究进展[J].电源技术,2008,32(5):287-292.
[4] 钟盛文,徐宝和,吴甜甜,等.Mg2+掺杂对富锂锰基材料性能的影响[J].电源技术,2013,37(1):32-34.
[5] 杜柯,胡国荣.锂离子电池正极材料富锂锰基固溶体的研究进展[J].科学通报,2012,57(10):794-804.
[6] LI J G,LI J,LUO J,et al.Recent advances in the LiFeO2-based materials for Li-ion batteries[J].Int J Electrochem Sci,2011,6: 1550-1561.
[7] TABUCHI M,ADO K.Magnetic properties of metastable lithium iron oxides obtained by solvothermal hydrothermal reaction[J]. Solid State Chem,1998,141:554-556.
[8] 李建刚,罗晶,李建军,等.锂离子电池LiFeO2基材料研究进展[J].化工新型材料,2012,40(3):12-17.
[9]UALAKHOV V R,KURMAEV E Z,UHLENBROCK S,et al. Electronic structure of LiNiO2,LiFeO2and LiCrO2:X-ray photoelectron and X-ray emission study[J].Solid State Communications,1995,95(6):347-351.
[10] WANG X,GAO L,ZHOU F,et al.Large-scale synthesis of α-LiFeO2nanorods by low-temperature molten salt synthesis(MSS) method[J].Journal of Crystal Growth,2004,265:220-223.
[11] MORALES J,SANTOS-PENA J.Highly electroactive nanosized α-LiFeO2[J].Electrochemistry Communications,2007,9:2116-2120.
[12]BARRIGA C,BARRON V,GANCEDO R,et al.Lithium ferrite formation by precipitation from Fe(Ⅲ)solutions[J].Journal of Solid State Chemistry,1988,77(1):132-140.
[13]TABUCHI M,ADO K,SAKAEBE H,et al.Preparation of AFeO2(A=Li,Na)by hydrothermal method[J].Solid State Ionics,1995,79:220-226.
[14] TABUCHI M,TSUTSUI S,MASQUELIER C,et al.Effect of canon arrangement on the magnetic properties of lithium ferrites (LiFeO2):prepared by hydrothermal reaction and post-annealing method[J].Journal of Solid State Chemistry,1998,140:159-167.
[15]SHIRANE T,KANNO R,KAWAMOTO Y,et al.Structure and physical properties of lithium iron oxide,LiFeO2,synthesized by ionic exchange reaction[J].Solid State Ionics,1995,79:227-233.
[16] LEE Y S,SATO S,TABUCHI M,et al.Structural change and capacity loss mechanism in orthorhombic Li/LiFeO2system during cycling[J].Electrochemistry Communications,2003,5:549-554.
[17] LEE Y S,SATO S,SUN Y K,et al.A new type of orthorhombic LiFeO2with advanced battery performance and its structural change during cycling[J].Journal of Power Sources,2003,119/121:285-289.
[18] LEE Y S,YOON C S,SUN Y K,et al.Synthesis of nano-crystalline LiFeO2material with advanced battery performance[J].Electrochemistry Communications,2002,4:727-731.
[19] BORDET-LE G,DENIARD P,LECERF A,et al.Intrinsic instability of Fe4+in electrochemically oxidized ramsdellite and orthorhombic Li1-xHxFeO2[J].Journal of Materials Chemistry,1999,9:1127-1134.
[20]KANNO R,SHIRANE T,INABA Y,et al.Synthesis and electrochemical properties of lithium iron oxides with layer-related structures[J].Journal of Power Sources,1997,68:145-152.
[21] SAKURAI Y,ARAI H,YAMAKI J.Preparation of electrochemically active α-LiFeO2at low temperature[J].Solid State Ionics,1998,113/115:29-34.
[22]MATSUMURA T,KANNO R,INABA Y,et al.Synthesis,structure and electrochemical properties of a new cathode material,LiFeO2,with a tunnel structure[J].Journal of Electrochemistry Society,2002,149:1509-1513.
[23]ARMSTRONG A R,TEE D W,BRUCE P G.Synthesis of tetrahedral LiFeO2and its behavior as a cathode in rechargeable lithium batteries[J].J Am Chem Soc,2008,134:3554-3559.
[24] 赵春松,赵煜娟,孙国平.锂离子电池正极材料LiFeO2的研究进展[J].材料导报,2011,25:290-293.
[25] LEE Y T,YOON C S,SUN Y K.Synthesis and structural changes of LixFeyOzmaterial prepared by a solid-state method[J].J Power Sources,2004,134(1):88-94.
[26] ALCÁNTARA R,JUMAS J C,LAVELA P,et al.X-ray diffraction,57Fe MÖssbauer and step potential electrochemical spectroscopy study of LiFeyCo1-yO2compounds[J].Journal of Power Sources,1999,81/82:547-553.
[27]SURESH P,SHUKLA A K,MUNICHANDRAIAH N.Synthesis and characterization of LiFeO2and LiFe0.9Co0.1O2as cathode materials for Li-ion cells[J].Journal of Power Sources,2006,159:1395-1400.
[28] LEE Y S,SATO S,SUN Y K,et al.Preparation of Mn-substituted LiFeO2:a solid solution of LiFeO2and LixMnO2[J].Elec trochemistry Communications,2003,5:359-364.
[29] TABUCHI M,NAKASHIMA A,ADO K,et al.The effects of preparation condition and dopant on the electrochemical property for Fe-substituted Li2MnO3[J].Journal of Power Sources,2005,146:287-293.
[30] TABUCHI M,NAKASHIMA A,ADO K,et al.Heat treatment effect on phase stability,cation distribution,chemical composition and electrochemical behavior for Fe-substituted Li2MnO3[J]. Chemistry of Materials,2005,17:4668-4677.
[31]TABUCHI M,NABESHIMA A,ADO K,et al.Material design concept for Fe-substituted Li2MnO3-based positive electrodes[J]. Journal of Power Sources,2007,174:554-559.
[32] TABUCHI M,NABESHIMA A,TAKEUCHI T,et al.Fe content effects on electrochemical properties of Fe-substituted Li2MnO3positive electrode material[J].Journal of Power Sources,2010,195:834-844.

