滞育七星瓢虫的代谢适应与抗寒性评价
任小云,张礼生,齐晓阳,安 涛,韩艳华,陈红印
(中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京 100081)
七星瓢虫Coccinella septempunctata 是优良的天敌昆虫,捕食蚜、蚧等农林害虫,作为商品被扩繁与应用(John et al.,1998;张礼生等,2014)。该虫具有显著的滞育现象,低温短日照可诱发其进入滞育,对滞育七星瓢虫营养物质储存、抵御逆境胁迫能力的研究,有助于深入探索滞育机理,指导滞育贮存,延长天敌产品货架期(张礼生等,2009,2014)。滞育是部分昆虫适应不良环境而形成的暂时停止发育的遗传特性 (Hahn and Denlinger,2007;Denlinger et al.,2014),对昆虫种群维持具有重要意义。滞育期间,昆虫不取食或很少取食,通过特殊的代谢调节,使体内重要生物活性物质的储存与利用发生改变(Hahn and Denlinger,2007),减慢体内代谢速率(Watanabe and Tanaka,1998;Denlinger,2002),减少能量消耗,使昆虫在逆境胁迫中得以存活 (Goto et al.,2001;Denlinger,2002)。如以末龄幼虫滞育的棉红铃虫Pectinophora gossypiella,其脂肪含量比非滞育个体高50%;滞育库蚊Culex.pipiens的脂肪和碳水化合物比非滞育个体高出近2 倍(Hahn and Denlinger,2007),这为昆虫在不利环境中的能量需求提供了保障。此外,滞育期间昆虫通过积累多元醇、糖类、蛋白质等抗冻保护物质,增强昆虫的过冷却能力,提高抗逆性(丁惠梅 等,2011;Li et al.,2014)。过冷却 点(supercooling point,SCP)是温度在逐渐降低的过程中昆虫体液开始结冰时对应的温度(Li et al.,2014),与其他生理指标(如体重、含水量、抗冻蛋白、脂肪等)的关系可以说明昆虫的耐寒性(郅伦山,2005;张珺等,2005;郅伦山等,2007;薛冬等,2014;Xu et al.,2015)。
滞育期间,昆虫生化物质的变化是决定昆虫能否成功度过不利环境的因素之一,过冷却点是衡量昆虫耐寒性的重要指标。滞育昆虫有海藻糖积累型和糖原积累型两种能量积累形式,七星瓢虫属哪种尚不明确。针对七星瓢虫正常发育、滞育及滞育解除个体的过冷却点和生化物质进行测定,对七星瓢虫的滞育类型做出判断,根据过冷却点测定结果及能量储存方式可对七星瓢虫的扩散、保护、利用及人工饲料的研发提供新思路,并可对七星瓢虫的滞育机制的揭示进行补充。
1 材料与方法
1.1 供试虫源及处理方法
七星瓢虫采自中国农科学院麦田,其饲养方法参照王伟(2013)。七星瓢虫卵、幼虫、蛹的饲养条件一致,置于人工气候箱中饲养,参数设置为温度24℃±1℃、相对湿度70% ±10%、光周期L16 ∶D8。
正常发育组成虫饲养条件与卵、幼虫、蛹饲养条件一致,待成虫产卵后用于后续实验。
滞育组成虫的饲养方法是,将羽化后的成虫配对,放入人工气候箱中饲养,其参数设置分别为温度18℃±1℃、相对湿度70% ±10%、光周期L10 ∶D14。滞育判断方法参考王伟(2013)。滞育雌虫用于后续试验。
滞育解除组的饲养方法是,将滞育40 d 未产卵个体置于对照组成虫饲养的条件下,以产卵作为滞育解除的判断标准。将产卵后的雌成虫用于后续试验研究。
大豆蚜饲养方法参考忻亦芬(1982)。
1.2 试验方法
1.2.1 含水量和脂肪含量的测定
分别取各处理下的雌成虫10 头,用蒸馏水清洗后,再用滤纸擦干,于精确度为0.1 mg的电子天平上称各处理下成虫的重量,记为湿重(wet weight,WW);然后,置于60℃干燥箱中48 h 烘至恒重,称其重量,记为干重(dry weight,DW)。成虫含水量为:(WW-DW)/WW×100。重复3 次。
分别取各处理下雌成虫10 头,单头称重,处理方法同含水量测定方法相同,记录单头雌虫的湿重(WW)及干重(DW)。脂肪提取方法参考杨光平(杨光平,2013)。重复3 次。
1.2.2 总糖、海藻糖、糖原含量的测定
参照仵均祥(2004)、孔璐(2013)的方法,稍有改进。
标准曲线制作参考孔璐(2013),重复3 次。
总糖的提取:取3个不同处理下的雌成虫各10 头,用蒸馏水洗净后擦干,单头至于EP 管中称重。加入100μL 10% 三氯乙酸溶液,用圆头玻璃棒研磨,充分匀浆,然后用400μL 10% 三氯乙酸溶液分两次冲洗玻璃棒,振荡,充分抽提;充分混匀后5000 rpm 离心10 min,将上清液转移至2 mL的离心管中,向残渣中再次加入500μL 10%三氯乙酸溶液抽提一次,离心,合并上清液并混合均匀。取200μL 总糖提取液,加入800μL 蒸馏水混匀后,用于总糖测定。每个处理重复3 次
海藻糖、糖原的提取:取各处理下雌成虫各10 头,用蒸馏水清洗后擦干,单头置于EP 管中称重。加入50μL 10% 三氯乙酸溶液,用圆头玻璃棒研磨,充分匀浆,用100μL 10% 三氯乙酸分两次冲洗玻璃棒。充分混匀后,5000 rpm 离心10 min,将上清液转移至2 mL 离心管中。沉淀再用50μL 10% 三氯乙酸抽提1 次,离心,合并上清液。加入无水乙醇800μL,置于4℃冰箱中16 h,保留上清、弃沉淀。10000 rpm 离心20 min,将上清液转移至另一2 mL 离心管中;取200μL 上清液于另一10 mL 离心管中,加入400μL 0.15 mol/L H2SO4,混匀后沸水浴10 min;冷却至室温,加入400μL 30% KOH,混合均匀后沸水浴10 min,冷却至室温待测海藻糖用。向沉淀中,加入1 mL MilliQ 水,90℃水浴溶解;将溶液转移至10 mL 离心管中待测糖原用。后续处理同标准曲线制作过程相同。每个处理重复3 次

1.2.3 山梨醇、甘油含量的测定
山梨醇、甘油含量的提取和测定参考李玉艳(2011)的方法。每个处理以10 头雌虫为一次重复,重复3 次。
1.2.4 总蛋白含量的测定
总蛋白提取方法参考成卫宁等(2008),采用Bradford 法测定。每次实验取单头雌成虫为一次重复,各处理重复30 次。
1.2.5 过冷却点的测定
七星瓢虫过冷却点的测定使用SUN-II 型智能昆虫过冷却点测定仪。每次试验以单头雌成虫为一次重复,正常发育组为25 次重复,滞育组为24 次重复,滞育解除组为20 次重复。
1.3 数据处理
利用统计软件SAS 9.3 ANOVA 程序对七星瓢虫在不同条件下的SCP、含水量、总糖、海藻糖、糖原、甘油、山梨醇及总蛋白含量进行方差分析,差异显著性检验采用Duncan's 新复极差法。
2 结果与分析
2.1 滞育不同阶段七星瓢虫含水量的比较
滞育对七星瓢虫的含水量有显著影响(图1)。在滞育条件下,七星瓢虫含水量为58.11% ±6.55%,显著低于对照组68.49% ±2.26%和滞育解除组65.84% ±4.02% (F=8.15,P<0.01)滞育解除后,七星瓢虫含水量增加,为七星瓢虫滞育解除后生长、繁殖提供适宜的内环境。
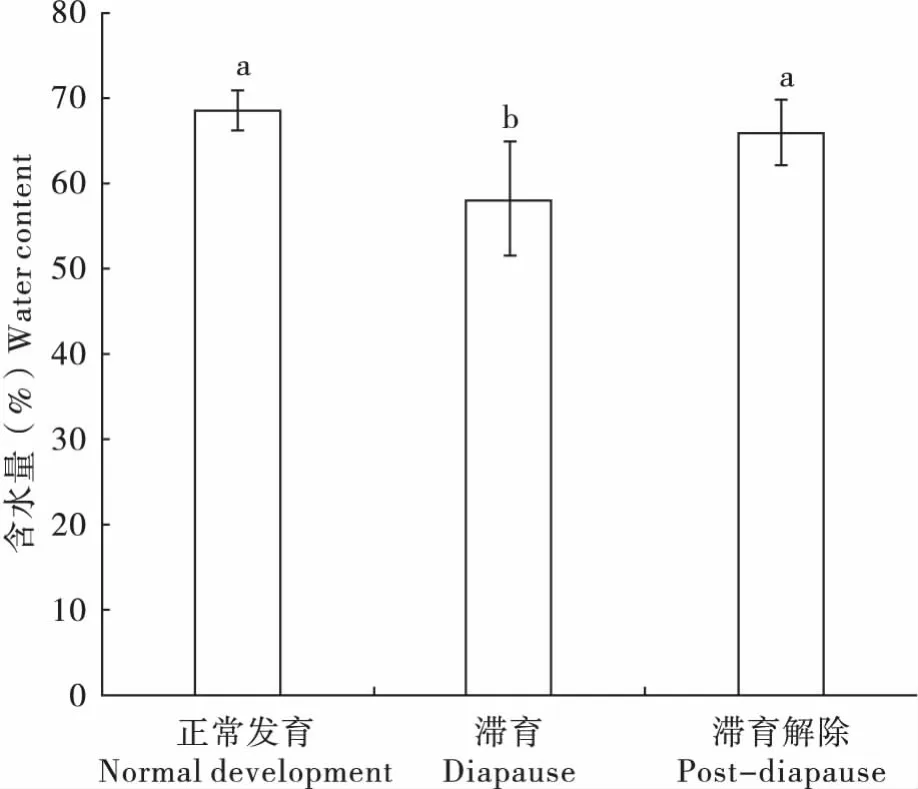
图1 正常发育、滞育及滞育解除七星瓢虫含水量Fig.1 Water content of normal development,diapause and post-diapause Coccinella septempunctata
2.2 滞育不同阶段七星瓢虫脂肪含量比较
七星瓢虫在3 种不同处理下的脂肪含量差异如图2 所示,对照组80.04 ±15.82μg/mg、滞育组173.66 ± 19.01μg/mg、滞育解除组83.83 ±12.54μg/mg。滞育对脂肪的积累有显著影响(F=8.48,P<0.01),滞育解除组与对照组脂肪含量差异不显著,说明七星瓢虫在滞育期间储存了大量脂肪,滞育解除后脂肪被分解转化为其它营养物质。
2.3 滞育不同阶段七星瓢虫总糖、海藻糖、糖原含量比较

图2 正常发育、滞育及滞育解除个体脂肪含量Fig.2 Lipid in normal development,diapause and post-diapause Coccinella septempunctata
七星瓢虫滞育期间总糖、糖原含量分别为10.60 ±0.54μg/mg、8.72 ±0.24μg/mg,正常发育组总糖、糖原含量分别为3.12 ±0.21μg/mg、1.28 ±0.62μg/mg,滞育解除组总糖、糖原含量为3.09 ±0.12μg/mg、1.47 ±0.22μg/mg。滞育组总糖和糖原含量显著高于正常发育组及滞育解除组,有极显著性差异(F=46.57,P=0.0006;F=114.25,P<0.0001);总糖和糖原在滞育组、滞育解除组之间无显著性差异。海藻糖含量在三组中的差异不显著(F=0.79,P=0.4946),正常发育组、滞育组及滞育解除组的海藻糖含量分别为1.57 ±0.10μg/mg、1.31 ±0.27μg/mg、1.56±0.41μg/mg (图3)。

图3 正常发育、滞育及滞育解除七星瓢虫的总糖、海藻糖、糖原Fig.3 Total sugars,trehalose and glycogen in normal development,diapause and post-diapause Coccinella septempunctata
2.4 滞育不同阶段七星瓢虫甘油、山梨醇含量比较
滞育期间甘油(1.74 ±0.50μg/mg)含量低于正常发育组(2.10 ±0.84μg/mg)及滞育解除组(2.38 ±0.46μg/mg),滞育组山梨醇(9.84 ±3.02μg/mg)低于正常发育组(16.57±4.10μg/mg)和滞育解除组(12.54 ±2.77μg/mg)。三组中甘油、山梨醇差异均不显著(F=1.33,P=0.3004;F=1.69,P=0.2387)。推测甘油、山梨醇在七星瓢虫滞育期间转化为脂肪和(或)糖原;滞育解除后,脂肪、糖原转化为其它生命物质,甘油、山梨醇含量逐渐上升(图4)。
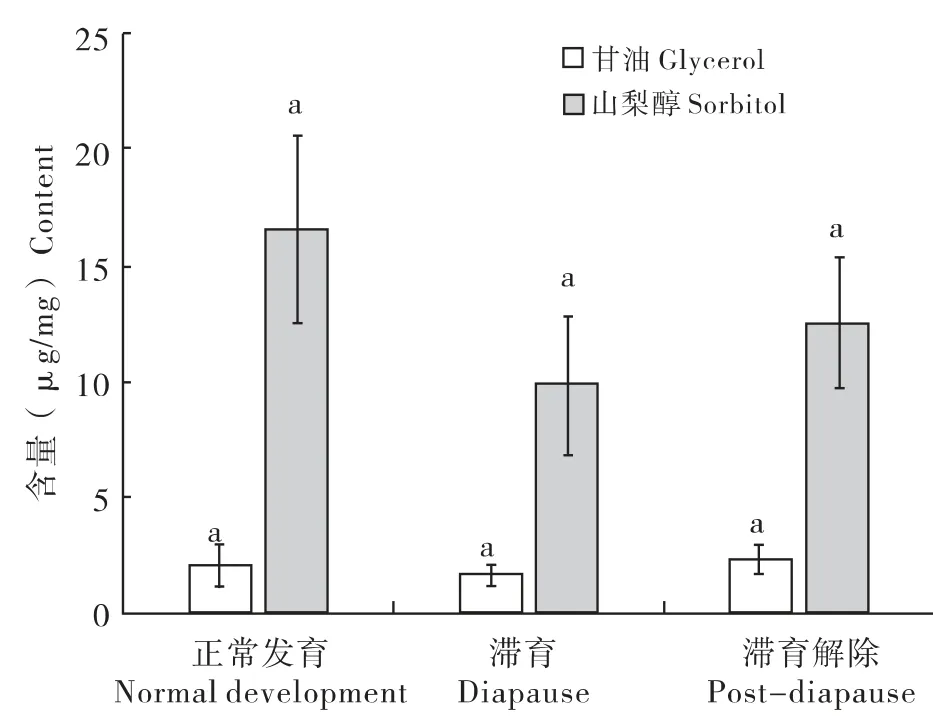
图4 正常发育、滞育及滞育解除七星瓢虫的甘油、山梨醇Fig.4 Glycerol and sorbitol in normal development,diapause and post-diapause Coccinella septempunctata
2.5 滞育不同阶段七星瓢虫总蛋白含量比较
七星瓢虫在正常发育、滞育、滞育解除条件下的总蛋白质含量的测定结果如图5 所示。滞育条件下的总蛋白含量(49.20 ±3.80μg/mg)显著低于正常发育组(71.02 ±6.15μg/mg)和滞育解除组 (69.45 ± 4.66μg/mg)(F=46.57,P=0.0006),正常发育组和滞育解除组之间无显著差异,说明滞育期间七星瓢虫的活动能力减弱,主要表现在卵巢发育被完全抑制;而滞育解除后的个体卵巢发育,体内总蛋白的表达量增加,恢复至正常发育状态。
2.6 滞育不同阶段七星瓢虫过冷却点比较
过冷却点的变化情况与含水量变化情况一致(图6),滞育组SCP 较正常组低近2℃,而滞育解除组SCP 较滞育组高近1℃,由此可以看出滞育期间的低温驯化能提高七星瓢虫的耐寒性。

图5 正常发育、滞育及滞育解除七星瓢虫的总蛋白Fig.5 Proteins in normal development,diapause and post-diapause Coccinella septempunctata

图6 正常发育、滞育及滞育解除七星瓢虫过冷却点Fig.6 SCP changes in normal development,diapause and post-diapause Coccinella septempunctata
3 结论与讨论
滞育通常被描述为低代谢的、抗逆能力增强的缓慢发育状态 (Ragland et al.,2010;Zhang et al.,2011),主要体现在昆虫的活动能力减弱、体内发生了一系列的生理生化变化 (Tauber and Tauber,1976;Hodek,2002),如热休克蛋白表达量和表达模式发生变化(Rinehart et al.,2007),脂肪、糖原、储存蛋白表达增加(Watanabe and Tanaka,1998;Papanastasiou et al.,2011)等。在滞育期间昆虫必须储存充足的营养物质,供其滞育期间存活所需的能量来源及滞育解除后的发育,这些营养物质主要包括脂肪、碳水化合物、氨基酸及其他必需的小分子营养物质,如维生素、矿物质等(Hahn and Denlinger,2011)。滞育的昆虫进入了一种可选择的发育途径,减慢了它们的发育速率,这些营养物质的代谢方式为该发育途径所需(Koštál,2006;Hahn and Denlinger,2011),如滞育期间含水量降低,糖原、脂肪等冷冻保护物质含量增加,提高了昆虫的耐寒性。
滞育期间,昆虫的含水量低于非滞育个体(Danks,2000)。体内含水量的降低,一方面会增加体内溶质浓度,减少因低温产生晶核造成的危害,提高其耐寒能力 (张拥军,2007;唐斌等,2014),维持内环境的稳定性;另一方面,水是生命活动的载体,含水量的降低减慢了昆虫的活动及昆虫体内的新陈代谢水平,有利于昆虫在滞育期间的存活。本研究中,七星瓢虫在滞育条件下含水量显著下降,降低了七星瓢虫的水化作用及新陈代谢速率;过冷却点降低表明七星瓢虫的耐寒性增强,含水量的降低对瓢虫耐寒性的增强有一定作用,与郅伦山等(2007)的研究一致;滞育的解除需要一定的湿度,如果水分缺少滞育持续的时间会延长(Lees,1956),因此七星瓢虫需要大量水分辅助其打破滞育,恢复正常的生长、繁殖,含水量显著提高(65.84% ±4.02%)。滞育解除个体的过冷却点较正常发育组降低,表明滞育的冷驯化可以提高七星瓢虫的耐寒性。
七星瓢虫滞育期间的总糖、糖原、脂肪含量显著升高,海藻糖、甘油、山梨醇含量降低不显著。糖原和脂肪是昆虫主要营养物质的储存形式(Hahn and Denlinger,2007;Arrese and Soulages,2010;Vukašinovic'et al.,2013),Zygaena trifolii 滞育期间储存了大量的糖原和脂肪,在滞育期间逐渐被利用(Wolfgang et al.,1995);欧洲玉米螟Ostrinia nubilalis 滞育个体的脂肪中含有大量的不饱和脂肪酸,一方面为欧洲玉米螟提供了能量来源,另一方面作为抗冻保护剂提高欧洲玉米螟的耐寒性(Vukašinovic'et al.,2013)。海藻糖是昆虫血糖的主要成分,是昆虫体内物质循环的转运形式(王荫长,1994)。一些昆虫如大斑芫菁Mylabris phalerata (朱芬等,2008)、麦红吸浆虫Sitodiplosis mosellana (仵均祥等,2004)、梨小食心虫Grapholitha molesta (郭婷婷等,2013)、烟蚜茧蜂Aphidius gifuensis (李玉艳,2011)等在滞育期间海藻糖含量高于非滞育个体,提高了昆虫体液的血糖浓度,其功能是作为抗冻保护剂增强昆虫的抗逆能力,而不是营养物质的储存方式(Hahn and Denlinger,2007)。七星瓢虫在滞育期间甘油、山梨醇、海藻糖含量下降不明显,有可能是作为前体物质为脂肪和(或)糖原的合成提供原料;而脂肪、糖原则作为营养物质的储存库,为七星瓢虫滞育期间及滞育解除后的发育提供能量。滞育七星瓢虫蛋白质组学研究表明,滞育期间七星瓢虫代谢速率显著降低,促进了脂肪的转运与贮存(刘遥,2014);Phospoglyceromutase 在七星瓢虫滞育期间上调表达,推测该虫在滞育期间糖异生速率加快,进而促进了糖原的合成(任小云等,2014),与本研究的脂肪、糖原研究结果相符。Hayakawa 和Chino (1982)提出滞育昆虫的糖醇积累方式至少可分为两种:糖原积累型和海藻糖积累型。根据分析结果,我们推断七星瓢虫滞育属于糖原积累型。七星瓢虫在滞育期间总糖含量显著升高,有可能是小分子糖类含量较高,在滞育期间瓢虫的抗寒性增强起着重要作用;有研究表明在滞育、低温等不利环境下生物体内不饱和脂肪酸的含量升高 (Maryam et al.,2007;Vukašinovic'et al.,2013;易杰群等,2015),作为抗冻保护剂保证生物体内环境的稳定性,本研究发现七星瓢虫滞育脂肪含量是正常发育及滞育解除个体的2 倍,推测有可能是不饱和脂肪酸含量升高,且不饱和脂肪酸作为主要的抗冻保护剂,该结论仍需进一步验证。
蛋白质是生命活动的主要承担者。在已研究的滞育昆虫中,其蛋白质含量主要呈下降趋势,如烟蚜茧蜂在滞育期间总蛋白含量随着滞育深度的增加逐渐下降(李玉艳,2011),中华通草蛉Chrysoperla sinica 滞育个体总蛋白含量显著高于非滞育个体(许永玉,2001);但在某些种类中,如马铃薯甲虫Leptinotarsa decemlineata 滞育个体蛋白质含量较非滞育个体高(de Kort,1990)。在本研究中,七星瓢虫滞育期间总蛋白较正常发育及滞育解除后个体的总蛋白含量低,说明七星瓢虫在滞育期间生命活动减弱。前期研究表明,七星瓢虫以成虫滞育,其卵巢发育程度低、卵巢中无卵黄沉积,属于卵巢发育被完全抑制型(王伟等,2011),进一步说明七星瓢虫在滞育期间生命活动减弱,营养物质的代谢速率减慢。
对七星瓢虫滞育耐寒性及营养物质储存的研究,有利于我们了解七星瓢虫的扩散分布情况和滞育机制,为我们保护和充分利用该天敌昆虫提供了理论依据。
对七星瓢虫正常发育、滞育及滞育解除后个体的生化物质变化及过冷却点的研究表明,滞育诱发七星瓢虫发生显著的代谢适应,蛋白质含量显著降低,抑制新陈代谢进程;糖脂含量显著升高,保障了七星瓢虫滞育维持及解除后发育的能量需求;七星瓢虫滞育属糖原积累型;滞育个体过冷却点大幅下降,耐寒性显著提升;且经过滞育的低温驯化后,滞育解除个体耐寒性增强,这对七星瓢虫的人工释放范围及迁飞、扩散提供了参考。
References)
Arrese EL,Soulages JL.Insect fat body:Energy,metabolism,and regulation [J].Annual Review of Entomology,2010,55:207-225.
Cheng WN,Li YP,Li JJ,et al.Protein contents and electrophoresis patterns of the pre-diapause,diapause and post-diapanse larvae in the wheat blossom midge,Sitodiplosis mosellana Gehin [J].Acta Phytophylacica Sinica,2008,35 (2):155-159.[成卫宁,李怡萍,李建军,等.小麦吸浆虫滞育前后和滞育期蛋白质含量及其电泳分析[J].植物保护学报,2008,35 (2):155-159]
Danks HV.Dehydration in dormant insects [J].Journal of Insect Physiology,2000,46 (6):837-852.
Dekort CAD.Mini-review thirty-five years of diapause research with the Colorado potato beetle [J].Entomologia Experimentalis et Applicata,1990,56:1-13.
Denlinger DL.Regulation of diapause [J].Annual Review of Entomology,2002,47:93-122.
Denlinger DL,Peter A.Armbruster:Mosquito diapause [J].Annual Review of Entomology,2014,59:73-93.
Ding HM,Ma G,Wu SA,et al.A literature review on changes of small molecules of diapause insects during overwintering period [J].Chinese Journal of Applied Entomology,2011,4:1060-1070.[丁惠梅,马罡,武三安,等.滞育昆虫小分子含量变化研究进展[J].应用昆虫学报,2011,4:1060-1070]
Goto M,Li Y,Kayaba S.Cold hardiness in summer and winter diapause and post-diapause pupae of the cabbage armyworm,Mamestra brassicae L.under temperature acclimation [J].Journal of Insect Physiology,2001,47 (7):709-714.
Guo T,Ling F,Zhang SY,et al.The super-cooling ability and biochemical substances in diapausing and non-diapausing larvae of Grapholitha molesta (Busck)(Lepidoptera:Tortricidae) [J].Journal of Applied Entomology,2013,6:1514-1518.[郭婷婷,凌飞,张顺益,等.梨小食心虫滞育与非滞育幼虫过冷却能力与体内主要生化物质含量[J].应用昆虫学报,2013,6:1514-1518]
Hahn DA,Denlinger DL.Meeting the energetic demands of insect diapause:Nutrient storage and utilization [J].Journal of Insect Physiology,2007,53 (8):760-773.
Hahn DA,Denlinger DL.Energetics of insect diapause [J].Annual Review of Entomology,2011,56:103-121.
Hayakawa Y,Chino H.Phosphofructokinase as a possible key enzyme regulating glycerol ortrehalose accumulation in diapausing insects[J].Insect Biochemistry,1982,12 (6):639-642.
Hodek I.Controversial aspects of diapause development [J].European Journal of Entomology,2002,99:163-173.
John JO,Timothy JK.Predaceous coccinellidae in biological control[J].Annual Review of Entomology,1998,43 (1):295-321.
Kong L.PopulationFitness and Physiological Metabolism Mechanisms of Ophraella communa Lesage (Coleoptera:Chrysomelidae)under Sub-optimal Low Temperature [D].Beijing:Chinese Academy of Agricultural Sciences,2013.[孔璐.亚适宜低温下广聚萤叶甲适合度及生理代谢[D].北京:中国农业科学院,2013]
Koštál V.Eco-physiological phases of insect diapause [J].Journal of Insect Physiology,2006,52 (2):113-127.
Lees AD.The physiology and biochemistry of diapause [J].Annual Review of Entomology,1956,1:1-16.
Li YY,Zhang LS,Zhang Q,et al.Host diapause status and host diets augmented with cryoprotectants enhance cold hardiness in the parasitoid Nasonia vitripennis [J].Journal of Insect Physiology,2014,70:8-14.
Li YY.Temperature and Photoperiodic Response of Diapause Induction an Diapause Physiology in Aphidius gifuensis Ashmead [D].Beijing:Chinese Academy of Agricultural Sciences,2011.[李玉艳.烟蚜茧蜂滞育诱导的温光周期反应及滞育生理研究[D].北京:中国农业科学院,2011]
Liu Y,Zhang LS,Chen HY,et al.Differential expression of malate dehydrogenase and isocitrate dehydrogenase in diapaused ladybird,Coccinella septempunctata L.[J].Chinese Journal of Biological Control,2014,30 (5):593-599.[刘遥,张礼生,陈红印,等.苹果酸脱氢酶与异柠檬酸脱氢酶在滞育七星瓢虫中的差异表达[J].中国生物防治学报,2014,30 (5):593-599]
Maryam A,Saeid M,Mohsen B.Seasonal changes of fatty acid ompositions in overwintering larvae of rice stem borer,Chilo suppressalis (Lepidoptera:Pyralidae)[J].Journal of Asia-Pacific Entomology,2007,10 (1):33-38.
Papanastasiou SA,Nestel D,Diamantidis AD,et al.Physiological and biological patterns of a highland and a coastal population of the European cherry fruit fly during diapause [J].Journal of Insect Physiology,2011,57 (1):83-93.
Ragland GJ,Denlinger DL,Hahn DA.Mechanisms of suspended animation are revealed by transcript profiling of diapause in the flesh fly [J].Proceedings of the National Academy of Sciences,2010,107 (33):14909-14914.
Ren XY,Qin XY,Jiang S,et al.Differential expression and function of glucose metabolic enzyme in diapausing ladybird,Coccinella septempunctata L.In:Construction of Ecological Civilization and Green Plant Protection [C].Beijing:China Agricultural Science and Technology Press,2014,536.[任小云,齐晓阳,蒋莎,等.滞育七星瓢虫糖代谢调控酶的差异表达及其功能.见:生态文明建设与绿色植保[C].北京:中国农业科学技术出版社,2014,536]
Rinehart JP,Li A,Yocum GD,et al.Up-regulation of heat shock proteins is essential for cold survival during insect diapause [J].Proceedings of the National Academy of Sciences of the United States of America,2007,104 (27):11130-11137.
Tang B,Lin QQ,Wu MJ,et al.The physiological regulation research of hardy proteins and induce insect 's cold-resistance by cold acclimation [J].Journal of Environmental Entomology,2014,36 (5):805-813.[唐斌,林青青,邬梦静,等.抗寒类蛋白与冷驯化诱发昆虫耐寒的生理调节研究[J].环境昆虫学报,2014,36 (5):805-813]
Tauber MJ,Tauber CA.Insect seasonality:Diapause maintenance,termination and postdiapause development [J].Annual Review of Entomology,1976,21:81-107.
Vukašinovic' EL,Pond DW,Worland MR,et al.Diapause induces changes in the composition and biophysical properties of lipids in larvae of the European corn borer,Ostrinia nubilalis (Lepidoptera:Crambidae) [J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2013,165 (4):219-225.
Wang W,Zhang LS,Chen HY,et al.Effects of temperature and light on diapause induction in lady beetle Coccinella septempunctata in Beijing,China [J].Chinese Journal of Biological Control,2013,1:24-30.[王伟,张礼生,陈红印,等.北京地区七星瓢虫滞育诱导的温光效应[J].中国生物防治学报,2013,1:24-30]
Wang W,Zhang LS,Chen HY,et al.Effects of low temperature and photoperiod regulation to Coccinella septempunctata diapause induction.In:Plant Protection Science and Technology Innovation and Pest Control Professional [C].Beijing:China Agricultural Science and Technology Press,2011,385-389.[王伟,张礼生,陈红印,等.低温下光周期对七星瓢虫Coccinella septempunctata滞育诱导的调控作用.见:植保科技创新与病虫防控专业化[C].北京:中国农业科学技术出版社,2011,385-389]
Wang YC.Insect Biochemistry [M].Beijing:China Agricultural Science and Technology Press,1994.[王荫长.昆虫生理生化学[M].北京:中国农业出版社,1994]
Watanabe M,Tanaka K.Adult diapause and cold hardiness inAulacophora nigripennis (Coleoptera:Chrysomelidae)[J].Journal of Insect Physiology,1998,44 (11):1103-1110.
Wolfgang W,Mareike V,Dietrich N.Oxygen consumption,water,lipid and glycogen content of early and late diapause and non-diapause larvae of the burnet moth Zygaena trzyolii [J].Journal of Insect Physiology,1995,41 (1):47-56.
Wu JX,Yuan F,Su L.Change of carbohydrate contents in larvae of the wheat midge,Sitodiplosis mosellana (Gehin)during mature and diapause stage [J].Acta Entomologica Sinica,2004,2:178-183.[仵均祥,袁锋,苏丽.麦红吸浆虫幼虫滞育期间糖类物质变化[J].昆虫学报,2004,2:178-183]
Xin YF.Simple artificial breeding of soybean aphid [J].Journal of Shenyang Agricultural College,1982,1:77-80.[忻亦芬.大豆蚜简易人工饲养[J].沈阳农学院学报,1982,1:77-80]
Xue D,Chen D,Fan XJ,et al.The supercooling point of potato tuber moth,Phthorimaea operculella (Zeller) [J].Journal of Environmental Entomology,2014,36 (5):860-864.[薛冬,陈丹,范秀娟,等.烟草潜叶蛾的过冷却点测定[J].环境昆虫学报,2014,36 (5):860-864]
Xu X,Zhu M,Li L,et al.Cold hardiness characteristic of the overwintering pupae of fall webworm Hyphantria cunea (Drury)(Lepidoptera:Arctiidae)in the northeast of China [J].Journal of Asia-Pacific Entomology,2015,18 (1):39-45.
Xu YY.DiapauseMechanism and Application of Chrysoperla sinica(Tjeder)[D].Zhejiang:Zhejiang University,2001.[许永玉.中华通草蛉的滞育机制和应用研究[D].浙江:浙江大学,2001]
Yang GP.Physiological Profile and Effects of Temperature/Humidity on Cold-hardiness of Diapauses Larvae of Chilo suppressalis (Walker)[D].Beijing:Chinese Academy of Agricultural Sciences,2013.[杨光平.二化螟滞育幼虫的生理特性及温湿度对其抗寒性的影响[D].北京:中国农业科学院,2013]
Yi JQ,Zou ZW,Zhang GR.The relationship between the fatty acids and thosedesaturases and the cold tolerance in the insects [J].Journal of Environmental Entomology,2015,37 (1):155-162.[易杰群,邹志文,张古忍.昆虫脂肪酸及其脱饱和酶与耐寒性的关系概述[J].环境昆虫学报,2015,37 (1):155-162]
Zhang LS,Chen HY,Wang MQ.Studies and applications on diapause of natural enemies.In:Food Safety and Plant Protection Science and Technology Innovation [C].Beijing:China Agricultural Science and Technology Press,2009,548-552.[张礼生,陈红印,王孟卿.天敌昆虫的滞育研究及其应用.见:粮食安全与植保科技创新[C].北京:中国农业科技出版社,2009,548-552]
Zhang LS,Chen HY,Li BP.Mass-rearing and Utilization of Insect Enemies [M].Beijing:China Agricultural Science and Technology Press,2014.[张礼生,陈红印,李保平.天敌昆虫的扩繁与应用[M].北京:中国农业科学技术出版社,2014]
Zhang J,Wu KM,Lin KJ,et al.Diapause characteristics and cold-hardiness of temperate and subtropical populations in Chilo suppressalis [J].Scientia Agricultura Sinica,2005,12:2451-2456.[张珺,吴孔明,林克剑,等.二化螟温带和亚热带地理种群的滞育特征与抗寒性差异[J].中国农业科学,2005,12:2451-2456]
Zhang Q,Nachman RJ,Kaczmarek K,et al.Disruption of insect diapause using agonists and an antagonist of diapause hormone[J].Proceedings of the National Academy of Sciences,2011,108 (41):16922-16926.
Zhang YJ.Studies on the Cold Hardiness and Mechanism of Overwintering Larva of Chilo supperssalis (Walker)[D].Wuhan:Huazhong Agricultural University,2007.[张拥军.二化螟越冬幼虫耐寒性及其机理研究[D].武汉:华中农业大学,2007]
Zhi LS.Studies on the Adult Diapause and Cold Hardiness of Chrysoperla sinica (Tjeder) [D].Shandong:Shandong Agricultural University,2005.[郅伦山.中华通草蛉成虫的滞育与耐寒性研究[D].山东:山东农业大学,2005]
Zhi LS,Li SF,Liu XF,et al.Research on cold resistance of overwintering Chrysoperla sinica adults [J].Shandong Agricultural Sciences,2007,3:67-68.[郅伦山,李淑芳,刘兴峰,等.中华通草蛉越冬成虫的耐寒性研究[J].山东农业科学,2007,3:67-68]
Zhu F,Li H,Wang Y,et al.Change of trehalose,glycogen and polyol contents of the diapausing larvae of Mylabris phalerata (Pallas)(Coleoptera:Meloidae)at different diapausing stages [J].Acta Entomologica Sinica,2008,51 (1):9-13.[朱芬,李红,王永,等.大斑芫菁滞育幼虫在滞育不同阶段体内糖类和醇类含量的变化[J].昆虫学报,2008,51 (1):9-13]

