质膜组分磷脂酰丝氨酸外翻的分子调控机制
毕丹,徐扬,逄越,李庆伟
质膜组分磷脂酰丝氨酸外翻的分子调控机制
毕丹1,2,徐扬1,2,逄越1,2,李庆伟1,2
1. 辽宁师范大学生命科学学院,大连116029;2. 辽宁师范大学七鳃鳗研究中心,大连116029
磷脂酰丝氨酸(Phosphatidylserine, PS)是细胞质膜重要的磷脂成分之一,具有重要的生物学功能。在细胞凋亡及一些特殊的病理条件下,细胞内ATP供能不足,胞浆Ca2+浓度升高,引起PS发生外翻。PS外翻在不同类型细胞中具有不同的生物学功能,且外翻的程度与疾病发展程度密切相关,可作为癌症等多种疾病治疗的靶标。文章综述了细胞质膜中磷脂酰丝氨酸的重要生物学功能和意义、磷脂酰丝氨酸外翻的分子机制及在临床医学方面的应用,以期对未来的功能和临床应用研究提供参考。
磷脂酰丝氨酸;靶标分子;细胞凋亡;磷脂酰丝氨酸外翻
磷脂酰丝氨酸(Phosphatidylserine,PS)属于细胞质膜磷脂中的甘油磷脂类,是细胞质膜重要的磷脂成分之一,主要存在于细菌、酵母、植物、哺乳动物的细胞质膜中[1]。1942年,Jordi Folch首次从牛脑磷脂中提取出了PS[2];1952年,Baer等[3]阐明了PS的基本化学结构:头部为亲水性的甘油骨架,尾部为两个烃链构成的亲油基团。亲水性的甘油头部由丝氨酸残基、磷酸残基和甘油骨架上第3位碳原子上的羟基3个基团组成,而甘油头部的另外两个羟基与脂肪酸成酯构成了PS的尾部。虽然PS只占膜总磷脂含量的2%~10%,但是其与细胞质膜的一系列功能有关,其中脑细胞质膜中的PS对大脑的各种功能起到重要的调节作用[4]。
在正常生理情况下,PS通常集中分布于细胞质膜内小叶。但是细胞在凋亡状态下,PS会存在于细胞质膜的外小叶中,即PS外翻。PS外翻以往仅仅作为凋亡细胞特有的一个特征性现象,但是近年来,随着多种可以与PS特异性结合的小分子物质的发现以及流式细胞术、荧光光谱技术和分子靶向技术等迅速发展,科研人员对PS进行了更深入的研究,取得了一些重要成果。PS外翻现象存在于多种细胞类型中,并具有重要的生物学意义[4]。本文对PS的功能、PS外翻机制、PS外翻对不同类型细胞的生物学意义及其在分子生物学、临床医学方面的应用进行了综述。
1 PS的生物学功能
构成细胞质膜4种主要磷脂中,PS是唯一可以调节细胞质膜中蛋白功能以及状态的磷脂。由于不同来源PS的脂乙酰残基有很大区别,所以通常的PS并非指单一成分,而是一组化合物。PS在细胞代谢中具有重要作用,如参与调节细胞质膜流动性的重要脂质——磷脂酰胆碱(乙酰胆碱的前体),可由PS甲基化形成;且PS在多条细胞信号通路中起到介导细胞受体与第二信使的作用。同时,PS可作为激活酶的辅助因子,例如在蛋白激酶C(PKC)的活化过程中,未活化的PKC在DAG(二酰甘油)协助下转移到细胞质膜,在酶催化下与膜中的PS、Ca2+形成PKC·PS·DGA·Ca2+复合物,变为活化态,进而激活下游通路。另外,PS还可以激活络氨酸羟化酶和Na+/K+-ATP酶等[1]。
近几年研究表明,PS还具有多种药理功能,例如:PS具有提高认知能力,尤其是记忆能力和学习能力的功能,并且在改善阿兹海默症、抑郁症等方面都有显著效果。
2 PS外翻及分子机制
在正常生理情况下,细胞质膜脂的分布存在不对称性。这是由于在细胞质膜中存在一种磷脂转(移)位酶(ATP-dependent aminophospho-lipid translocase),可以特异地将PS和磷脂酰乙醇胺(Phosphatidylethanolamine, PE)运送到膜的内小叶。同时,另外一种细胞质膜中的翻转酶(ATP-dependent floppase)负责将PS与磷脂酰胆碱(Phosphatidylcholine, PC)运送至细胞质膜外小叶。这两种酶对膜同时起作用,但翻转酶的反应速度比转位酶慢10倍。这两个酶促反应各自独立进行,即当翻转酶的活性被抑制时,转位酶仍有活性。在正常生理情况下,这两种酶的作用相互协调,引起膜内主要磷脂的不对称分布,即鞘磷脂(Sphingomyelin, SM)和磷脂酰胆碱(Phosphatidylcholine, PC)集中分布在细胞质膜外小叶,而磷脂酰乙醇胺(Phosphatidylethanolamine, PE)和PS集中分布于细胞质膜内小叶[5]。这种膜脂的不对称性分布是细胞的一种自我保护机制,与细胞识别、内吞与外排、凝血及某些疾病如血栓、自身免疫病等的发展有密切关系。
然而,在凋亡、能量不足等特殊条件下,膜脂的不对称性被破坏,引起PS外翻[6]。其引发机制有以下几方面:
2.1 ATP缺乏
磷脂转位与翻转酶分别属于膜转运蛋白中的ABC超家族和P-型质子泵,都需要依赖ATP供能以维持其活性。因此,当胞内ATP浓度过低时,这两种酶的活性将大大降低,失去了转运能力,导致由膜外小叶至内小叶的PS转运产生障碍而使PS外翻[7]。
2.2 胞浆Ca2+浓度升高
正常情况下,细胞外Ca2+浓度约比细胞内高4个数量级,然而当大量Ca2+进入胞浆时,会激活一种Ca2+依赖性的脂质爬行酶(Scramblase)的活性。这种酶最先是在血小板膜中发现,作用是使膜脂双层内的磷脂分子双相翻转。磷脂爬行酶在正常情况下活性很低,当细胞内Ca2+浓度升高时,才会活化。另外,Ca2+活化磷脂爬行酶的过程造成胞内供能不足,抑制了磷脂转位酶的活性,使翻转到膜外小叶的PS不能及时翻转回来[8]。同时高浓度的Ca2+可以使一些半胱氨酸蛋白水解酶类(Cysteinyl aspartate specific proteinase)活性升高,激活了细胞凋亡信号转导通路,进而导致大量PS外翻。
2.3 其他类型的生物损伤
除了ATP、Ca2+的影响之外,在其他极端的生理条件下也会引起细胞质膜中PS外翻,如一些物理性损伤。另外,活性氧浓度过高以及肿瘤内皮细胞因子的激活也会引起肿瘤血管内皮细胞质膜表面PS外翻[9]。
3 PS外翻对于不同类型细胞的生物学意义
3.1 凋亡细胞
众所周知,外翻的PS可与另外一些分子共同构成“识我”(find me)和“食我”(eat me)的信号使凋亡细胞被吞噬细胞识别和吞噬。过去人们认为吞噬细胞中仅存在一种可以与PS特异性结合的受体,但近期研究结果表明,有多种可与PS特异性结合的受体来介导细胞凋亡。按照结合方式可将特异性结合PS的受体分为两类:一类为直接识别,这类受体属于膜蛋白(如BAI1、TIM-4[10]和Stabilin 2等),可以直接识别凋亡细胞表面外翻的PS;另一类为间接识别,受体(MER和αvβ3等)则通过与一些可溶性桥接分子(MFG-E8和Gas6等)相结合,桥接分子再与PS特异性结合的方式完成对PS的特异性识别[11](图1)。当吞噬细胞通过“识我”信号的引导靠近凋亡细胞时,凋亡细胞表面的“食我”信号(外翻的PS、细胞质膜表面粘附分子和糖基化位置的改变等)就负责引导吞噬细胞进行吞噬[12]。

图1 吞噬细胞对凋亡细胞的识别作用示意图
由此可见,PS外翻是细胞凋亡的重要表面标志之一。但这也容易造成理解上的误区,似乎细胞凋亡与PS外翻是紧密联系,互相依赖的过程。但近年的研究表明,细胞凋亡与PS外翻是两个彼此独立的事件,即凋亡细胞不一定发生PS外翻,而PS外翻的细胞也不一定是凋亡细胞。在多种细胞类型中,PS外翻发生在细胞凋亡之前,具有明显的细胞类型特异性,且不同细胞间表达量有较大差别。另外,一些含巯基的药剂作用细胞会引起细胞PS外翻,但该细胞并未发生凋亡,因为作用后该细胞中未出现Caspase活化或DNA破碎等典型凋亡的标志性现象。PS外翻对于很多类型细胞还具有区别于细胞凋亡的其他生物学意义[13]。
3.2 血细胞
研究表明,在多种血细胞表面均有少量PS表达,而且对于不同血细胞有不同的生物学意义。
3.2.1 红细胞
哺乳动物成熟的红细胞中没有线粒体等细胞器,所以不存在以线粒体为中心的内源性细胞凋亡途径,因此红细胞的程序性死亡称为红细胞衰亡。与细胞凋亡类似,红细胞衰亡可由外源物质的刺激引起[14],表现为Ca2+浓度升高、ATP供能不足、Caspase活化、PS外翻和细胞皱缩等[15]。镰刀形红细胞贫血病患者的红细胞表面也有大量PS表达,这是由于细胞内Ca2+浓度过高,激活了Gardos通道(又称中电导钙激活K+通道),导致大量K+外流,其外流伴有细胞水分的丢失、Cl-流失和PS外翻,进而导致红细胞脱水、皱缩,出现镰刀形红细胞[3,16]。因此,可以利用该离子通道阻断剂,如克霉唑(Clotrimazole)来治疗镰刀形红细胞贫血病。
3.2.2 血小板
在血小板中,PS能在凝血因子Ⅷ和IXa存在的条件下激活凝血因子X。凝血因子Xa还能够促进凝血因子Va-Xa复合物的形成,从而激活凝血级联反应[17]。研究表明,在红细胞、血小板、淋巴细胞与中性粒细胞4种血细胞表面表达的PS均有一定的促凝血作用[18]。
3.3 寄生虫
在寄生虫虫体细胞中,PS外翻的现象被称为“凋亡模拟”,是一种逃避宿主免疫应答以及炎症反应的策略[19]。例如在利什曼虫()中,无鞭毛的虫体无PS外翻现象,而前端着生鞭毛的虫体中,有的亚群有PS外翻现象,有的亚群则无此现象[20]。当这两个亚群的利什曼虫()同时侵入宿主体内时,PS外翻的亚群会吸引大量巨噬细胞对其围追堵截,而另一个亚群的利什曼虫因此回避了宿主的免疫应答,会趁机加速宿主的侵染[21]。
3.4 肿瘤细胞
研究表明,原代培养的肿瘤细胞、肿瘤细胞系、恶性转移瘤细胞如前列腺癌细胞、原发性黑色素瘤细胞表面均有PS表达,而且其表面表达PS的量与肿瘤细胞的恶性程度呈正相关性。而针对细胞质膜表面PS表达量的检测,目前最常用的是AnnexinV- FITC荧光探针标记法。膜联蛋白(Annexin)是一类与膜上的酸性磷脂发生反应、钙依赖性的蛋白家族,可分为12种(AnnexinⅠ-AnnexinⅫ)类型,其N端区不同,但C端区高度同源,含4~8个重复单位,每个单位含有5个α螺旋,参与膜转运、膜表面依赖钙调蛋白的多项活动。AnnexinV分子量约为35 kDa,能与PS高亲和力特异性结合。将Annexin-V进行荧光素(FITC、PE)或biotin标记,被标记了的Annexin-V可作为荧光探针,检测细胞质膜表面的PS表达。在荧光光谱实验中,科研人员利用AnnexinV-FITC探针分别标记生黑色素细胞与不同恶性程度的黑色素瘤细胞表面的PS后,绝对荧光强度值表明,原发性黑色素瘤细胞表面PS的表达量是生黑色素细胞的两倍,而恶性黑色素瘤细胞表面PS的表达量则达到了生黑色素细胞的8~11倍。2011年,Riedl等[22]仅以PS是否外翻为唯一指标,通过流式细胞术成功地分选出了肿瘤细胞与非肿瘤细胞,这就意味着可以将外翻的PS作为肿瘤细胞特异性标志物对肿瘤细胞进行定性。
但是,肿瘤细胞为什么会PS外翻仍然是个谜。有研究表明,这与肿瘤细胞高频率的细胞分裂与细胞凋亡有关,但也有研究证明肿瘤细胞表面的PS外翻并没有逃过巨噬细胞对其的识别[22],但是肿瘤细胞却机智地逃过了死亡的命运继续生存,比如黑色素瘤细胞可以沉默细胞凋亡因子Apaf-1基因的表达,使激活的促凋亡因子p53失去介导该细胞凋亡的功能,避免肿瘤细胞凋亡[23]。目前,关于肿瘤细胞PS外翻的生物学意义学术界仍无确切的说法,但是可以确定的一点是PS外翻对于整个肿瘤的生长利大于弊。
4 PS外翻在临床医学中的应用
4.1 肿瘤治疗新方案
目前,恶性肿瘤已经成为严重威胁人们生活质量的疾病之一,而且多数消化道肿瘤具有早期易转移、晚期难治疗等特点,致死率很高。目前对消化道恶性肿瘤的治疗主要采取手术、放疗和化疗的方法。化疗在消化道肿瘤治疗中占首要地位,然而其耐药性可造成化疗疗效降低甚至失败[24]。P-糖蛋白(P-gP)为一种跨膜糖蛋白,由多药耐药基因(Multi-drugs resistance, MDR1)编码,属于ABC超家族转运蛋白。研究表明,P-gP为单向药物输出蛋白,多药耐药肿瘤细胞质膜表面高表达,其高表达原因与肿瘤细胞内钙离子浓度偏高有关。细胞表面P-gP的Walker A和Walker B结构域水解ATP供能,还能够将PS翻转至膜的外层,造成肿瘤细胞表面PS高表达[25]。
P-gP抑制剂的开发与研究一直都是肿瘤治疗研究的重点之一,目前已发展了三代P-gp抑制剂,但都会对机体造成一定程度的损害。目前,科研人员利用P-gP使PS外翻的特点设计了新型P-gP抑制剂,例如使用降低细胞质膜极性头部区域的流动性的药物,导致细胞质膜脂质环境发生变化,减少PS外翻机会,继而降低P-gP底物外排速率[26]。
利用肿瘤细胞表面PS外翻的特征,还可以设计一系列以肿瘤细胞表面外翻的PS为靶点的新药,具有药效高,能被限定在特定的靶细胞、器官或组织内等特点[27]。
目前,以PS为靶点设计的抗癌药物大部分由抗菌肽(Antimicrobial peptides)加工而成。这类由自身免疫系统产生的带正电荷的短肽,可由离子键与带负电荷的肿瘤细胞表面PS特异性结合。因为正常细胞不存在PS外翻的现象,所以这类药物不能作用正常细胞,因此,与传统的全身用药的化学疗法相比,特异性强副作用小。目前,随着高通量抗菌肽筛选技术的应用,研发特异性强的抗菌肽类药物拥有广阔的发展前景[28,29]。
4.2 增强某些抗癌药物的细胞毒性
利用PS外翻可以从分子水平上提高一些抗癌药物的细胞毒性。如用于治疗乳腺癌的药物氟达拉滨,其杀伤乳腺癌细胞的方式是在磷酸酶的作用下先脱去一个磷酸基团,再在膜转运蛋白的帮助下进入细胞,通过整合进DNA或RNA的方式杀伤细胞,此过程比较繁琐[30]。2013年,Krais等[31]为了优化这一过程,将嘌呤核苷磷酸化酶(Purine nucleoside phosphorylase, PNP)与Annexin V(膜联蛋白)构建成融合蛋白作用于MCF细胞,由于Annexin V可以与MCF细胞表面PS特异性结合,所以将这个融合蛋白固定在MCF细胞表面。而PNP的作用则是将氟达拉滨的核糖-1-磷酸基团脱去,使之变成2-氟腺嘌呤的形式(图2)。这种形式的氟达拉滨是以自由扩散的形式进入细胞,而且2-氟腺嘌呤不仅可以作用DNA、RNA,还可以作用胞内蛋白,从而大大提高了氟达拉滨的细胞毒性[6]。另外,还可以将细胞杀伤性蛋白药物包被在PS脂质体内,保护该药物在到达病灶前不被降解,从而起到缓释作用,延长药物的半衰期,如SapC-DOPS的应用[32,33]。
4.3 作为多种疾病的评价指标
因为多种疾病的恶性程度与细胞表面PS表达量息息相关,所以可以通过细胞PS外翻总量大致判定某种疾病的恶性程度,也可以在给药治疗后通过实时监测其细胞表面PS表达量的变化程度来评价该药物的疗效。目前这种评价方法已经应用到多种癌症的治疗中,例如,目前常用来评测抗癌药物疗效的18F-FDG显像法针对肝癌、肾癌及乳腺癌的显像存在很大的局限性,且葡萄糖代谢的减缓并不一定代表肿瘤细胞发生死亡[34]。因此,Palmowski等[35]针对肿瘤细胞表面特异性表达PS这一特点,利用一种新型小分子化合物PSVue794作为荧光探针,标记肿瘤细胞表面表达的PS,代替18F-FDG,通过荧光成像技术检测PSVue794是否聚集,来评价抗肿瘤血管生成药物的疗效。PSVue794分子量仅1.84 kDa,它比常规用来标记细胞表面PS的Annexin V-FITC对PS量的变化反应更为敏感,所以对药物疗效的评测更为准确,适用范围也更广。再如前文中提到负责特异性运输PS至细胞质膜外小叶的翻转酶,属于膜转运蛋白ABC超家族。这种酶还有另外一个作用:与载脂蛋白apoAI结合促进胆固醇与apoAI形成高密度脂蛋白(HDL)[36]。HDL颗粒小,结构致密,能清除积存于血管壁内的胆固醇,且不向组织释放胆固醇,具有将组织中胆固醇转移出来的功能,是抗动脉粥样硬化的保护因子。当人体内HDL合成受阻时,就易患高密度脂蛋白缺乏症,并有可能演变为动脉粥样硬化。为了促进HDL的形成,可以使用一些药物增加翻转酶活性,促进胆固醇与apoAI的结合,同时还可以将外翻PS的量作为评价该药物作用效果的有效指标[37]。

图2 PNP-AV融合蛋白作用示意图
5 细胞质膜中PS的检测方式
由于PS在药理及临床诊断方面有重要的应用,所以针对不同的目的,选择不同的技术来检测细胞质膜中PS的表达情况十分重要。目前,PS的检测技术主要分为直接检测法与间接检测法两类。直接检测法一般是指将光谱分析与化学分馏相结合,这种方法可以获得比较精确的数据,如Allison等[38]用傅里叶红外光谱仪结合生物信息学分析对肿瘤细胞质膜中各种磷脂成分进行了准确定量。而间接检测法是指利用多种可以与PS特异性结合的配体与实验细胞进行孵育,配体带有荧光标签,从而可以使用流式细胞仪或者荧光光谱仪等对细胞内、外PS表达情况进行检测。目前研究发现,多种物质如蛋白质、多肽、小分子化合物都可作为检测细胞质膜中PS的配体,而且不同配体有不同的特点[39,40],比较结果见表1。
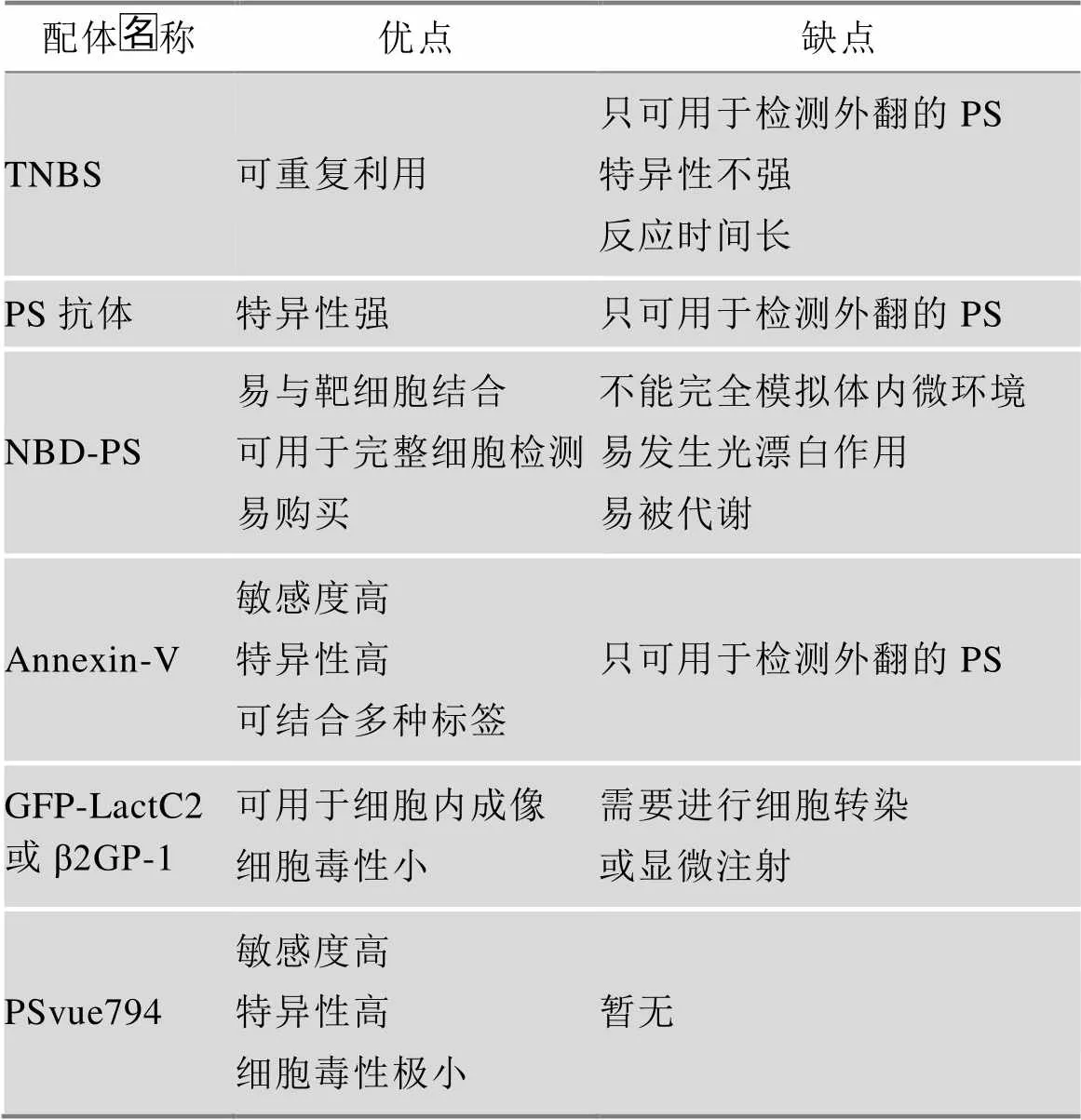
表1 特异性结合PS的配体比较
6 展 望
在PS外翻的机制研究方面,尽管Riedl等[22]证实了肿瘤细胞表面普遍表达PS,且表达量与肿瘤细胞的恶性程度呈正相关关系,但肿瘤细胞为什么会出现PS外翻的现象,以及这种现象是否由凋亡引起仍有待研究。虽然大量实验表明巨噬细胞以外翻的PS为“识我”信号识别凋亡细胞,但其穿过细胞表面的蛋白-脂质复合物识别PS的具体作用方式还不明确。而且,为何凋亡细胞表面表达的PS不能引起全部巨噬细胞对其的识别?另外,研究表明人体外周血液中成熟红细胞质膜PS外翻可能参与了脓毒症贫血的发生过程,揭示抑制红细胞衰亡可能对治疗脓毒症具有潜在的临床治疗价值,不过其具体作用机制尚待进一步研究证实。
在对一些疾病的恶性程度评估与治疗方面,PS外翻可作为凋亡及坏死细胞的免疫原性信号这一特征,为开发自身免疫病及癌症治疗的新药提供了潜在的可能。为了更准确、迅速、直观地监测细胞表面PS量的变化情况,目前科研人员正致力于研究与PS特异性结合的物质,如小分子荧光探针PSVue794等。随着各项技术的应用与成熟,会有更多特异性结合PS的产品问世,同时也会进一步推动PS功能与应用的研究。目前,国内外对其结构、合成以及改善多种疾病的保健功效有了一定研究,但是其代谢、作用机理还不十分清楚。目前国内开发磷脂酰丝氨酸产品刚刚起步,仍具有广阔的发展空间。相信未来,PS将广泛用于肿瘤诊断及治疗,并将在药品、保健领域具有广阔的应用前景。
[1] 王镜岩, 朱圣庚, 徐长法. 生物化学. 北京: 高等教育出版社, 2002.
[2] Folch J, Lees M, Sloane-Stanley GH. A simple method for the isolation and purification of total lipides from animal tissues., 1957, 226(1): 497–509.
[3] Baer E, Maurukas J. Phosphatidyl serine, 1955, 212(1): 25–38.
[4] Chu C, Huang X, Chen CT, Zhao Y, Luo JJ, Gray BD, Pak KY, Dun NJ.imaging of brain infarct with the novel fluorescent probe PSVue 794 in a rat middle cerebral artery occlusion-reperfusion model., 2013, 12(1): 8–16.
[5] Lin QQ, London E. Preparation of artificial plasma membrane mimicking vesicles with lipid asymmetry., 2014, 9(1): e87903.
[6] Haberkorn U, Markert A, Mier W, Askoxylakis V, Altmann A. Molecular imaging of tumor metabolism and apoptosis., 2011, 30(40): 4141–4151.
[7] Seigneuret M, Devaux PF. ATP-dependent asymmetric distribution of spin-labeled phospholipids in the erythrocyte membrane: relation to shape changes., 1984, 81(12): 3751–3755.
[8] Haest CWM. Distribution and movement of membrane lipids. In: Bernhardt I, Ellory C. Red Cell Membrane Transport in Health and Disease. Berlin Heidelberg: Springer, 2003: 1–25.
[9] Ran S, Downes A, Thorpe PE. Increased exposure of anionic phospholipids on the surface of tumor blood vessels., 2002, 62(21): 6132–6140.
[10] Kroy DC, Ciuffreda D, Cooperrider J H, Kroy DC, Ciuffreda D, Cooperrider JH, Tomlinson M, Hauck GD, Aneja J, Berger C, Wolski D, Carrington M, Wherry EJ, Chung RT, Tanabe KK, Elias N, Freeman GJ, de Kruyff RH, Misdraji J, Kim AY, Lauer GM. Liver environment and HCV replication affect human T-cell phenotype and expression of inhibitory receptors., 2014, 146(2): 550–561.
[11] Ravichandran KS. Beginnings of a good apoptotic meal: the find-me and eat-me signaling pathways., 2011, 35(4): 445–455.
[12] Caberoy NB, Alvarado G, Bigcas JL, Li W. Galectin-3 is a new MerTK-specific eat-me signal., 2012, 227(2): 401–407.
[13] Dong HP, Holth A, Kleinberg L, Ruud MG, Elstrand MB, Tropé CG, Davidson B, Risberg B. Evaluation of cell surface expression of phosphatidylserine in ovarian carcinoma effusions using the annexin-V/7-AAD assay clinical relevance and comparison with other apoptosis parameters., 2009, 132(5): 756–762.
[14] Jilani K, Enkel S, Bissinger R, Almilaji A, Abed M, Lang F. Fluoxetine induced suicidal erythrocyte death., 2013, 5(7): 1230–1243.
[15] Bhavsar SK, Bobbala D, Xuan NT, Föller M, Lang F. Stimulation of suicidal erythrocyte death by α-lipoic acid., 2010, 26(6): 859–868.
[16] Jilani K, Lang F. Carmustine-induced phosphatidylserine translocation in the erythrocyte membrane., 2013, 5(4): 703–716.
[17] Weiss E, Rees DC, Gibson JS. Role of calcium in phosphatidylserine externalisation in red blood cells from sickle cell patients., 2010, 7(4): 1–8.
[18] 刘述川, 周晋, 史家岚, 苏雁华. 正常血细胞表面磷脂酰丝氨酸的表达及其促凝功能. 中华血液学杂志, 2011, 32(12): 858–862.
[19] Laliberte JP, Moss B. Appraising the apoptotic mimicry model and the role of phospholipids for poxvirus entry., 2009, 106(41): 17517–17521.
[20] Farias LH, Rodrigues A P, Silveira FT, Seabra SH, DaMatta RA, Saraiva EM, Silva EO. Phosphatidylserine exposure and surface sugars in two Leishmania (Viannia) braziliensis strains involved in cutaneous and mucocutaneous leishmaniasis., 2013, 207(3): 537–543.
[21] Rochael NC, Lima LG, Oliveira SM, Barcinski MA, Saraiva EM, Monteiro RQ, Pinto-da-Silva LH. Leishmania amazonensis exhibits phosphatidylserine-dependent procoagulant activity, a process that is counteracted by sandfly saliva., 2013, 108(6): 679–685.
[22] Riedl S, Rinner B, Asslaber M, Schaider H, Walzer S, Novak A, Lohner K, Zweytick D. In search of a novel target—phosphatidylserine exposed by non-apoptotic tumor cells and metastases of malignancies with poor treatment efficacy., 2011, 1808(11): 2638–2645.
[23] Tormo D, Checińska A, Alonso-Curbelo D, Pérez-Guijarro E, Cañón E, Riveiro-Falkenbach E, Calvo TG, Larribere L, Megías D, Mulero F, Piris MA, Dash R, Barral PM, Rodríguez-Peralto JL, Ortiz-Romero P, Tüting T, Fisher PB, Soengas MS. Targeted activation of innate immunity for therapeutic induction of autophagy and apoptosis in melanoma cells., 2009, 16(2): 103–114.
[24] Manavbasi Y, Zweytick D, Willumeit R, Lohner K. Phosphatidylserine selective peptides as novel anti-cancer agents., 2009, 96(3): 157.
[25] Riedl S, Rinner B, Tumer S, Schaider H, Lohner K, Zweytick D. Targeting the cancer cell membrane specifically with human lactoferricin derivatives., 2011, 22(Suppl. 3): 33.
[26] Blondelle SE, Lohner K. Optimization and high-throughput screening of antimicrobial peptides., 2010, 16(28): 3204–3211.
[27] Pierigè F, De Marco C, Orlotti N, Dominici S, Biagiotti S, Serafini S, Zaffaroni N, Magnani M, Rossi L. Cytotoxic activity of 2-Fluoro-ara-AMP and 2-Fluoro-ara-AMP- loaded erythrocytes against human breast carcinoma cell lines., 2010, 37(1): 133–142.
[28] Van Rite BD, Lazrak YA, Pagnon ML, Palwai NR, Neves LF, McFetridge PS, Harrison RG. Enzyme prodrug therapy designed to target L-methioninase to the tumor vasculature., 2011, 301(2): 177–184.
[29] Derenne A, Vandersleyen O, Goormaghtigh E. Lipid quantification method using FTIR spectroscopy applied on cancer cell extracts.,2014, 1841(8): 1200–1209.
[30] Wojton J, Chu ZT, Mathsyaraja H, Meisen WH, Denton N, Kwon CH, Chow LM, Palascak M, Franco R, Bourdeau T, Thornton S, Ostrowski MC, Kaur B, Qi XY. Systemic delivery of SapC-DOPS has antiangiogenic and antitumor effects against glioblastoma., 2013, 21(8): 1517– 1525.
[31] Krais JJ, De Crescenzo O, Harrison RG. Purine nucleoside phosphorylase targeted by annexin V to breast cancer vasculature for enzyme prodrug therapy., 2013, 8(10): e76403.
[32] Chu ZT, Abu-Baker S, Palascak MB, Ahmad SA, Franco RS, Qi XY. Targeting and cytotoxicity of SapC-DOPS nanovesicles in pancreatic cancer., 2013, 8(10): e75507.
[33] Wang SH, Gulshan K, Brubaker G, Hazen SL, Smith JD. ABCA1 mediates unfolding of apolipoprotein AI N terminus on the cell surface before lipidation and release of nascent High-Density lipoprotein., 2013, 33(6): 1197–1205.
[34] Gulshan K, Brubaker G, Wang S, Hazen SL, Smith JD. Sphingomyelin depletion impairs anionic phospholipid inward translocation and induces cholesterol efflux., 2013, 288(52): 37166–37179.
[35] Palmowski K, Rix A, Lederle W, Behrendt FF, Mottaghy FM, Gray BD, Pak KY, Palmowski M, Kiessling F. A low molecular weight zinc2+-dipicolylamine-based probe detects apoptosis during tumour treatment better than an annexin V-based probe., 2014, 24(2): 363–370.
[36] Schutters K, Reutelingsperger C. Phosphatidylserine targeting for diagnosis and treatment of human diseases., 2010, 15(9): 1072–1082.
[37] Kay JG, Grinstein S. Sensing phosphatidylserine in cellular membranes., 2011, 11(2): 1744–1755.
[38] Krishnamurthy S, Tichenor MD, Satish AG, Lehmann DB. A proposed role for efflux transporters in the pathogenesis of hydrocephalus., 2014, 55(4): 366–376.
[39] Chen NH, Weiss D, Reyes J, Liu LG, Kasserra C, Wang XM, Zhou SM, Kumar G, Weiss L, PalmisanoM. No clinically significant drug interactions between lenalidomide and P‑glycoprotein substrates and inhibitors: results from controlled phase I studies in healthy volunteers., 2014, 73(5): 1031–1039.
[40] Postnov A, Froklage FE, van Lingen A, Reijneveld JC, Hendrikse NH, Windhorst AD, Schuit RC, Eriksson J, Lammertsma AA, Huisman MC. Radiation dose of the P-glycoprotein tracer 11C-laniquidar., 2013, 54(12): 2101–2103.
(责任编委: 陈雁)
Molecular regulations of phosphatidylserine eversion in plasma membrane
Dan Bi1,2, Yang Xu1,2, Yue Pang1,2, Qingwei Li1,2
Phosphatidylserine (PS), one important phospholipid of cell membranes, has crucial biological functions. Under special pathological circumstances such as cell apoptosis, cells cannot generate enough ATP for energy and the concentration of cytoplasmic Ca2+increases, resulting in PS eversion. PS eversion has different biological functions in different cell types. In addition, the degree of eversion is closely associated with the progress of diseases. Therefore, it can be therapeutic targets of cancer and many other diseases. In this review, we summarize the fundamental biological functions of PS, molecular mechanisms of PS eversion, as well as its potential in translational medicine.
phosphatidylserine; target molecules; apoptosis; phosphatidylserine eversion
2014-06-25;
2014-10-20
国家重大基础研究发展规划(973计划)项目(编号:2013CB835304),全国海洋公益项目(编号:201305016),国家自然科学基金项目(编号:31170353,31202020)和大连市科技计划项目(编号:2013E11SF056)资助
毕丹,硕士研究生,专业方向:细胞生物学。E-mail: 543272866@qq.com
李庆伟,教授,博士生导师,研究方向:细胞生物学。E-mail: liqw@263.net逄越,副教授,硕士生导师,研究方向:细胞生物学。E-mail: pangyue01@163.com
10.16288/j.yczz.14-207
网络出版时间: 2014-12-16 13:06:45
URL: http://www.cnki.net/kcms/detail/11.1913.R.20141216.1306.001.html

