鹿角胶-壳聚糖细胞支架修复大鼠股骨头缺血性坏死
孙铁锋, 王 平
(1.山东中医药大学,山东济南250355;2.山东省中医药研究院,山东济南250014)
[药 理]
鹿角胶-壳聚糖细胞支架修复大鼠股骨头缺血性坏死
孙铁锋1,2, 王 平2*
(1.山东中医药大学,山东济南250355;2.山东省中医药研究院,山东济南250014)
目的 研究鹿角胶-壳聚糖细胞支架对大鼠股骨头缺血性坏死的修复。方法 无菌条件下酶消化法分离、培养新生Wistar乳大鼠成骨细胞;物理法无菌制备鹿角胶-壳聚糖细胞支架;将成骨细胞接种到鹿角胶-壳聚糖细胞支架上,置入造模成功的大鼠股骨头坏死部位。结果 鹿角胶-壳聚糖支架有促进成骨细胞增殖和增强活力作用,支架治疗后模型大鼠关节活动受限情况得到改善,X光线观察股骨头坏死区与囊性变逐渐修复,光镜照片表明治疗骨细胞部分变性、坏死减轻。结论 鹿角胶-壳聚糖细胞支架对股骨头缺血性坏死具有较好的修复作用。
成骨细胞;鹿角胶-壳聚糖细胞支架;股骨头缺血性坏死;大鼠
股骨头缺血性坏死(Avascular necrosis of the femoral head,ANFH),是临床上一种较常见的骨科疾病,因其致残率、致死率极高,被称为 “不死的癌症”。目前采用的关节置换术和药物治疗都有一定的局限性[1],给患者带来身心痛苦和经济负担。组织工程支架技术的出现,使股骨头坏死的治疗出现了新的转机,该方法的原理是将外源的成骨细胞植入到坏死部位,并提供有利于成骨细胞分化的微环境,促进其生长,从而替代已经坏死的股骨头。我们制成鹿角胶-壳聚糖细胞支架,搭载成骨细胞移植到体内,考察支架在体内建立的微环境下能否促进成骨细胞顺利地增殖,逐渐生成新生骨组
织,替代坏死组织,最终完成股骨头坏死的修复。
1 材料与方法
1.1 材料
1.1.1 实验动物 Wistar大鼠(不分雌雄),体质量180~220 g,新生Wistar乳大鼠,体质量30~35 g,购自山东大学实验动物中心,动物质量合格证号鲁动质scxk(鲁)20100004号;鹿角胶 (湖北华光制药有限责任公司,生产批号120401);壳聚糖 (山东奥康生物科技有限公司,生产批号140316v,脱乙酰度>90%);维甲酸 (山东良福制药有限公司,生产批号H10970054)。
1.1.2 试验条件 实验室温度23~25℃;湿度50%~70%;通风良好;动物饲养条件,喂以专用颗粒鼠饲料。实验前动物饮水、进食正常,状态良好。
1.1.3 试验主要仪器和试剂 DMEM-LG液体培养基(Hyclone公司);0.25%胰蛋白酶-EDTA溶液(Solarbio公司);标准胎牛血清 (天津市灏洋生物制品科技有限责任公司);青链霉素混合液(Solarbio公司);D-Hank’s液(Solarbio公司);PBS磷酸盐缓冲液 (Solarbio公司);茜素红指示剂(Solarbio公司);碱性磷酸酶活性检测试剂盒(上海工硕生物技术有限公司);塑料培养板(Corning公司);倒置相差显微镜(Olympus公司);CO2培养箱 (长沙华曦电子科技有限公司生产);酶标仪(Bio-Rad公司);培养箱Galaxy(德国);超净工作台ZHJH-1209(台湾斯特仪器设备有限公司);GB303基本型电子天平(Mettler-Totado公司);恒温水浴 (上海医用电子设备厂生产);DDL-5型离心机 (上海安亭科技仪器厂生产)。
1.2 方法
1.2.1 成骨细胞的分离和培养 取Wistar乳大鼠脱颈处死,无菌条件下取其头盖骨,消化后过100目细胞筛,1 000 r/min,离心5 min,取下层。用DMEM-LG清洗后置于25 cm2塑料培养瓶中,于37℃,5%CO2恒温培养箱中培养。接种后12 h第一次换液,去除不贴壁细胞。其后每3天换一次液。8~10 d后,用0.25%胰蛋白酶消化、传代,传至第3代时进行鉴定。
1.2.2 成骨细胞成骨性鉴定 将传代3次的成骨细胞取出,用PBS缓冲液清洗3次,茜素红染色,进行钙结节染色,水浴2 h,双蒸水冲洗3遍,固定、标记、拍照,观察是否有钙结节出现,若结果为阳性,则鉴定为成骨细胞。
1.2.3 鹿角胶-壳聚糖细胞支架的制备[2-3]将壳聚糖粉末溶解于0.1 mol/L的醋酸,配制成3%(w/v)的壳聚糖溶液,按照1:3(壳聚糖与鹿角胶)的比例加入鹿角胶,搅拌混匀,混合溶液加入1% (w/v)相对分子质量1 000聚乙二醇,37℃溶解蜡状聚乙二醇。将壳聚糖/鹿角胶溶液缓慢倒入模具,-80℃预冷,再放入冷冻抽干机中冻干48 h,制备成壳聚糖-鹿角胶支架。支架成型后浸入无水乙醇中60 min,用Na2HPO4饱和溶液洗涤至pH中性,三蒸水冲洗5~10次。然后将支架材料浸泡在碳酰二亚胺交联剂中10 h,再用40%的乙醇溶液浸泡30 min,最后用三蒸水冲洗干净,进行二次冻干。辐照灭菌,备用。
1.2.4 鹿角胶-壳聚糖细胞支架负载成骨细胞 将诱导后的成骨细胞用胎牛血清的DMEM培养液吹打成单细胞悬液,调整细胞浓度。以2:1的比例将复合支架与成骨细胞混合,置于12孔板中,于37℃、体积分数5%CO2条件下培养5.0~6.0 min,待复合支架与成骨细胞复合物形成凝胶后取出,再在每孔加入适宜量的完全培养液,继续培养。
1.2.5 支架对成骨细胞增殖的影响 消化接种“1.2.4”项下细胞于96孔板,培养24、48、72 h后进行MTT检测。3个细胞板分别接入3 000、4 000、5 000个细胞,调零孔只加入100μL细胞培养液,边缘孔加入100μL PBS,置于37℃、饱和温度、5%CO2恒温培养箱内孵4 h,贴壁后,每孔加入10μLMTT染色液,继续培养4 h。每孔加入100μL Formazan溶解液(DMSO),置于摇床低速振荡10 min,用酶标仪490 nm处测定吸光度OD值。将经过5 d的诱导后将培养液吸出,PBS培养液洗2遍,细胞粉碎机,超声裂解,按碱性磷酸酶试剂盒操作步骤加入500μL基质液,37℃水浴15 min后加入750μL显色液,用酶标仪测定504 nm处的吸光度 (A)值,结果进行组间t检验。
1.2.6 将鹿角胶-壳聚糖细胞支架定向固定在ANFH模型动物坏死部位[4-9]取Wistar大鼠72只,体质量为180~220 g,随机分为空白对照组和模型组,模型组给大鼠灌胃维甲酸70 mg/kg,每日1次。6周后,停用维甲酸,随机选取2只大鼠处死,取股骨头部位的骨组织,用10%的福尔马林固定,光镜下快速检测验证模型成功。将造模成功的大鼠,麻醉后取俯卧位,左下肢外展20°固定于操作台上,消毒。在医用便携式X光机的照射下,
确定左侧股骨头坏死部位,将鹿角胶-脱蛋白骨细胞支架置于埋线针内,自坏死部位对应的体表皮肤刺入,直达股骨头坏死部位。取右侧部位不给予任何治疗,作为模型对照组。继续饲养。检测以下指标[10-12]:一般情况观察、股骨头大体观察、X光片观察、股骨头部位的病理检查。
1.3 统计学处理 采用SPSS 17.0软件完成统计处理,实验数据以表示,组间比较选用LSD法,P<0.05为差异有显著性意义。
2 结果
2.1 成骨细胞形态学观察 倒置相差显微镜观察成骨细胞,48 h更换培养液时,在倒置显微镜下,可观察到原代培养细胞呈现单个或多个细胞聚集状态,见图1a。第5天换液时,细胞呈典型的 “铺路石”状,见图1b。

图1 成骨细胞的形态 (×200)Fig.1 Bone ceIImorphoIogies(×200)
2.2 成骨细胞的鉴定 茜素红染色结果显示,培养皿中的成骨细胞布满了红色阳性克隆的钙化结节(图2),从而证实该细胞为成骨细胞。

图2 茜素红染液染色的钙结节 (×10)Fig.2 AIizarin red dye staining caIcium nodu Ies(×10)
2.3 鹿角胶-壳聚糖细胞支架的观察 如图3所示,冷冻干燥法制备的鹿角胶-壳聚糖支架材料为多孔似海绵状,孔与孔之间相互连通。支架整体形状为圆柱纽扣型,外观呈米白色泡沫样,支架表面呈现叠瓦状,仔细观察可见表面布满孔隙。

图3 鹿角胶-壳聚糖支架材料的外观Fig.3 AntIer geIatin-chitosan scaffoId appearance
2.4 支架对成骨细胞增殖的影响 支架培养组(实验组)细胞进行干预后,实验组的细胞的OD值在24、48和72 h时显著高于对照组,说明鹿角胶-壳聚糖支架对细胞有增值作用,见表1。
表1 支架对成骨细胞生长的增殖作用Tab.1 Support vaIue-added effects on the grow th of osteob Iast

表1 支架对成骨细胞生长的增殖作用Tab.1 Support vaIue-added effects on the grow th of osteob Iast
注:与空白对照组比较,*P<0.05,**P<0.01
培养时间/h OD值空白对照组 支架组24 0.247±0.016 0.492±0.091**48 0.535±0.093 0.767±0.118**72 0.564±0.047 0.612±0.131*
培养5 d测定对照组和实验组细胞A值,见表2。经方差分析,实验组碱性磷酸酶活性明显强于对照组 (P<0.01)。
表2 碱性磷酸酶的吸光度 (A)值Tab.2 Absorbance(A)vaIues of aIkaIine phosphatase

表2 碱性磷酸酶的吸光度 (A)值Tab.2 Absorbance(A)vaIues of aIkaIine phosphatase
注:与空白对照组比较,**P<0.01
组别 孔数(n) 吸光度(A)值10 125.42±0.18支架组 10 216.48±0.52空白对照组**
2.5 鹿角胶-壳聚糖细胞支架对ANFH模型动物的修复作用结果
2.5.1 整体情况观察结果 成模后大鼠尾部出现溃烂情况,行走跛行,关节活动受限。植入支架后肉眼观察大鼠股骨头部位无明显的形状变化,未发生切口感染,无明显的炎症反应、排异反应,动物进食良好、腿部活动逐渐恢复正常,大鼠无死亡。按照表3设计的观察表给大鼠进行评分,结果见表4。
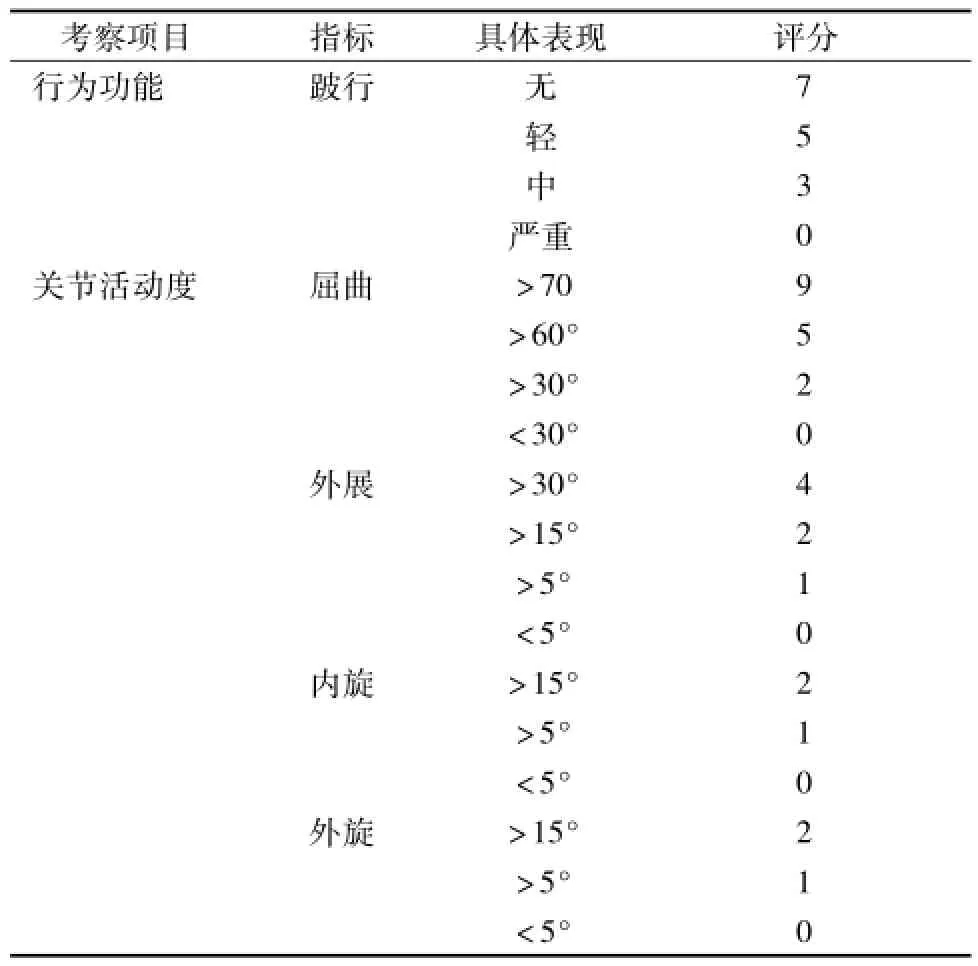
表3 一般情况观察表Tab.3 GeneraIobservation tab Ie
表4 一般情况综合评分结果Tab.4 Resu It of com prehensive scores in genera In=10)

表4 一般情况综合评分结果Tab.4 Resu It of com prehensive scores in genera In=10)
注:与模型对照组比较,##P<0.01
组别 样本数 评分结果空白对照组10 22.20±1.32模型对照组 10 4.60±1.35支架组 10 13.60±1.90##
2.5.2 X光片观察结果 X线光片可观察到大鼠左侧股骨头部位存在囊性变以及骨硬化征象,部分动物有一定程度的股骨头节段性扁平化或者软骨下塌陷,呈新月状;植入细胞支架侧可见,股骨头坏死情况减轻,股骨头清晰,部分动物仅出现股骨头轻度变化,例如骨小梁清晰度较差、模糊情况。
2.5.3 股骨头大体观察结果 空白对照组股骨头:术后4、12、24周均可见关节面平整,呈半透明,瓷白色,无坏死及囊性变,股骨头无塌陷,髋臼与关节间隙正常。模型对照组股骨头:术后4、12、24周均可见大鼠可见股骨头塌陷,关节间隙轻度变窄,股骨变脆。随着时间的推移,股骨头塌陷程度变重,脆性增加。支架组股骨头:术后4周移植物周围有红色结缔组织出现,股骨头坏死区及囊性变存在,个别动物出现股骨头塌陷。12周可移植物与周围组织界限模糊,股骨头关节面平整,坏死区与囊性变丧逐渐修复,股骨头未见塌陷。24周可见移植物与周围正常组织界限基本消失,股骨头坏死区与囊性变逐渐修复,股骨头无塌陷。见图4、图5。
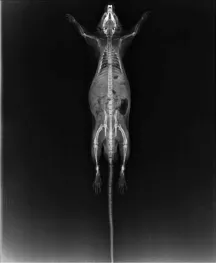
图4 大鼠俯卧整体X光片图Fig.4 Rat prone overaIIX ray fiIm

图5 大鼠股骨头X光片图Fig.5 Rat femoraIhead X ray fiIm
2.5.4 光镜观察结果 空白对照组:软骨片光滑,软骨细胞排列整齐,粘合线均匀规则,骨髓腔见少量充血。模型对照组:软骨面骨细胞部分变性、坏死,表面呈锯齿状,部分出现塌陷,骨髓腔出血,部分滑膜变性、坏死。支架组:纤维软骨及软骨关节面表面光滑,纤维软骨下部分呈疏松状,部分软骨不规则,可见少量粘合线,极少部分软骨细胞破坏。光镜观察结果见图6。
3 讨论

图6 大鼠股骨头光镜下观察结果Fig.6 Observation of rat femoraI head under Iight m icroscope
股骨头缺血性坏死是一种致死率和致残率极高的骨科疾病,目前采用的关节置换术和药物治疗都存在一定的局限性,而采用低侵袭性方法保存自体股骨头是治疗该病的发展趋势。基于种子细胞、细胞因子及支架材料的 “干细胞疗法”的出现,为股骨头缺血性坏死的治疗提供了新途径。组织工程学技术主要将体外培养的活细胞种植于人工合成的或天然细胞外基质上,再将它们移植到体内,达到形成与原有组织所具备的功能的新生组织的目的。本实验将鹿角胶-壳聚糖支架用作植入成骨细胞的载体,搭载成骨细胞移植到体内,提供生长所需的微环境,使其迅速生长后替代已经坏死的骨组织。实验结果表明,植入体内后支架与周围组织结合紧密,材料周围未发现炎性细胞浸润,无明显的炎症反应、排异反应,行走跛行,关节活动受限逐步得到改善,表明材料能有效地发挥支架作用。肉眼观察股骨头部位移植物与周围正常组织界限逐渐消失,股骨头坏死逐渐修复。X光观察,塌陷消失,坏死区与囊性变逐渐修复,股骨头恢复形状完整、结构恢复清晰,移植物逐渐在视野上消失。组织切片观察到支架组可以见到少量粘合线,骨细胞部分变性、坏死状态得到改善。动物体内实验结果表明,支架能激发成骨细胞活力,调节骨的代谢,促进新骨生长,保护骨重建功能的顺利进行,对于治疗股骨头坏死具有重要的意义。
[1] 穆晓红,赵子义,徐 林,等.纳米材料支架与骨髓间充质干细胞构建纳米骨修复兔股骨头坏死[J].中国组织工程研究与临床康复,2010,14(51):9582-9586.
[2] 文鹏飞,宋克东,刘天庆,等.壳聚糖支架材料的制备、表面修饰及细胞粘附性能的研究[J].高校化学工程学报,2008,22(6):992-998.
[3] Sultana N,Khan TH,Mokhtar M,et al.Composite scaffolds based on poly(caprolactone)and chitosan for bone tissue regeneration[J].Adv Sci Lett,2013,19(1):162-165.
[4] 孙克民,王和鸣,陈文列,等.复方巴戟天合剂对大鼠激素性股骨头缺血性坏死的组织学研究[J].湖南中医药大学学报,2011,31(7):14-17.
[5] 马焕芝,曾炳芳,李晓林,等.甲基强的松龙联合内毒素诱导兔股骨头缺血性坏死的实验研究[J].中国修复重建外科杂志,2008,22(3):265-270.
[6] 谢志涛,赵德伟,江 磊,等.甲强龙联合内毒素诱导犬股骨头坏死的实验研究[J].中国骨与关节损伤杂志,2014,29(6):570-571.
[7] 师 彬,王 平,孙国栋.仙鹿活骨丸对大鼠股骨头缺血性坏死的干预治疗作用[J].上海中医药杂志,2008,42(10):70-72.
[8] Pharhat B,Peng H,LiB B,etal.Effects of antler powder on treatment of corticosteroid induced avascular necrosis of the femoral head in rats[J].JGlin Rehabil Tissue Eng Res,2011,15(24):4541-4544.
[9] 张怡元,林 煜,冯尔宥,等.钽块支撑治疗犬股骨头缺血性坏死模型的实验研究[J].中国中医骨伤科杂志,2014,22(6):1-4.
[10] 王艳梅.X线在股骨头缺血性坏死诊断中的价值分析[J].中国现代药物应用,2014,8(16):29-30.
[11] 张德洲,易雪冰,钟 鉴.不同病因致股骨头缺血性坏死的影像对比[J].中国组织工程研究,2013,17(48):8455-8460.
[12] 李顺东,许 超,童培建,等.股骨头缺血性坏死常用分期体系的回顾与评价[J].中医正骨,2014,26(4):36-39.
AntIer gIue-chitosan scaffoIds repairing the experim entaI avascu Iar necrosis of femoraIhead in rats
SUN Tie-feng1,2, WANG Ping2*
(1.Shandong University of Traditional GhineseMedicine,Jinan 250355,Ghina;2.Shandong Academy of GhineseMedicine,Jinan 250014,Ghina)
AIM To study the effect of antler glue-chitosan scaffolds on repairs to avascular necrosis of the femoral head in rats.METHODS NeonatalWistar rat osteoblasts were cultured and separated by enzyme digestion under sterile condition.The osteoblast cellswere seeded onto aseptic antler glue-chitosan scaffold prepared by physicalmethod and placed in the femoralhead position with avascular necrosis.RESULTS Antler glue-chitosan scaffold not only facilitated osteoblast proliferation and vitality,but also improved the functional limitation of joints in model rats.X ray observation revealed the gradual changes of femoral head necrosis area and cystic degeneration.Lightmicrograph showed that this treatment lightened the partial denaturation and necrosis of bone cells. CONCLUSION Antlergelatin-chitosan cell scaffold has a good effecton repairs to avascular necrosis of the femoral head.
osteoblasts;antler glue-chitosan scaffolds;avascular necrosis of the femoral head;rats
R965.2
A
1001-1528(2015)11-2337-05
10.3969/j.issn.1001-1528.2015.11.001
2014-12-12
国家自然科学基金项目 (81273776);山东省自主创新重大计划项目 (2014GSF118026);山东省科技发展专项(2012G0021846);济南青年科技明星计划 (济科合字 [2012]第01-42号)
孙铁锋(1989—),男,硕士生,研究方向为中药药理。Tel:(0531)82949847,E-mail:suntiefenglove@163.com
*通信作者:王 平 (1974—),女,副研究员,硕士生导师,研究方向为中药药理。Tel:(0531)82949847,E-mail:wangpingjinan @163.com

