紫荆花中多糖的微波提取工艺优化及其抗氧化活性
卫 强,桂 芹,邱 镇,徐 飞,纪小影
(安徽新华学院药学院,安徽 合肥 230088)
紫荆花中多糖的微波提取工艺优化及其抗氧化活性
卫 强,桂 芹,邱 镇,徐 飞,纪小影
(安徽新华学院药学院,安徽 合肥 230088)
在单因素试验的基础上,采用Box-Behnken试验设计和响应面分析法,研究提取时间、微波功率、液料比对紫荆花中多糖提取量的影响,建立影响因素与响应值之间的数学模型,确立最佳提取工艺。同时,以1,1-二苯基-2-三硝基苯肼自由基清除能力、还原Fe3+能力、羟自由基清除能力验证紫荆花中多糖的抗氧化活性。结果表明,紫荆花中多糖的最佳提取工艺为:提取时间16 min、液料比40∶1(mL/g)、微波功率2 kW。此条件下提取量可达30.81 mg/g。抗氧化实验结果表明,紫荆花多糖有一定抗氧化活性。比较微波和煮沸两种方法提取的紫荆花多糖活性和提取效率,发现微波提取更佳。
紫荆花;微波提取;多糖;响应面法;抗氧化
紫荆花(Cercis chinensis Bunge)系豆科紫荆属植物,在我国作为景观植物种植广泛。紫荆花具有活血通经、消肿止痛、解毒等功效,用于治疗月经不调、风湿性关节炎、风湿筋骨痛、鼻中疳疮等症[1]。食品工业上还可以提供天然食用红色素等[2-3]。国内研究表明,紫荆乙醇提取物对癌细胞的细胞周期有明显抑制作用,并能诱导癌细胞凋亡[4]。另外,紫荆叶提取物具有显著镇痛、消炎作用,可增强小鼠耐缺氧和抗疲劳的能力[5]。
研究[6-8]发现,人类90%以上疾病源于氧自由基导致的人体正常细胞和组织损伤,进一步诱发炎症、肿瘤、帕金森病、老年痴呆症和心脏病等疾病。多糖及其复合物参与和介导了细胞各种生命活动的调节,具有抗衰老、抑肿瘤、降血脂、降血糖作用[9-10]。国内学者研究证实了紫荆花黄酮类成分的抗氧化活性[11],但对其多糖成分的研究未见报道。本实验对紫荆花中多糖类成分进行提取和抗氧化研究,以期为进一步开发应用其丰富的资源提供参考。
1 材料与方法
1.1 材料与试剂
紫荆花采自合肥大蜀山区。
葡萄糖 上海士锋生物科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 北京索莱宝科技有限公司;其他试剂均为分析纯;水为纯化水。
1.2 仪器与设备
LDZ4-1.2型低速离心机 北京京立离心机有限公司;KJ-SY-150超声提取器 北京同德创业科技有限公司;CNWB-C型微波萃取器 广州万程微波设备有限公司;UV-4802型紫外-可见分光光度计 美国尤尼柯仪器有限公司。
1.3 方法
1.3.1 微波提取工艺流程
紫荆花(5 g)→低温烘干,粉碎→紫荆花粗粉→以体积分数90%、60%乙醇溶液分别超声提取3~4 次→抽滤,弃去滤液,残渣加水以微波浸提→浓缩→离心→Sevag法除蛋白→紫荆花粗多糖→测定含量
1.3.2 微波提取工艺优化
1.3.2.1 单因素试验
设定水与紫荆花液料比30∶1(mL/g)、微波功率3 kW,考察不同提取时间(4、8、12、16、20、24 min)对多糖提取量的影响;固定水与紫荆花液料比30∶1(mL/g)、提取时间12 min,研究不同微波功率(0.5、1、2、3、4、5 kW)对多糖提取量的影响;固定提取时间12 min、微波功率3 kW,研究不同液料比(10∶1、20∶1、30∶1、40∶1、50∶1、60∶1)对多糖提取量的影响。
1.3.2.2 响应面试验
在单因素试验基础上,以Box-Behnken试验设计进行提取,以响应面分析最佳工艺。
1.3.3 多糖含量测定
精密称取葡萄糖标准品1 g,以水溶解定容于50 mL容量瓶中。精密移取 0.2、0.4、0.6、0.8、1.2、1.4 mL的葡萄糖标准液于25 mL具塞试管中,加蒸馏水至2.0 mL,加入1.0 mL 5%苯酚溶液,加入浓硫酸 5 mL,室温静置5 min,再于沸水浴中恒温15 min。取出,迅速置于冰水中维持10 min。取蒸馏水2.0 mL为参比,如上操作,于490 nm波长处测定吸光度。以吸光度为纵坐标、葡萄糖质量浓度为横坐标绘制标准曲线,计算含量[12]。多糖提取量计算公式如式(1)所示:
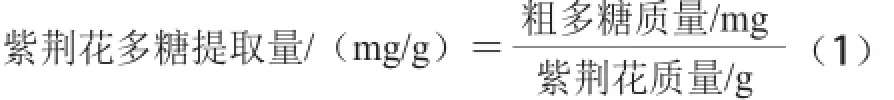
1.3.4 微波与煮沸提取比较
精密称取紫荆花5 g两份,一份以提取时间16 min、液料比40∶1、微波功率2 kW为参数,重复提取3次(第1次16 min,第2次8 min,第3次8 min);另一份加入40 倍水煮沸提取3次(第1次2 h,第2次1 h,第3次0.5 h),将不同提取液分别减压浓缩至约200 mL,按照1.3.1节和
1.3.3 节方法进行纯化和含量测定。
1.3.5 紫荆花多糖清除DPPH自由基能力
精密称定DPPH化合物0.019 2 g,以甲醇溶解,移入250 mL容量瓶,得到浓度为0.2 mmol/mL的溶液,冰箱冷藏,备用。
分别精密称定紫荆花多糖和VC各0.05 g,以90%乙醇溶解,定容25 mL,再稀释至5 组不同质量浓度的溶液,分别取1 mL稀释液,加入1 mL上述浓度为0.2 mmol/mL的DPPH溶液,以90%乙醇溶液为空白,避光反应30 min,于波长517 nm波长处测定吸光度,以式(2)计算自由基清除率[13]。
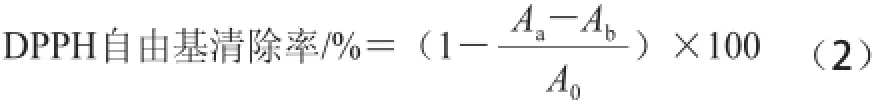
式中:Aa表示样品溶液吸光度;Ab表示空白溶液吸光度;A0表示VC溶液吸光度。
1.3.6 紫荆花多糖还原Fe3+能力
采用普鲁士兰法测定样品还原Fe3+能力。取10 mL具塞比色管,依次加入不同质量浓度的紫荆花多糖和VC溶液各2.0 mL、磷酸盐缓冲液(0.2 mol/L,pH 6.6)2 mL和1 g/100 mL的铁氰化钾2 mL,摇匀,于50 ℃水浴中反应20 min,加入10%三氯乙酸2.0 mL,摇匀,离心10 min(2 500 r/min),取上清液2.0 mL,加入2.0 mL蒸馏水和1 g/100 mL的三氯化铁1.0 mL,以相应试剂为参比,在700 nm波长处测定吸光度[14]。
1.3.7 紫荆花多糖清除羟自由基能力
利用H2O2与Fe2+产生•OH,•OH进一步与水杨酸反应,产生有色产物,该有色成分在510 nm波长处有吸收。
固定反应时间,取相同体积的反应体系溶液(8.8 mmol/L H2O21 mL、9 mmol/L Fe2+1 mL、9 mmol/L水杨酸乙醇溶液1 mL),加入不同质量浓度的紫荆花多糖和VC溶液,以蒸馏水为参比,于510 nm波长处测定吸光度[14],以式(3)计算羟自由基清除率。
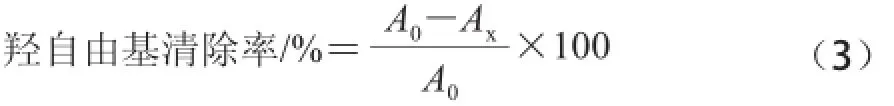
式中:Ax表示样品溶液吸光度;A0表示VC溶液吸光度。
1.4 数据分析
以Design-Expert 8.0.6统计软件进行Box-Behnken试验设计和分析。
2 结果与分析
2.1 单因素试验结果
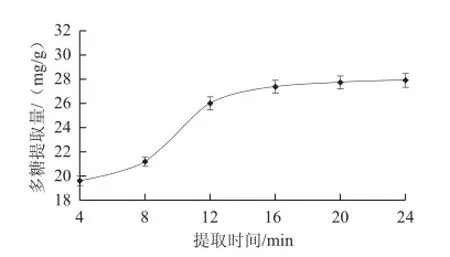
图1 提取时间对多糖提取量的影响Fig.1 Effect of extraction time on the extraction rate of polysaccharides
2.1.1 提取时间对多糖提取量的影响如图1所示,随着提取时间的延长,紫荆花多糖提取量逐步增加。以4~12 min增加较快,16 min后增加缓慢。其原因可能是提取时间延长可明显提高微波的反射、吸收和穿透效果,提高提取量。当达到提取峰值时,一次提取产生的细胞内外浓度差达到平衡时,提取量不再增加。考虑时间和成本因素,提取时间选择12~20 min较好。
2.1.2 微波功率对多糖提取量的影响
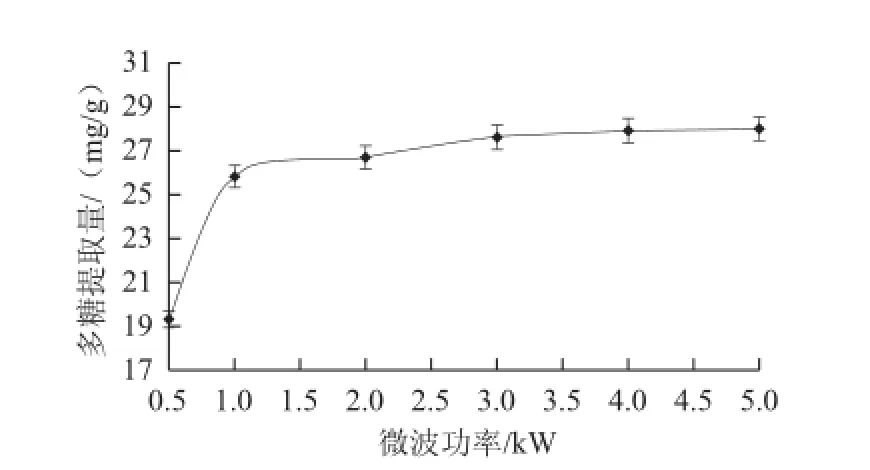
图2 微波功率对多糖提取量的影响Fig.2 Effect of microwave power on the extraction rate of polysaccharides
如图2所示,随着微波功率的增强,紫荆花多糖的提取量逐步增加。在0.5~1.0 kW范围内多糖提取量增加快速,在1.0~5.0 kW范围内多糖提取量增加缓慢。这可能是由于0.5~1.0 kW范围内微波可辐射植物维管束和腺细胞,使细胞内部快速升温,达到产生膨胀破裂的临界内压,在此范围内破壁能力逐步增强。但大于3 kW后破壁能力达到极限,溶剂挥发加快,反而不利于细胞内含物外溢。考虑成本因素,微波功率选择1~3 kW较好。
2.1.3 液料比对多糖提取量的影响
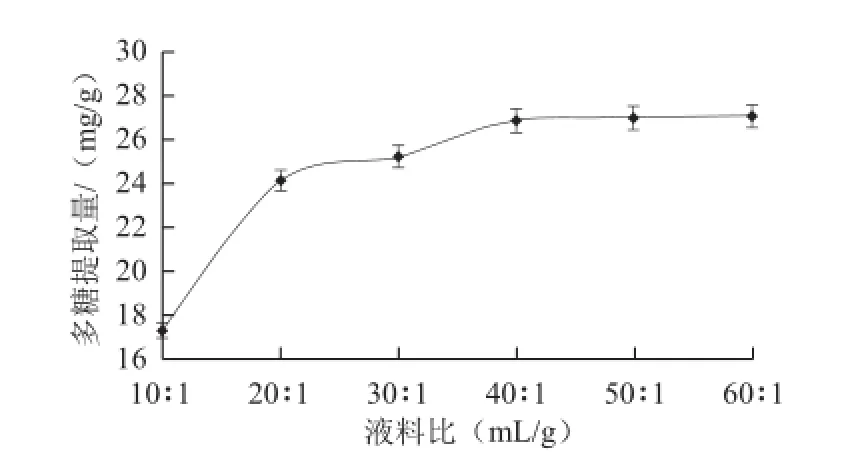
图3 液料比对多糖提取量的影响Fig.3 Effect of solvent-to-solid ratio on the extraction rate of polysaccharides
如图3所示,在液料比10∶1~40∶1范围内,紫荆花多糖提取量快速增加;在液料比40∶1~60∶1范围内,紫荆花多糖提取量增加缓慢。其原因是液料比增加有利于提高细胞内外的浓度差,提高细胞壁内外物质交换容量,增加提取量。当单次提取接近细胞内外浓度平衡时,提取量增加缓慢。考虑成本因素,液料比选择30∶1~50∶1较好。
2.2 响应面试验结果
2.2.1 Box-Behnken试验设计与结果
由Box-Behnken试验设计,在单因素试验基础上选取提取时间、液料比、微波功率3 个因素考察进行响应面分析,以紫荆花多糖含量为响应值,试验结果见表1、2。

表1 响应面试验设计与结果Table1 Experimental deesign and results for respponse surface methodology
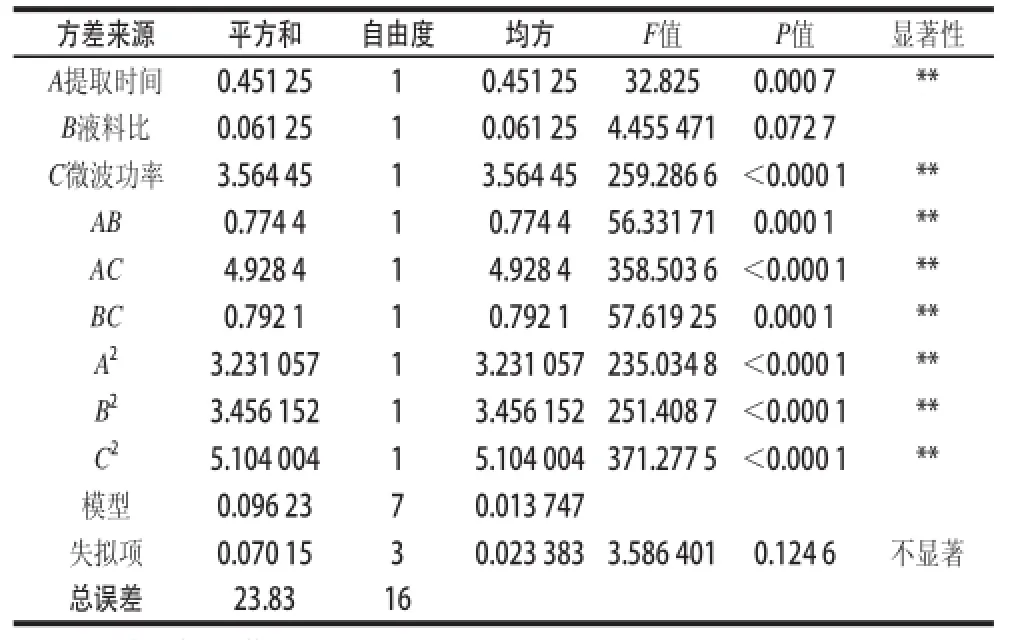
表2 方差分析和显著性检验结果Table 2 Analysis of variaance and significance tess
由表2可知,提取时间、微波功率一次项及提取时间、液料比和微波功率二次项,提取时间与液料比、提取时间与微波功率、液料比与微波功率的交互项P值均小于0.01,说明对提取量的影响极显著。失拟项检验P值显示不显著,表明模型充分拟合,受其他因素影响小。经显著性检验,该模型的相关系数R2=0.996 0,说明该模型与实际试验拟合较好,自变量与响应值线性关系显著。得到回归方程如下:
Y=30.08—0.24A+0.087B+0.67C—0.44AB+ 1.11AC—0.44BC—0.88A2—0.91B2—1.10C2
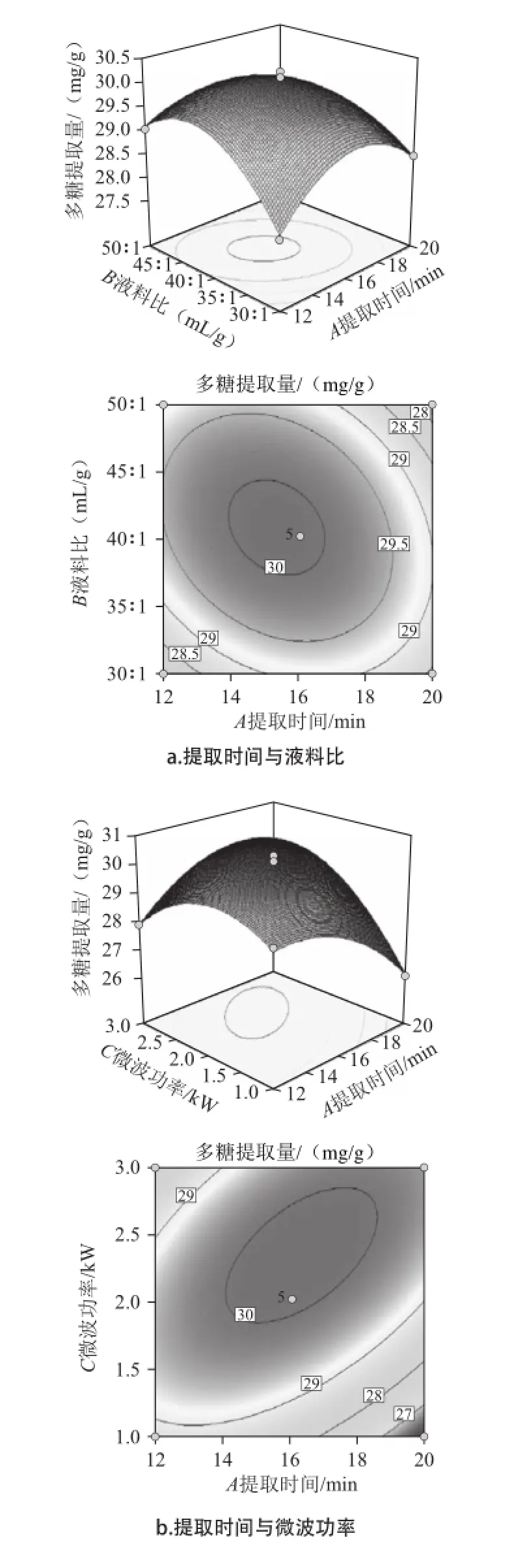
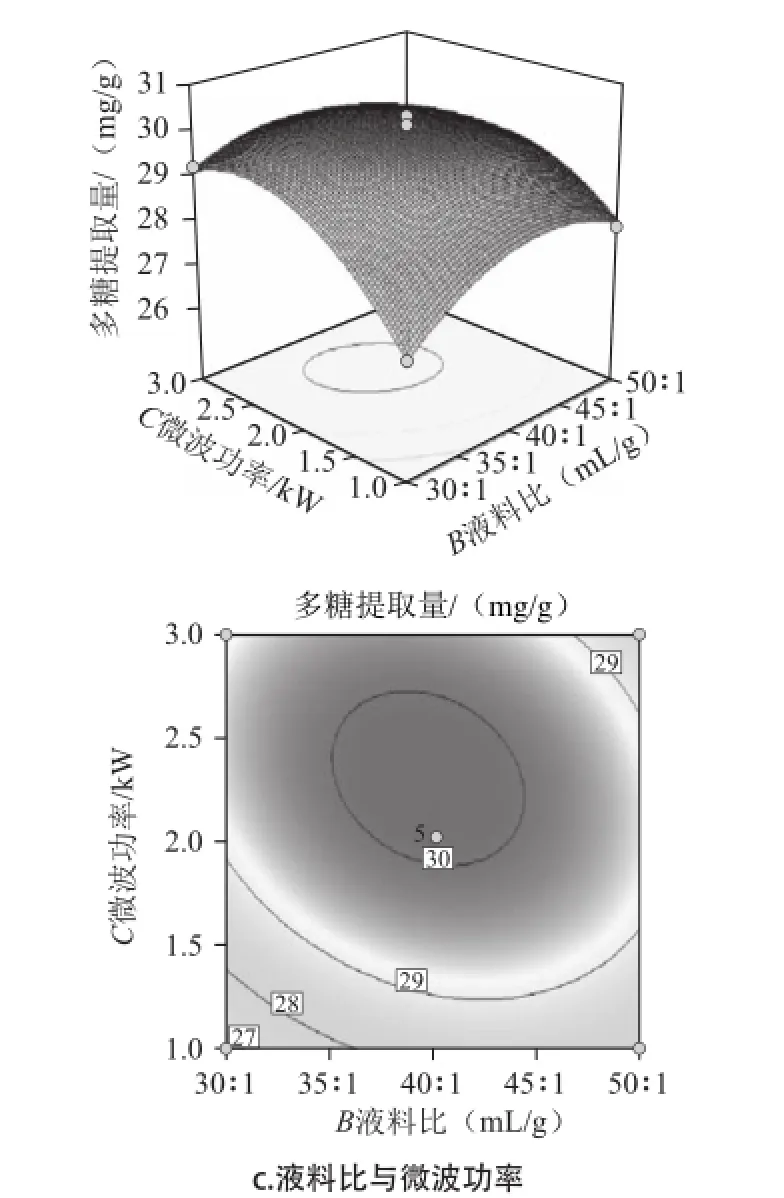
图4 各因素交互作用对紫荆花中多糖提取的响应面和等高线图Fig.4 Response surface and contour plots for the interaction effects of extraction parameters on the extraction rate of polysaccharides from Cercis chinensis Bunge
根据回归分析结果,作出响应面图,如图4所示。三组图直观地反映了各因素对响应值的影响。响应面图是响应值Y对应于试验因素A、B、C所构成的三维空间曲面图及其在二维平面上的等高线图,响应面可直观反映3个因素之间及两者之间的交互作用对响应值的影响[15]。等高线的形状可反映出交互效应的强弱,椭圆形表示两因素交互作用显著,而圆形则与之相反[16]。结合表2的P值,由图4a可知,液料比和提取时间交互作用为极显著水平(P<0.001),等高线呈椭圆形;当微波功率固定,随着液料比增加和提取时间的延长,多糖提取量呈现先快速提高后缓慢减小的趋势。从等高线上看,提取时间16 min、液料比40∶1附近值对提高含量有重要影响。由图4b可知,微波功率和提取时间交互作用为极显著水平(P<0.000 1),等高线椭圆形;当液料比固定,随着微波功率增加和提取时间的延长,多糖提取量呈现先快速提高后快速减小的趋势,提取时间对多糖含量影响较大。从等高线上看,微波功率2 kW、提取时间16 min附近值对提高含量有重要影响。由图4c可知,微波功率和液料比交互作用为极显著水平(P<0.001),等高线椭圆形;当提取时间固定,随着微波功率和液料比两个因素的增加,多糖提取量呈现先快速提高后缓慢减小的趋势,表明当达到微波功率2 kW、液料比40∶1后,对多糖提取量影响相对较小。
2.2.2 验证性实验及提取次数考察
对试验模型进行分析,得出紫荆花多糖提取最优工艺参数为提取时间16 min、液料比40∶1、微波功率2 kW,此最优工艺条件下紫荆花粗多糖提取量理论值为30.80 mg/g。采用优化提取条件进行多糖的工艺验证实验,测得紫荆花多糖平均提取量为30.81 mg/g(n=3,相对标准偏差1.28%),与理论预测值相比,相对偏差较小。以上述优化条件提取5 次(第1次16 min,后面均为8 min),提取量分别为30.77、26.32、19.10、6.01、2.36、1.06 mg/g,考虑到提取成本,3次提取可满足工艺要求。
2.3 微波与煮沸提取比较
经过3 次提取,分别得到煮沸法提取多糖(polysaccharide of Cercis chinensis bunge-boiling extraction,PCCB-BE)和微波提取多糖(polysaccharide of Cercis chinensis bunge-microwave extraction,PCCBME),测定含量,分别为52.17、76.16 mg/g,可见微波提取多糖含量较煮沸法高出23.99 mg/g,而时间上较煮沸法提取节省近3 h。
2.4 紫荆花多糖清除DPPH自由基能力

图5 紫荆花多糖对DPPH自由基的清除能力Fig.5 DPPH radical-scavenging activity of polysaccharides from Cercis chinensis Bunge
由图5可知,随着紫荆花多糖和VC质量浓度的增加,对DPPH自由基清除能力逐步增强。当达到50%清除率时,PCCB-ME、PCCB-BE和VC的质量浓度分别为0.468、0.568、0.647 mg/mL,对DPPH自由基清除能力大小依次为PCCB-ME>PCCB-BE>VC。
2.5 紫荆花多糖还原Fe3+能力
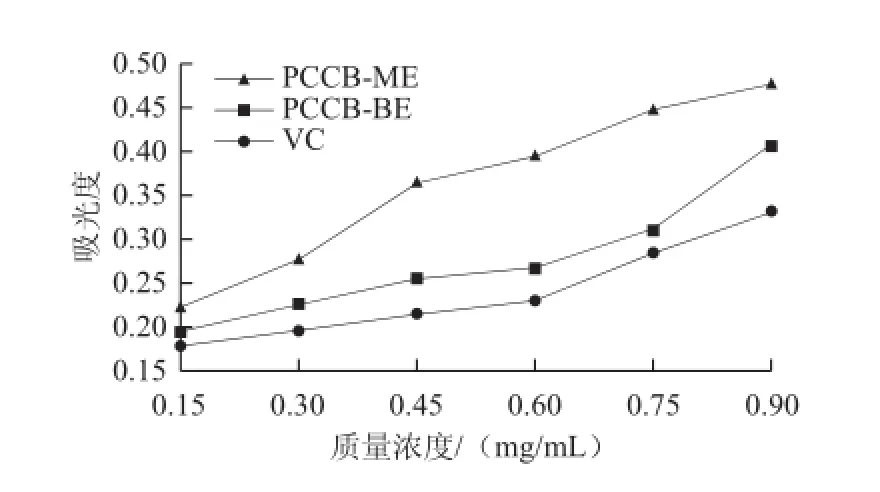
图6 紫荆花多糖还原Fig.6 Fe3+reducing power of polysaccharides from Cercis chinensis Bunge
由图6可知,当吸光度为0.3时,PCCB-ME、PCCB-BE和VC的质量浓度分别为0.339、0.618、0.830 mg/mL,可见还原Fe3+能力大小依次为PCCB-ME>PCCB-BE>VC。
2.6 紫荆花多糖清除羟自由基能力
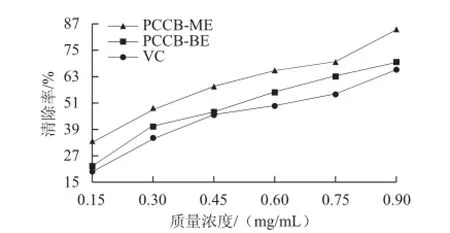
图7 紫荆花中多糖清除羟自由基能力Fig.7 ・OH radical-scavenging activity of polysaccharides from Cercis chinensis Bunge
由图7可知,当羟自由基达到50%清除率时,PCCBME、PCCB-BE和VC的质量浓度分别为0.355、0.531、0.608 mg/mL,对羟自由基清除能力大小依次为PCCBME>PCCB-BE>VC。
3 结 论
微波根据所遇介质性质不同会产生反射、吸收和穿透现象[17]。微波辐射植物维管束和腺细胞,使细胞内部快速升温,内压提高,细胞壁膨胀破裂,提高溶剂活性细胞,内含物流出而溶解在溶剂中[18-21]。本实验以微波辅助提取紫荆花中多糖,瞬间破壁作用快速提出多糖成分,以Box-Behnken试验设计和响应面分析法优选最佳工艺条件为:提取时间16 min、液料比40∶1、微波功率2 kW。以此工艺单次提取得到的紫荆花多糖提取量为30.81 mg/g,3 次提取量为76.16 mg/g。而煮沸法3 次提取的紫荆花多糖平均含量为52.17 mg/g,且提取时间较微波提取长3 h。
目前,合成抗氧化剂(如丁基羟基茴香醚)有致毒和致癌性[22-23]。天然多糖能平衡机体氧化反应,可通过直接清除活性氧,络合产生活性氧所必须的金属离子等途径实现抗氧化作用[24-26],且无毒副作用。本实验考察了微波提取紫荆花多糖清除DPPH自由基、清除羟自由基和还原Fe3+能力3个方面的作用,当清除DPPH自由基和羟自由基达到50%清除率时,PCCB-ME质量浓度最低(分别为0.468、0.355 mg/mL),当还原Fe3+吸光度为0.3时,PCCB-ME质量浓度最低(0.339 mg/mL),证实微波提取的紫荆花多糖具有明显的抗氧化活性优势。这可能是由于微波为高效、瞬时提取,而煮沸法由于长期高温氧化破坏多糖结构的完整性,进而影响到其活性。
[1] 谢宗万. 全国中草药汇编: 下册[M]. 2版. 北京: 人民卫生出版社, 1996: 617.
[2] 李尚德, 关雄泰, 徐美亦. 紫荆花微量元素含量测定[J]. 广东医学院学报, 1994, 12(2): 142-143.
[3] 康四和, 邓海英. 湖北紫荆皮植物学及生药鉴定研究[J]. 时珍国医国药, 2010, 21(1): 185-187.
[4] 袁云香. 紫荆的应用价值与栽培研究[J]. 林业实用技术, 2012(4): 49-51.
[5] 张颖, 张立木, 李同德, 等. 紫荆叶对模型小鼠的消炎镇痛及耐缺氧抗疲劳作用研究[J]. 中国药房, 2009, 20(36): 2817-2818.
[6] 邓薏. 近五年国内中药抗氧化作用研究进展: 上[J]. 中药药理与临床, 2012, 28(6): 155-162.
[7] NYSTROM T. The free-radical hypothesis of aging goes prokaryotic[J]. Cellular and Molecular Life Science, 2003, 60(7): 1333-1341.
[8] 刘洁, 李文香, 王文亮, 等. 生物多糖研究进展[J]. 山东农业科学, 2011(5): 98-101.
[9] 罗祖友, 吴季勤, 吴谋成. 植物多糖的抗氧化与抗病毒活性[J]. 湖北民族学院学报: 自然科学版, 2007, 25(1): 77-81.
[10] KOH J H, KIM K M, KIM J M, et al. Antifatigue and antistress effects of the hot-water extract from mycelia of Cordyceps sinensis[J]. Biological and Pharmaceutical Bulletin, 2003, 26(5): 691-694.
[11] 陈志红, 徐美奕, 龚先玲. 紫荆花黄酮类化合物体外抗氧化活性研究[J]. 化学世界, 2010(7): 401-403.
[12] 汤彬, 薛平, 李祥, 等. 南方红豆杉多糖的含量测定及体外降血糖活性研究[J]. 食品工业科技, 2013, 34(9): 128-131; 136.
[13] 宋海璐, 周琼花, 严婷婷, 等. 夏枯草色素的抗氧化活性研究[J]. 中国野生植物资源, 2013, 32(3): 33-34.
[14] 王冬梅, 吕振江, 王永红, 等. 不同炮制方法对玉竹提取物得率及体外抗氧化作用的影响[J]. 植物研究, 2012, 32(5): 621-626.
[15] 乔孟, 屈晓清, 丁之恩. 响应面法优化超声波辅助提取湖北海棠叶中总黄酮工艺[J]. 食品科学, 2013, 34(2): 143-147.
[16] 杜玉兰, 黎庆涛, 王远辉. 响应曲面法优化鼠尾藻中脂质的提取工艺[J]. 天然产物研究与开发, 2008, 20(6): 1091-1094.
[17] 邓湘庆, 龚盛昭. 微波辅助萃取中药有效成分的研究进展[J]. 广东化工, 2006, 33(12): 89-92.
[18] JOCELYN PAR☒ J R, MICHEL S, JACQUES L. Microwave-assisted natural products extraction: US, 5002784[P]. 1991-03-26.
[19] JACOB J, CHIA L H L, BOEY F Y C. Review-thermal and nonthermal interaction of microwave radiation with materials[J]. Journal of Materials Science, 1995, 30: 5321-5327.
[20] 郝金玉, 韩伟, 邓修. 新鲜银杏叶经微波辅助提取后微观结构的变化[J]. 中草药, 2002, 33(8): 739-741.
[21] GAO Shan, HAN Wei, DENG Xiu. Study of the mechanism of microwave-assisted extraction of Mahonia bealei (Fort.) leaves and Chrysanthemum morifolium (Ramat.) petals[J]. Flavour and Fragrant Journal, 2004, 19(3): 244-250.
[22] SAITO M, SAKAGAMI H, FUJISAWA S. Cytotoxicity and apoptosis induction by butylated hydroxyanisole (BHA) and butylated hydroxytoluene (BHT)[J]. Anticancer Research, 2003, 23(6C): 4693-4701.
[23] ZHANG Hao, JIANG Lu, YE Shu, et al. Systematic evaluation of antioxidant capacities of the ethanolic extract of different tissues of jujube from China[J]. Food and Chemical Toxicology, 2010, 48(6): 1461-1465.
[24] 郑德勇, 安鑫南. 植物抗氧化剂研究展望[J]. 福建林学院学报, 2004, 24(1): 88-91.
[25] 杨玉红, 郝慧敏. 药用植物多糖的生物学功能及应用研究进展[J].生物学教学, 2013, 38(1): 6-8.
[26] TSUDA T, SHIGA K, OHSHIMA K. Inhibition of lipid peroxidation and active oxygen radical scavenging effect of anthocyanin pigments isolated from Phaselous vulgaris L.[J]. Biochemical Pharmacology, 1996, 52: 1033-1039.
Microwave-Assisted Extraction and Antioxidant Activities in vitro of Polysaccharides from Cercis chinensis Bunge Flowers
WEI Qiang, GUI Qin, QIU Zhen, XU Fei, JI Xiaoying
(College of Pharmacology, Anhui Xinhua University, Hefei 230088, China)
The microwave-assisted extraction of polysaccharides from Cercis chinensis Bunge flowers was optimized with the combined use of single-factor method and response surface methodology based on Box-Behnken design. A regression surface model was developed indicating the effects of three operating parameters on extraction efficiency. The antioxidant activity of the extracted polysaccharides was evaluated by DPPH, hydroxyl radical scavenging and Fe3+reducing power assays. The optimal extraction conditions were determined as a solvent to flower ratio of 40:1 (mL/g), 16 min extraction time and 2 kW microwave power, resulting in an extraction yield of 30.81 mg/g. Antioxidant tests indicated that the polysaccharides obtained by microwave-assisted extraction had antioxidant activity higher than that of those extracted by boiling. Moreover, the former method gave a higher yield of polysaccharides.
Cercis chinensis Bunge; microwave-assisted extraction; polysaccharides; response surface analysis; antioxidant activity
TS201.1
A
1002-6630(2015)04-0039-06
10.7506/spkx1002-6630-201504008
2014-07-09
国家大学生创新创业训练项目(201312216028;201312216029);安徽省质量工程项目(2013gxk105);安徽新华学院质量工程项目(2013gxkcx01)
卫强(1977—),男,副教授,硕士,主要从事药学教学与科研。E-mail:weiqiang509@sina.com

