HPLC法测定清热暗疮丸中绿原酸的含量
岳 莉,戚继红,沈 伟
(安徽省淮北市食品药品检验中心,安徽淮北 235000)
清热暗疮丸是由金银花、大黄浸膏、穿心莲浸膏、人工牛黄、蒲公英浸膏、珍珠层粉、山豆根浸膏、甘草、栀子浸膏等九味中药制成的中药制剂,具有清热解毒,凉血散瘀,泻火通腑之功效,临床用于治疗痤疮(粉刺),疖痛。该产品收载于《卫生部药品标准》中药成方制剂第六册,原标准没有有效成分的含量测定。金银花为其处方中君药之一,主要成分为绿原酸,具有抗菌、抗病毒活性。为了有效控制该产品的质量,经参考有关文献及《中国药典》2010年版一部[1]方法,本文采用高效液相色谱法测定金银花中绿原酸的含量,用于本制剂的质量控制。
1 仪器及试药
1.1 仪器 Thermo U-3000 HPLC色谱系统;ChromeleonTM7工作站;Thermo DAD-3000检测器;超声波处理器(济宁奥波超声电气有限公司,批号:JAC-300);Mettler AE-240电子分析天平(0.1 mg;0.01 mg)。
1.2 试药 绿原酸对照品(中国药品生物制品检定所,批号:110753-200413,供含量测定用);清热暗疮丸,来源:我所监督抽样样品(吉林省天光药业有限 公 司,批 号:20130201,20130204,20130307,20130312);乙腈、磷酸为色谱纯;甲醇为分析纯,水为重蒸馏水。
2 方法与结果
2.1 色谱条件及系统适用性试验[2-4]色谱柱:十八烷基硅烷键合硅胶为填充剂,Thermo C18(250 mm×4.6 mm,5 μm);流动相为乙腈—0.4%磷酸溶液(14∶86);流速:1.0 mL·min-1;柱温:25℃;进样量:10 μL;检测波长 327 nm[2]。
2.2 溶液的制备
2.2.1 对照品储备液的制备 精密称取绿原酸对照品12.78 mg,置50 mL棕色量瓶中,用适量50%乙醇溶解,超声,冷却定容,摇匀,即得浓度为255.6 mg·L-1的绿原酸对照品储备液。见图1。
2.2.2 供试品溶液的制备 取本品20丸,研细,取细粉约0.54 g(相当于4丸的重量),精密称定,置25 mL棕色量瓶中,加入50%乙醇适量,置超声仪中超声30 min,放冷至室温,用50%乙醇稀释至刻度,摇匀,过滤,取续滤液,用0.45μm微孔滤膜过滤,即得供试品溶液。见图2。
2.2.3 样品阴性对照溶液 按清热暗疮丸的处方,称取除金银花的粉末约0.54 g,按供试品制备方法制备阴性对照溶液。在供试品色谱图中,与对照品色谱相应的位置上有着相同保留时间的色谱峰,而阴性溶液在此保留时间无色谱峰出现,表明没有其它成分干扰峰。见图3。
2.3 方法学考察
2.3.1 线性关系的考察 分别精密量取对照品储备液0.5、1、4、10、20、30 mL 置 50 mL 棕色量瓶中,加50%乙醇稀释至刻度,按上述色谱条件,精密吸取上述对照品溶液及储备液10μL,注入液相色谱仪,记录色谱图。以对照品的峰面积(A)为纵坐标,对照溶液浓度为横坐标(mg·L-1),得绿原酸的线性回归方程为 Y=0.532 5X-0.077 71(r=0.999 99),在 2.556 ~ 255.6 mg·L-1的范围内具有良好的线性关系。
2.3.2 检测限 按信噪比3∶1计,绿原酸的检出限为 0.051 mg·L-1。
2.3.3 专属性试验 精密吸取样品阴性对照溶液10μL,注入液相色谱仪,结果表明,阴性对照无干扰。
2.3.4 精密度试验 精密量取“2.2”项下10 mL对照品溶液,连续进样 5次,绿原酸的面积为27.079、27.051、27.037、27.129、27.039,RSD=0.039%,表明仪器精密度良好。
2.3.5 稳定性试验 取样品测定项下的供试品溶液(批号:20130201),分别在 0、2、4、6、8、10、12、14、18、30 h进样测试,记录色谱图,其峰面积的RSD为0.60%,提示在30 h内都可进行相对准确的定量分析。
2.3.6 重复性试验 取同一批号的样品(批号:20130201)6份,各测定2次,照样品测定项下方法测定,计算含量,绿原酸的平均含量为2.088 3 mg·g-1,RSD 为 0.69%,结果表明方法重复性良好。
2.3.7 加样回收率试验 精密称取已知含量的样品(批号:20130204),置25 mL棕色量瓶中,共9份,分成3组,每组分别精密加入含绿原酸51.12 mg·L-1对照品溶液液 4、5、6 mL,照“2.2.2”制备方法得加样回收率试验溶液,精密量取10μL注入液相色谱仪,按上述色谱条件测定,结果绿原酸平均回收率为99.8%,RSD=0.82%。结果见表1。
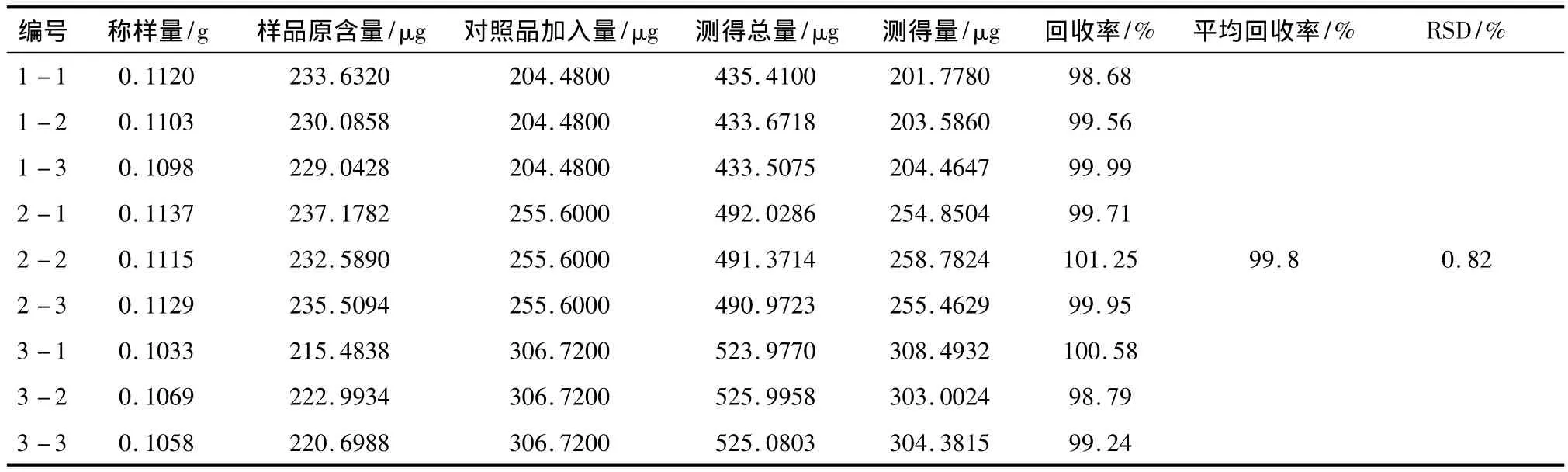
表1 绿原酸加样回收率
2.4 样品的测定 取本品3批(批号:20130201,20130307,20130312),各取2份,精密称取适量,置25 mL棕色量瓶中,照“2.2.2”制备方法得供试品溶液。精密量取10μL注入液相色谱仪,记录色谱图(见图2),用回归方程计算含量,结果见表2。

表2 绿原酸样品测定结果
3 讨论
绿原酸是由咖啡酸与奎尼酸形成的酯,其分子结构中有酯键、不饱和双键及多元酚三个不稳定部分。由于绿原酸的特殊结构,决定了其可以利用乙醇、丙酮、甲醇等极性溶剂从植物中提取出来,但是由于绿原酸本身的不稳定性,提取时不能高温、强光及长时间加热。绿原酸的供试液放置于棕色瓶、冰箱(2℃)保存时最为稳定。本文经过试验研究及参考相关资料,确定绿原酸的提取溶剂为50%甲醇,超声时间 30 min 最佳[5-6]。
因供试品含多组分物质,图谱中还有相关色谱峰,而绿原酸属于有机酸,在HPLC测定时易发生前沿或拖尾峰,流动相中加入酸可以改善峰形[7-9]。参考药典,通过调节流动相乙腈—0.4%磷酸的比例,绿原酸峰的保留时间约为8.0 min,所有成分全部出峰时间为35 min,柱效高,峰形好,绿原酸与其它相邻的色谱峰达到完全分离。
[1]国家药典委员会.中国药典(一部)[S].北京:中国医药科技出版社,2010:205-206.
[2]许 永,吕晓燕.HPLC法测定清痤颗粒中绿原酸的含量[J].安徽医药,2012,16(3):316-317.
[3]刘英慧,雷 鹏,朱 露,等.RP-HPLC法同时测定甘松中绿原酸和蒙花苷的含量[J].中国新药与临床药理,2012,23(3):318-321.
[4]王玲玲,王 凌,杨 菲,等.RP-HPLC法测定银黄颗粒中绿原酸和黄芩苷的含量[J].中国实验方剂学杂志,2012,18(12):124-126.
[5]李树鹏,刘凤鸣,刘 永.忍贝颗粒质量标准的研究[J].淮海医药,2012,30(4):351-353.
[6]徐庆仪.养阴清咽颗粒的质量标准研究[J].中国中医药现代远程教育,2013,11(10):156-158.
[7]高 茹,林以宁,梁 歌,等.绿原酸的吸收与代谢研究进展[J].中国实验方剂学杂志,2012,18(10):316-319.
[8]何小珍,郭 玉,徐小娜,等.野菊不同部位绿原酸和3,5-二咖啡酰奎尼酸的含量测定[J].中国实验方剂学杂志,2012,18(11):72-75.
[9]孙艳涛,王 冰,李云兴,等.金银花-连翘药对中绿原酸和连翘苷在大鼠各组织中的分布研究[J].中国实验方剂学杂志,2012,18(17):157-160.

