沉默信息调节因子2相关酶1及脂肪酸合成酶在非酒精性脂肪肝大鼠模型中的表达及意义*
史燕如,常艳,辛鹏,项琦,张美荣
(1.天津市南开医院营养科,天津 300100;2.天津市疾病预防控制中心,天津 300171)
·论著·
沉默信息调节因子2相关酶1及脂肪酸合成酶在非酒精性脂肪肝大鼠模型中的表达及意义*
史燕如1,常艳1,辛鹏2,项琦1,张美荣1
(1.天津市南开医院营养科,天津 300100;2.天津市疾病预防控制中心,天津 300171)
目的观察高脂、高糖喂养对大鼠非酒精性脂肪肝(NAFLD)的影响,探讨其沉默信息调节因子2相关酶1(Sirt1)及脂肪酸合成酶(FAS)的表达变化,进而揭示可能引起NAFLD发病的分子途径。方法Wistar雄性大鼠分为正常组和模型组,分别饲以基础饲料和高脂、高糖饲料。13周后处死,肝脏行苏木精-伊红(HE)染色和油红O染色,检测血清及肝匀浆总胆固醇(TC)、三酰甘油(TG)含量,应用实时逆转录聚合酶链反应(Real-time RT-PCR)和Western blot检测大鼠肝组织FAS、Sirt1的mRNA和蛋白表达水平。结果模型组大鼠体重、能量利用率、血清及肝脏TC和TG明显高于正常组。HE染色和油红O染色观察到模型组大鼠肝细胞脂肪明显变性。模型组肝脏Sirt1 mRNA水平与正常组比较,差异无统计学意义,但蛋白水平明显低于正常组;模型组肝脏中FAS mRNA和蛋白水平明显低于正常组。结论高脂、高糖喂养能使大鼠形成NAFLD,增加血清及肝脏的脂肪浓度。Sirt1表达降低提示其与NAFLD的发生有关,而FAS表达降低与以往部分研究结果截然不同,还需要更深层次的研究。
非酒精性脂肪肝;沉默信息调节因子2相关酶1;脂肪酸合成酶
非酒精性脂肪肝病(nonalcoholic fatty liver disease,NAFLD)是基因、环境、代谢应激等相关因素共同作用的结果,是以肝细胞脂肪堆积为主的临床病理综合征。西方国家NAFLD的患病率约为20%~30%,亚太地区接近12%~40%[1]。非酒精性脂肪肝的发生机制非常复杂,包括遗传因素、胰岛素抵抗、氧化应激等,其肝脏摄取和合成脂类的能力超过清除能力,即肝脏脂类的获得与清除没有达到平衡是重要的原因之一[2]。
脂肪酸合成酶(fatty acid synthase,FAS)是一种多功能的复合酶,是合成脂肪酸的关键酶,与体内脂质代谢密切相关。高脂、高糖饮食中的脂质以脂肪酸的形式被肝脏摄取,使肝脏三酰甘油(Triglycerides,TG)合成增多,容易形成脂肪肝[3]。然而国内外对非酒精性脂肪肝形成中FAS表达改变的研究结果迥异[4-7],还需深入研究。
沉默信息调节因子2相关酶1(silent information regulator 2/sirtuin1,Sirt1)是在哺乳动物细胞中发现的与酵母沉默信息调节因子Sir2同源性最高的同系物,是一类尼克酰胺腺嘌呤二核苷酸依赖的脱乙酰基酶,与代谢综合征的发生密切相关。Sirt1参与体内许多生理功能的调节,包括众多基因转录、能量代谢以及细胞衰老过程的调节,尤其在糖和脂代谢中发挥重要作用[8]。目前,国内外关于非酒精性脂肪肝中Sirt1的表达也引起越来越多的重视[9-10]。本研究用高脂、高糖膳食复制大鼠非酒精性脂肪肝模型,并研究该模型动物中肝脏FAS和Sirt1的表达。
1 材料与方法
1.1实验动物
清洁级Wistar雄性大鼠20只,初始体重(170± 10)g,购于上海西普尔-必凯实验动物公司,分为正常组(基础饲料)和模型组(高脂、高糖饲料)。基础饲料由华中科技大学同济医学院实验动物学部提供;高糖、高脂饲料由60%基础饲料、17.5%猪油、8%蔗糖、10%鸡蛋黄粉、4%酪蛋白、0.5%牛胆盐配制而成。基础饲料供能比为:蛋白质26.48%、脂肪10.19%、碳水化合物63.33%,共12.96 kJ/g。高脂高糖饲料供能比为:脂肪54.22%,蛋白质18.33%,碳水化合物27.45%(19.65%淀粉,7.8%蔗糖),共17.09 kJ/g。喂养时间为13周,期间每天观察大鼠饮食、粪便,记录每天进食量及每周体重。实验结束后,每组取3只大鼠做肝脏病理检测和油红O染色,另外7只大鼠断头处死后分离血清行相关指标测定,肝脏取出后液氮速冻并置于-80℃冰箱冷冻保存待用于后续实验。
1.2试剂
总胆固醇(total cholesterol,TC)、TG试剂盒购自北京中生北控生物科技公司,SYBR green-based实时荧光定量聚合酶链反应试剂盒购自大连TaKaRa公司,Sirt1抗体和辣根过氧化物酶标记的二抗购自英国Abcam公司,FAS抗体购自美国Cell Signaling公司,β-actin抗体和油红O试剂购自美国Sigma公司。
1.3方法
1.3.1能量利用率计算由于基础饲料和高脂、高糖饲料的能量密度不同,故将食物摄入量换算为能量摄入量,再按公式算出能量利用率。能量利用率(%)=体重增量(g)/同期热能摄入量(kcal)×100。
1.3.2血清及肝脏TC、TG检测血清TC、TG的测定严格按照相关试剂盒说明书进行操作。将肝脏与异丙醇1∶9匀浆,4℃静置48 h,3 000 r/min离心15 min,取上清液进行肝脏TC、TG测定。
1.3.3肝组织苏木精-伊红染色(hematoxylin-eosin staining,HE)和油红O染色动物过夜禁食12 h后,4%多聚甲醛灌注固定,取固定好的肝脏组织进行常规HE染色。对于油红O染色,先配置油红O饱和液,即0.5 g油红O充分溶于100 ml异丙醇中,按饱和液与水3∶2的比例配制成染液。取肝脏组织行厚度为8μm的冷冻切片,染色20 min,苏木素复染核25 s,1%盐酸分化后用流水冲洗反蓝,甘油明胶封片后镜下拍照观察。
1.3.4实时逆转录聚合酶链反应(real-time reverse transcription-polymerasechainreaction,Real-time RT-PCR)实验使用Trizol提取肝脏总RNA,严格按照SYBR green-based qRT-PCR试剂盒说明书在ABI-7900HT机器上进行实验。管家基因GADPH作内参,结果用2-ΔΔCt方法计算。引物设计如下:GADPH正向引物:5'-GCAAGTTCAACGGCACAG-3',反向引物:5'-GCCAGTAGACTCCACGACAT-3';FAS正向引物:5'-GGACGGAGGTATCAA-3',反向引物:5'-CGGAACCACTCACAC-3';Sirt1正向引物:5'-TTC AGAACCACCAAAGCG-3',反向引物:5'-CAGCAAG GCGAGCATAAA-3'。Real Time PCR反应条件为:95℃预变性30 s,95℃变性5 s,共40个循环,60℃继续延伸30 s,增加一个熔解曲线。
1.3.5Western blot实验将肝脏组织切成小块用无线电免疫沉淀(radio-immunoprecipitation assay,RIPA)裂解液[1%Triton X-100,1%脱氧胆酸盐,0.1%十二烷基硫酸钠-聚丙烯酰胺(sodium dodecyl sulfate,SDS)]充分匀浆裂解提取总蛋白。上样前每个样本取等量蛋白与2×SDS样品缓冲液混合,100℃孵育5 min,行SDS聚丙烯酰胺凝胶电泳后电转移到聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上。0.1%Tween-20和5%脱脂奶粉的封闭液中孵育过夜。次日在室温下一抗孵育2 h,洗脱缓冲液洗涤3次后用辣根过氧化物酶标记的二抗孵育1 h,洗膜后加增强化学发光法(enhanced chemiluminescence,ECL)试剂在Western blot检测系统下检测条带,用Quantity One 4.62软件对条带进行分析,以目的条带和β-actin条带灰度值的比值作为检测结果。
1.4统计学方法
采用SPSS 18.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,用t检验,P<0.05为差异有统计学意义。
2 结果
2.1一般情况、体重及能量利用率比较
喂养中、后期正常组大鼠灵活好动,皮毛光泽整洁,体重持续小幅增长;模型组大鼠行动迟缓,毛发杂乱,体重持续快速增长。喂养结束时,两组大鼠体重比较差异有统计学意义。根据实验期间动物体重增量及同期热能摄入量算出能量利用率,结果表明,模型组大鼠能量利用率显著高于正常组(P=0.000)。见图1、2。
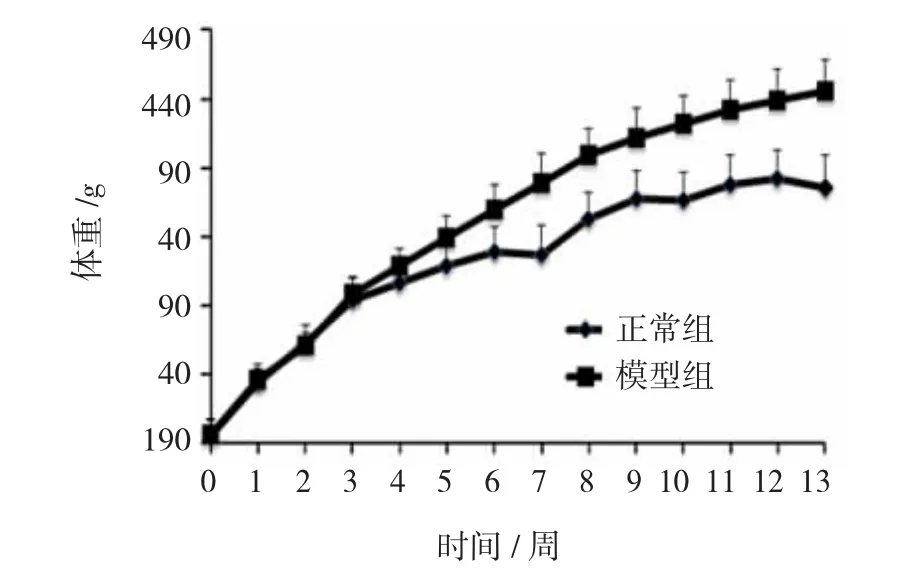
图1 两组大鼠体重变化

图2 两组大鼠的能量利用率
2.2血清和肝脏TC、TG含量
模型组大鼠血清及肝脏TC、TG水平显著高于正常组(P<0.05)。见附表。
附表两组大鼠血清及肝脏TC、TG水平比较(n=7±s)

附表两组大鼠血清及肝脏TC、TG水平比较(n=7±s)
组别血清肝脏TC/(mmol/L)TC/(μmol/g)TG/(μmol/g)正常组1.14±0.310.97±0.259.09±2.0112.18±4.97模型组1.57±0.311.39±0.3315.66±2.5525.07±5.31 t值-2.81-3.03-5.35-4.69 P值0.0160.0110.0000.001 TG/(mmol/L)
2.3两组大鼠肝脏HE和油红O染色
HE染色光镜下显示,正常组大鼠肝细胞排列紧密,细胞核位于细胞中央,核大而圆;模型组大鼠肝细胞排列疏松,肝细胞中出现很多大的脂滴(见图3A)。肝脏做冷冻切片后进行油红O染色,结果显示,正常组大鼠肝脏未见中性脂肪沉积,模型组肝脏中可见较多较大的脂滴聚集(见图3B)。

图3 两组大鼠肝脏HE和油红O染色(×400)
2.4 肝脏的FAS、Sirt1 mRNA及蛋白的表达
Real-time RT-PCR和Western blot结果显示,模型组大鼠肝脏中FAS mRNA和蛋白水平显著低于正常组(P=0.015和0.008);模型组大鼠肝脏Sirt1 mRNA水平与正常组比较,差异无统计学意义(P= 0.599),但蛋白水平明显低于正常组(P=0.012)。见图4、5。

图4 两组大鼠肝脏中FAS和Sirt1 mRNA水平

图5 两组大鼠肝脏中FAS和Sirt1的蛋白表达
3 讨论
脂肪肝(fatty liver disease,FLD)是世界范围内最常见的一种肝病,分为酒精性脂肪肝与非酒精性脂肪肝。后者的病因可分为营养性(肥胖)、代谢性(低脂蛋白血症)、内分泌性(糖尿病、高脂血症)等。随着人们生活水平的提高和饮食结构的改变,肥胖、高脂血症和糖尿病已成为非酒精性脂肪肝的最主要病因。
目前认为NAFLD的发病与胰岛素抵抗、脂质代谢异常、氧化应激及脂质过氧化等因素有关,其中脂质代谢异常被认为是NAFLD发病机制中最关键,也是最基础的环节之一,但具体机制尚未阐明。脂肪肝如果长期得不到有效治疗就可能发展成脂肪性肝炎,甚至是肝硬化、肝癌,但是目前脂肪肝治疗尚无特效药,所以脂肪肝重在预防。因此,对非酒精性脂肪肝形成机制进行研究,从而发现有效的预防措施非常重要。
本研究结果显示,模型组大鼠的体重、能量利用率及血清脂质含量高于正常组,肝脏TC、TG的沉积也显著高于正常水平。从肝脏HE和油红O染色可以观察到模型组大鼠肝脏严重脂肪变性,而正常组大鼠肝细胞形态正常,未见脂质沉积,说明高脂、高糖饮食造成大鼠肝脏脂质代谢异常。
脂肪酸合成酶是体内合成脂肪途径中一个关键酶,其表达上升是对内源性脂肪酸合成和细胞增殖的适应。FAS表达活性增高的意义在于满足细胞对能量需求和增殖条件下形成细胞膜脂质的需要[11-12]。作为成脂基因的FAS,随着脂类物质摄入的增多,FAS的表达往往显著升高。国内外很多研究表明,非酒精性脂肪肝大鼠的肝脏FAS在其他调控基因的作用下表达上调[4-5],从而参与高脂饮食大鼠非酒精性脂肪肝形成。本研究在实验设计时也将模型组FAS表达上升作为预期结果之一,但最后却得出相反的结论,与王玉明[6]和曹瑞等[7]的结果类似。其研究发现高脂摄入显著降低大鼠肝脏FAS mRNA及蛋白表达水平,认为肝脏脂质的蓄积并非由提高脂肪酸和TG合成相关酶活性引起,可能与脂肪酸β氧化活性降低有关。本研究认为,模型组大鼠肝脏FAS表达降低是机体对高脂、高糖饮食的适应性调节,提示肝脏脂质沉积可能不是通过FAS表达增多引起的,但尚需更深入的研究和更多的理论支持。
Sir基因家族(Sirt1-Sirt4)在酵母中首次被发现,Sirt1是烟酰胺腺嘌呤二核苷酸依赖的去乙酰化酶,可促进脂肪动员,降低脂肪沉积,还有延缓衰老、抑制增殖、增加胰岛素分泌等作用。SUN等[13]用棕榈酸处理肝脏细胞使其产生胰岛素抵抗后,Sirt1的表达随之降低,而通过基因转染使其高表达Sirt1后可改善细胞的胰岛素抵抗状态。庞婧等[14]用油酸干预肝细胞生长后发现,油酸可导致三酰甘油在肝脏中的蓄积和影响肝细胞的胰岛素敏感性,而这些改变很可能是通过下调Sirt1来实现。袁媛等[15]研究发现,高脂组小鼠脂代谢异常且肝脏Sirt1蛋白表达水平下降,而Sirt1激活剂白藜芦醇可改善肝脏的脂代谢功能,其机制可能与促进肝脏Sirt1表达有关。白藜芦醇是一种Sirt1有效激活剂,可以用过刺激Sirt1的表达及影响其活性而发挥对机体的保护作用[16]。也有研究表明,白藜芦醇能抑制非酒精性脂肪肝的形成[17]。本实验证实NAFLD大鼠肝脏Sirt1蛋白低表达,提示抑制Sirt1表达可能使其不能发挥促进脂肪消耗及改善胰岛素抵抗的作用,从而导致非酒精性脂肪肝的形成。但本研究仅仅探讨非酒精性脂肪肝形成中Sirt1表达的变化,为以后进一步的研究奠定基础。
综上所述,非酒精性脂肪肝形成的机制极其复杂。高脂、高糖饮食旨在模拟现代人的不良饮食习惯,用其喂养能使大鼠形成非酒精性脂肪肝。Sirt1表达下降可能参与非酒精性脂肪肝的形成;而FAS表达的明显降低与很多研究结果截然相反,这需要更深层次的研究。
[1]FARRELL GC,CHITTURI S,LAU GK,et al.Guidelines for the assessment and management of non-alcoholic fatty liver disease in the asia-pacific region:executive summary[J].J Gastroenterol Hepatol,2007,22(6):775-777.
[2]MUSSO G,GAMBINO R,CASSADER M.Recent insights into hepaticlipidmetabolisminnon-alcoholicfattyliverdisease (NAFLD)[J].Prog Lipid Res,2009,48(1):1-26.
[3]王素琴,黄缘.非酒精性脂肪肝病的研究进展[J].世界华人消化杂志,2014,22(23):3410-3415.
[4]张谷,陈芝云,严茂祥,等.大鼠非酒精性脂肪性肝病进展中肝脏脂代谢关键调控基因表达的变化[J].医学研究杂志,2013,42(5): 157-160.
[5]冷亮,蒋卓勤,纪桂元.大豆异黄酮对非酒精性脂肪肝大鼠肝脏脂代谢的影响[J].中华预防医学杂志,2011,45(4):335-339.
[6]王玉明,王静凤,薛长湖.胆固醇影响大鼠脂肪代谢的机制研究[J].营养学报,2007,29(6):530-534.
[7]曹瑞,季爱玲,张文斌,等.共轭亚油酸对肥胖大鼠肝脏脂质代谢酶及PPARγ基因表达的影响[J].军事医学科学院院刊,2007,31(1): 42-49.
[8]王军力,肖国强,曹姣,等.SIRT1与糖脂代谢及其运动关系研究进展[J].中国运动医学杂志,2012,31(4):356-362.
[9]COLAK Y,YESIL A,MUTLU HH,et al.A potential treatment of?non-alcoholic fatty liver disease with SIRT1 activators[J].J Gastrointestin Liver Dis,2014,23(3):311-319.
[10]王晓珂,赵健亚,刘天娥,等.白藜芦醇对大鼠非酒精性脂肪肝的作用及机制研究[J].毒理学杂志,2013,27(6):450-453.
[11]MORIWAKI S,MURAKAMI H,TAKAHASHI N.Yamogenin in fenugreek inhibits lipid accumulation through the suppression of gene expression in fatty acid synthesis in hepatocytes[J].Biosci Biotechnol Biochem,2014,78(7):1231-1236.
[12]罗建学,李春风,初晓辉,等.脂肪酸合成酶基因的研究进展[J].中国畜牧兽医,2011,38(6):118-123.
[13]SUN C,ZHANG F,GE X,et al.SIRT1 improves insulin sensitivity under insulin-resistant conditions by repressing PTP1B[J]. Cell Metab,2007,6(4):307-319.
[14]庞婧,代杨,张铁梅.不同类型高脂状态对肝细胞内SIRT1表达的调节[J].现代生物医学进展,2013,13(17):3205-3208.
[15]袁媛,詹志鹏,崔玉丰,等.白藜芦醇对小鼠脂代谢及相关蛋白表达影响[J].中国公共卫生,2014,30(4):443-445.
[16]PICARD F,KURTEV M,CHUNG N,et al.Sirt1 promotes fat mobilization in white adipocytes by repressing PPAR-gamma[J]. Nature,2004,429(6993):771-776.
[17]XIN P,HAN H,GAO D,et al.Alleviative effects of resveratrol on nonalcoholic fatty liver disease are associated with up regulation of hepatic low density lipoprotein receptor and scavenger receptor class B typeⅠgene expressions in rats[J].Food and Chemical Toxicology,2013,52(1):12-18.
(申海菊 编辑)
Expression of silent information regulator 2/SIRTuin1 and fatty acid synthase in liver of rats with nonalcoholic fatty liver disease and its significance*
Yan-ru SHI1,Yan CHANG1,Peng XIN2,Qi XIANG1,Mei-rong ZHANG1
(1.Department of Nutriology,Nankai Hospital,Tianjin 300100,P.R.China;2.Tianjin Center for Disease Control and Prevention,Tianjin 300171,P.R.China)
【Objective】To investigate the alteration of silent information regulator 2/sirtuin1(SIRT1)and fatty acid synthase(FAS)in liver of rats under high fat/sucrose diet(HFS)so as to reveal the possible pathogenesis of nonalcoholic fatty liver disease(NAFLD).【Methods】Male Wistar rats were divided into control group and model group.The rats in the control group were fed with standard diet and the rats in the model group were fed with HFS.After 13 weeks,the livers were stained with HE and oil red O,the content of total cholesterol(TC)and triglycerides(TG)was detected in the serum and liver homogenate,the alteration of SIRT1 and FAS in the liver was determined by RT-PCR and Western blot.【Results】Compared with the control group,the body weight,energy efficiency and serum and liver TC and TG levels were significantly increased in the model group.Unlike the control group,the fatty degeneration of hepatocytes was obvious in the model group by HE and oil red O staining.Compared to the control group,the hepatic SIRT1 protein expression significantly decreased in the model group,but the level of SIRT1 mRNA had no significant difference. Unexpectedly,the hepatic FAS mRNA and protein expressions in the model group were markedly decreased compared with those in the control group.【Conclusions】HFS can induce NAFLD and increase the lipidconcentrations in serum and liver of rat.These data indicate that HFS may induce NAFLD through downregulation of SIRT1 expression,whereas the low expression of FAS is completely different from some previous studies which requires further research.
nonalcoholic fatty liver disease;silent information regulator 2/sirtuin1;fatty acid synthase
R151.3;R575.5
A
1005-8982(2015)32-0009-05
2015-04-13
中央高校基本科研业务费专项资金(No:2011TS054)
张美荣,E-mail:1913293506@qq.com;Tel:022-27435067

