珍稀药用植物竹节参SRAP-PCR反应体系的构建与优化
宋 佳,张绍鹏,孙 巧,李天佩,曾万勇,陈 平
(武汉轻工大学 生物与制药工程学院,湖北 武汉 430023 )
珍稀药用植物竹节参SRAP-PCR反应体系的构建与优化
宋佳,张绍鹏,孙巧,李天佩,曾万勇,陈平
(武汉轻工大学 生物与制药工程学院,湖北 武汉 430023 )
摘要:人参属重要的药用植物竹节参(Panax japonicus C. A. Mey)野生资源已近濒危,开展其遗传多样性研究对于资源保护和可持续利用具有重要意义。研究构建并优化了竹节参DNA的SRAP-PCR扩增体系。以竹节参根茎为材料,对PCR反应体系中的dNTPs、DNA模板、引物、Taq DNA聚合酶浓度和复性第二阶段的退火温度等条件进行探索和研究,得到了能稳定扩增竹节参基因组的最佳反应体系(25μl):DNA 40ng,dNTPs 0.2 mmol/L,Primer 0.36μmol/L,10×PCR Buffer 2.5 ul,Taq DNA polymerase 2U,退火温度50℃。进一步检测了随机组合的24对引物,进行扩增,得到了2对带型清楚、重复性较好的引物Me1/Em5和Me3/Em1。以这2对引物对10个不同产地竹节参DNA样品进行SRAP-PCR扩增。产物的电泳图谱表明,竹节参不同产地的DNA谱带多态性丰富,带型清晰,重复性好。说明建立的该SRAP-PCR反应体系稳定可靠,为利用SRAP分子标记技术研究竹节参的植物遗传多样性奠定了工作基础。
关键词:竹节参;SRAP-PCR反应体系;构建;优化
1引言
近年来,AFLP、RAPD、ISSR等分子标记技术逐渐应用到药用植物的研究领域,已成为目前中药资源系统研究的重要手段和方法,在人参属植物如三七[1]、人参[2-3]、西洋参[4- 5]的遗传多样性研究方面目前已经取得了重要的研究进展。由Li和Quiros[6]开发的一种新型分子标记技术——标记序列相关扩增多态性(sequence-related amplified polymorphism, SRAP) 因其具有简单、高效、多态性丰富、重复性好、高共显性、易测序且不需预知物种基因序列信息等优点,已逐步被国内外学者应用于苹果[7]、马铃薯[8]、油菜[9]等果蔬的遗传多样性分析、遗传图谱构建[10]、种质资源鉴定评价[11],重要性状基因标记[12]等研究。该标记根据基因启动子、内含子中AT含量丰富及外显子中GC含量丰富的特点设计引物,对基因开放读码框(ORFs)进行PCR扩增, 因不同个体间启动子、内含子与间隔区的长度不同而产生多态性,被认为是研究群体遗传变异最好的标记之一[13],目前SRAP标记在竹节参的研究中尚未见有相关报道。构建竹节参基因组DNA的SRAP-PCR的优化反应体系,为竹节参遗传图谱的构建、遗传多样性分析研究奠定基础。
竹节参(PanaxjaponicasC.A.Mey)为五加科人参属多年生草本植物,以干燥根茎入药[14]。其又称竹节人参、竹根七、竹节三七、白三七、大叶三七、北三七,主产于湖北、四川、云南、贵州等地,有止血生肌、散瘀止痛、舒筋活络、滋补强壮等功效[15]。它兼具我国北药人参和南药三七的功用,被民间誉为“草药之王”,为我国珍稀中药材资源[16]。野生竹节参资源目前已处于濒危状态,经过多年的研究,在竹节参的植物分类[17]、化学成分研究[18-20]、临床应用研究等方面取得了一定的进展[21-23]。在其药用植物的生长发育、遗传多样性评估、品种鉴定及植物系统分类等方面的研究目前尚处于起步阶段,本课题组在前期竹节参转录组测序研究的基础上,利用单因素分析法[24]首次构建并优化了竹节参SRAP-PCR反应体系。以竹节参(PanaxjaponicusC. A. Mey)为材料,对PCR反应体系中的dNTPs、DNA模板、引物、Taq DNA聚合酶浓度和复性第二阶段的退火温度等条件进行梯度实验,构建并优化了竹节参SRAP-PCR反应体系,为进一步开展竹节参的遗传多样性、种质资源研究和遗传连锁图构建等系统研究提供技术基础。
2材料与方法
2.1 材料
供试材料为竹节参(PanaxjaponicasC.A.Mey)的根茎,不同产地竹节参的材料见表1。
表1竹节参样品
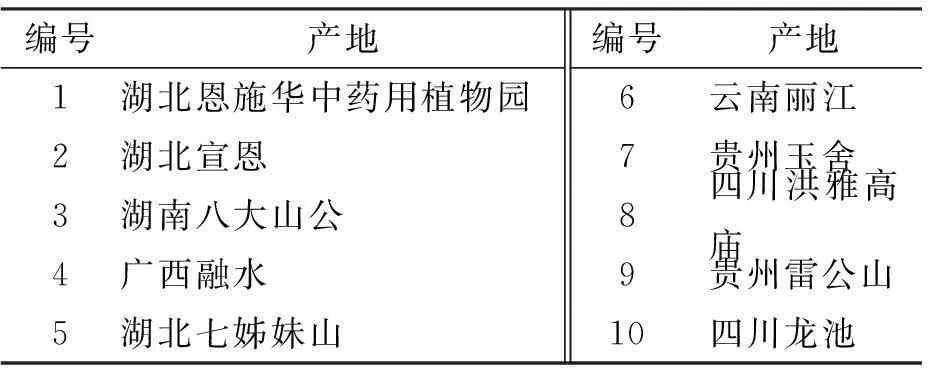
编号产地编号产地1湖北恩施华中药用植物园6云南丽江2湖北宣恩7贵州玉舍3湖南八大山公8四川洪雅高庙4广西融水9贵州雷公山5湖北七姊妹山10四川龙池
2.2 主要试剂
Taq DNA聚合酶、dNTP Mixture、10×PCR Buffer、DL10000 DNA Marker(武汉生物工程技术服务有限公司),SRAP标记引物来自Li和Quiros[6](所选引物序列见表2,由上海桑尼生物科技有限公司合成,稀释10umol/L备用),琼脂糖(Biosharp),CTAB(Amresco),无水乙醇、氯仿(国药集团化学试剂有限公司)等。
表2SRAP引物序列

引物正向引物序列(5’-3’)引物反向引物序列(5’-3’)Me1TGAGTCCAAACCGGATAEm1GACTGCGTACGAATTAATMe2TGAGTCCAAACCGGAGCEm2GACTGCGTACGAATTTGCMe3TGAGTCCAAACCGGATTEm3GACTGCGTACGAATTGACMe4TGAGTCCAAACCGGAGCEm4GACTGCGTACGAATTAATMe5TGAGTCCAAACCGGTCCEm5GACTGCGTACGAATTCAAMe6TGAGTCCAAACCGGACCEm6GACTGCGTACGAATTGCAMe7TGAGTCCAAACCGGAAGEm7GACTGCGTACGAATTCTGMe8TGAGTCCAAACCGGTAAEm8GACTGCGTACGAATTCGAMe9TGAGTCCAAACCGGTGCEm9GACTGCGTACGAATTCAGMe10TGAGTCCAAACCGGTCAEm10GACTGCGTACGAATTCCA
2.3 竹节参基因组 DNA的提取与检测
切取一小块(0.2 g)竹节参样品的最嫩部位,采用改良的CTAB法[25]提取各样品基因组DNA。用液氮将样品研磨至粉末,放入到加有CTAB提取缓冲液(100 mmol/L Tris-HCl pH 8.0, 1.4 mol/L NaCl, 20 mmol/L EDTA pH 8.0, 2% CTAB, 1%PVP K-40, 1%β-巯基乙醇)中,65℃水浴1h,每10min轻轻摇晃一次,加入氯仿400ul,混匀后静置2-3min,15℃,12 000r/min离心10min,轻轻吸取上清液400ul,加入等体积的异戊醇:氯仿(1:24),4℃, 12 000r/min离心10min,轻轻吸取上清液450ul,加入2.5倍体积的无水乙醇,4℃, 12 000r/min离心20min,弃上清,得到DNA沉淀物。经室温干燥后,加入30ul ddH2O充分溶解。利用紫外分光光度计(PE Lambda25)和1%的琼脂糖凝胶检测其浓度和质量。
2.4 SRAP-PCR反应体系优化
基础扩增反应体系(25 μl):模板l μl (50 ng/μl),10×Buffer 2.5 μl,dNTP Mixture (10 mmol/L) 0.3 μl,正反引物各5 μl (1.5 μmol/L), Taq酶0.4 μl (5 U/μl),剩余用ddH2O 补足。采用单因素分析法,设定dNTPs、DNA模板、引物、Taq DNA聚合酶浓度和复性第二阶段的退火温度5个参数。在反应体系中其他成分不变的情况下,将每个参数设置5个梯度(表3)。
2.5 SRAP-PCR扩增体系
SRAP-PCR反应采用复性变温法,扩增反应程序如下:预变性94 ℃5 min;前5个循环变性94 ℃1 min,退火35 ℃ 1 min,延伸72℃ 1.5 min;后35个循环变性94℃ 1 min,退火50 ℃[6],1 min,延伸72 ℃ 1.5 min;最后延伸72 ℃ 5 min。
2.6 SRAP-PCR引物的筛选
以1号竹节参DNA为模板,进行SRAP-PCR反应引物的筛选。正反引物各10个,随机组合挑选24对,进行PCR扩增,产物用1%琼脂糖凝胶电泳检测(表3)。
表3竹节参SRAP-PCR反应体系参数
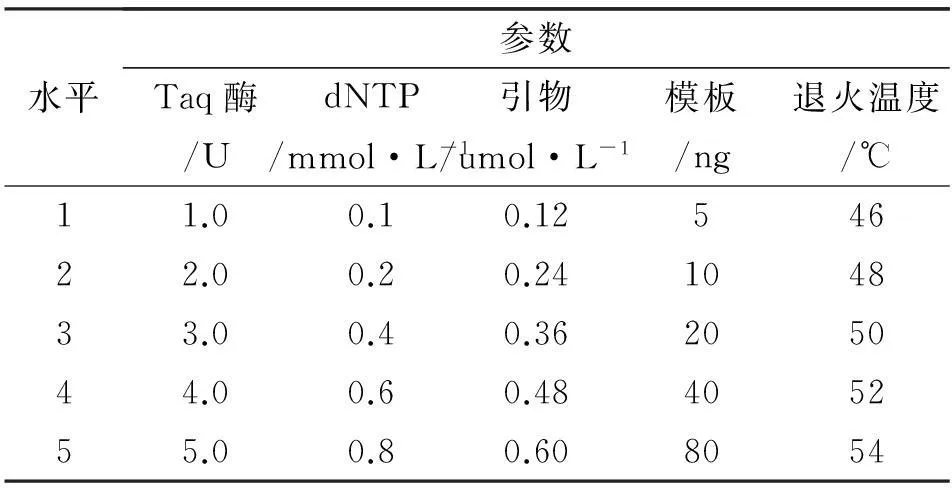
水平参数Taq酶/UdNTP/mmol·L-1引物/umol·L-1模板/ng退火温度/℃11.00.10.1254622.00.20.24104833.00.40.36205044.00.60.48405255.00.80.608054
3结果与分析
3.1 引物筛选结果
将正向引物和反向引物随机组合成引物对,采用SRAP-PCR初始反应程序进行引物筛选,扩增结果见图1。实验结果表明4号(Me1/Em3),7号(Me1/Em5),12号(Me3/Em1),13号(Me8/Em1),20号(Me7/Em8),23号(Me7/Em10)这6对引物能扩增出清楚、重复性较好的带型。经过多次重复试验后,最终确定选用Me1/Em5作为固定引物进行各因素优化实验。

图1 24对引物SRAP-PCR扩增结果
3.2 SRAP-PCR优化结果
3.2.1dNTPs浓度对SRAP-PCR扩增的影响
dNTPs是合成DNA链的原料,其浓度是影响PCR反应的决定性因素之一。图2中结果表明,当dNTPs浓度为0.1—0.8 mmol/L时,都能扩增出条带,但浓度为0.8 mmol/L时,扩增产物的谱带较弱;浓度为在0.6 mmol/L时,扩增产物谱带不太稳定。故dNTPs浓度在0.1—0.4 mmol/L时效果最好。
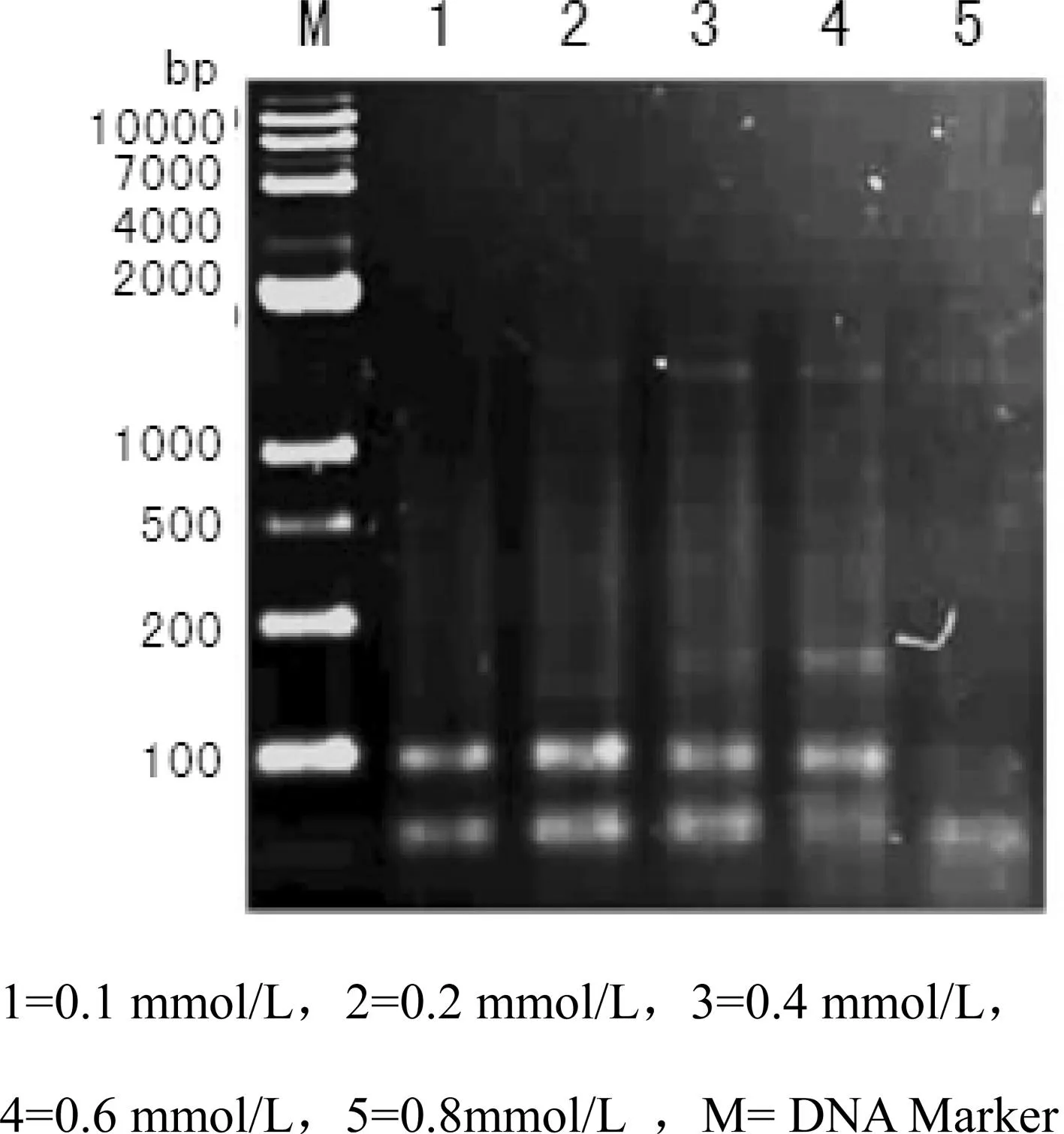
图2 不同dNTPs浓度SRAP-PCR扩增结果
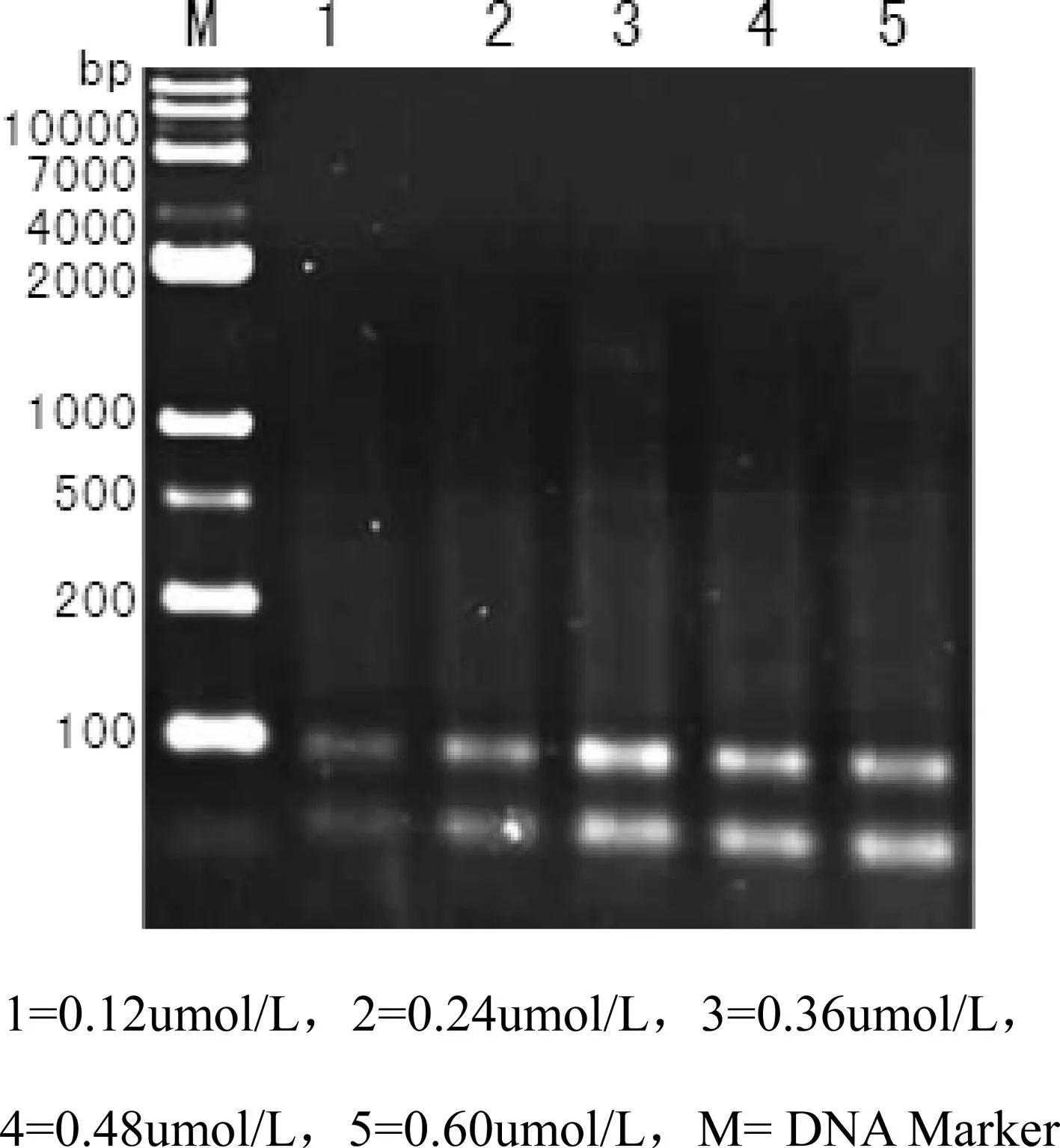
图3 不同引物浓度SRAP-PCR扩增结果
3.2.2引物浓度对SRAP-PCR扩增的影响
引物浓度过高会导致非特异性扩增和引物二聚体的形成,过低则PCR产量受到影响。由图3可知,当引物浓度为0.12 umol/L时,扩增产物电泳条带不清晰;随着引物浓度的增加,扩增条带逐渐清晰,在0.24—0.60 umol/L时,谱带清晰且稳定,确定竹节参SRAP扩增最优引物浓度为0.36umol/L。
3.2.3DNA模板量对SRAP-PCR扩增的影响
高质量的模板也是PCR扩增的关键因素。由图4可知,当模板DNA用量为5或10 ng时,扩增的谱带较暗;而为20或40 ng时,扩增的谱带主带最清晰;当模板DNA用量为20—80 ng时,条带稳定且亮度基本保持不变,说明SRAP对竹节参模板DNA浓度适应范围比较广,本试验确定竹节参SRAP扩增模板DNA浓度为40 ng。

图4 不同DNA模板浓度SRAP-PCR扩增结果
3.2.4Taq酶对SRAP-PCR扩增的影响
Taq酶的用量对PCR扩增效率有着显著影响。若浓度过低,扩增产物量降低;浓度过高,非特异性扩增几率增大。由图5可知,Taq DNA聚合酶为1.0 U时,扩增的条带较少;用量为3.0—5.0 U时,条带清楚但易产生非特异性条带;综合考虑,本试验确定竹节参SRAP扩增的Taq DNA聚合酶适宜用量为2.0 U。
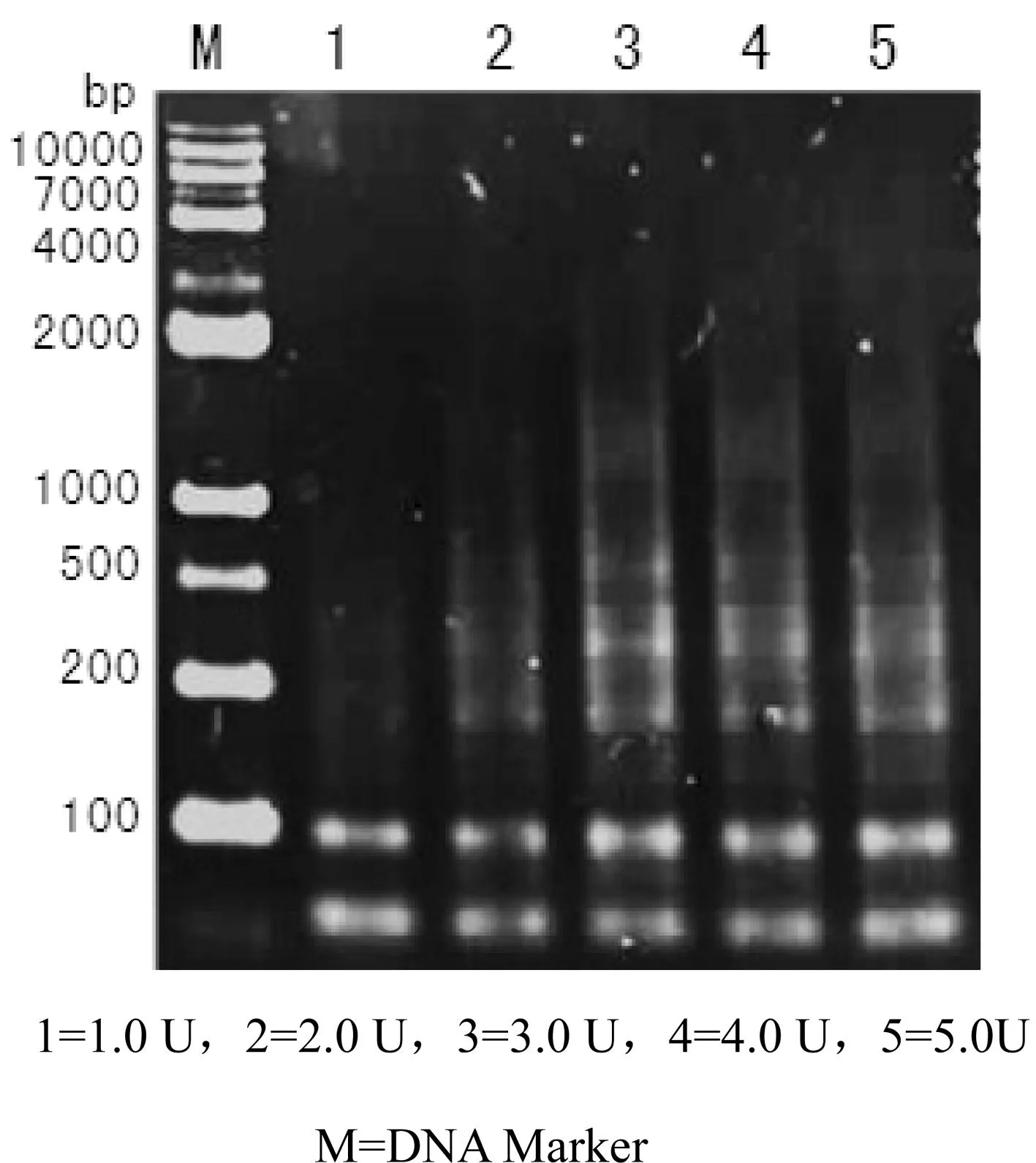
图5 不同Taq酶浓度SRAP-PCR扩增结果
3.2.5退火温度对SRAP-PCR扩增的影响
退火温度对PCR扩增结果有着至关重要的影响。退火温度过低,会导致反应结果中出现大量非特异性结合条带;退火温度过高,虽然特异性会好一些,但是扩增效率会降低,所以对退火温度的筛选是很有必要的。如图6所示,本实验确定当退火温度为50℃时较为适宜,产物有较清晰条带。

图6 不同退火温度SRAP-PCR扩增结果
3.3 竹节参SRAP-PCR反应体系的确立和稳定性检测
考虑到试验结果的稳定性和降低试验成本等因素,我们最终确定竹节参SRAP标记最优扩增反应体系(25 μl):DNA模板1 μl (40 ng/μl),10×Buffer 2.5 μl,dNTP Mixture 0.4 μl (10 mmol/L),引物6 μl (1.5 μmol/L),Taq酶0.4 μl (5 U/μl),退火温度50℃,剩余用ddH2O补足。
利用上述最优扩增反应体系,选取引物组合Me1/Em5和Me3/EmL对10个不同产地竹节参样品进行扩增,以检测该SRAP-PCR反应体系的稳定性。结果显示,所选引物可在10个不同产地竹节参样品上扩增出清晰稳定、重复性好的条带(图7和图8)。
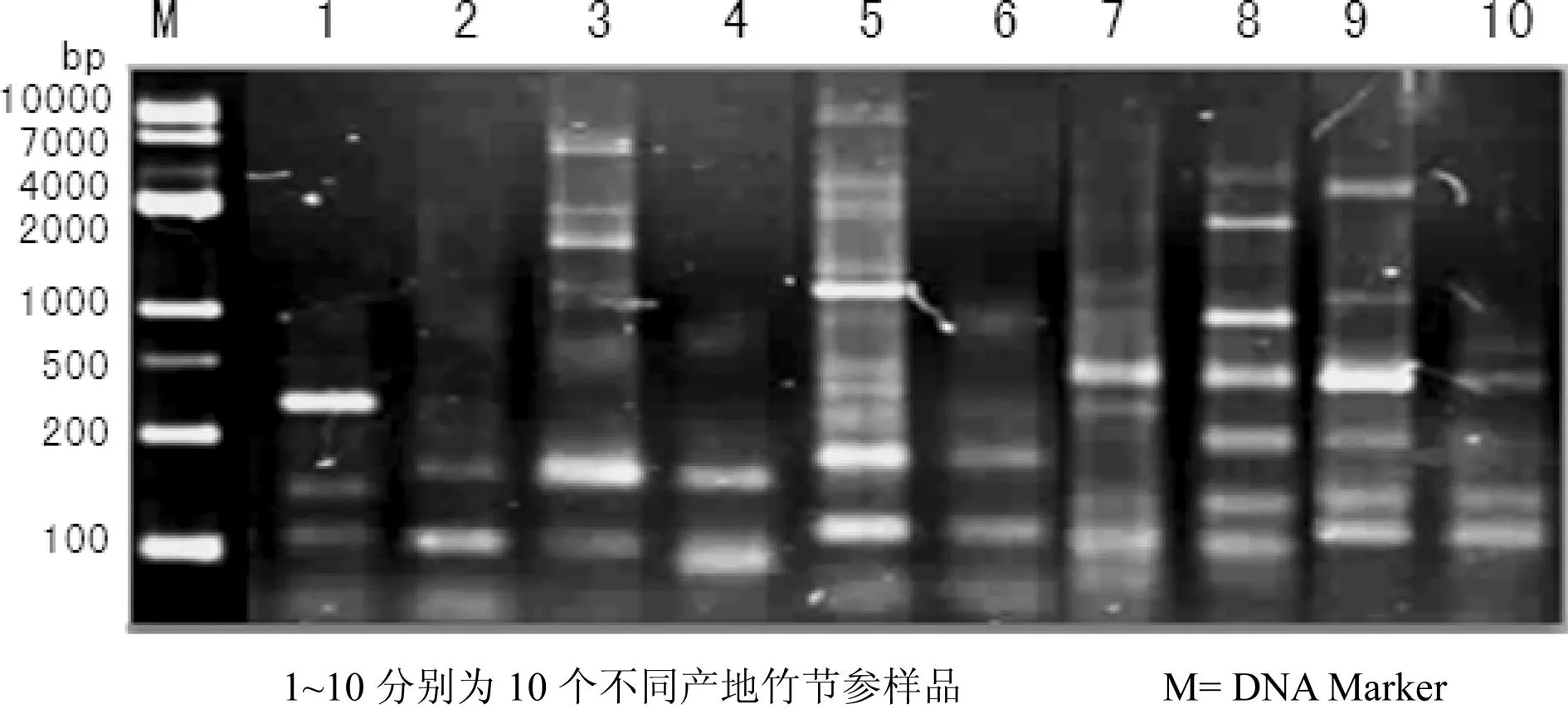
图7 引物Me1/Em5对10个不同产地竹节参样品SRAP-PCR扩增结果
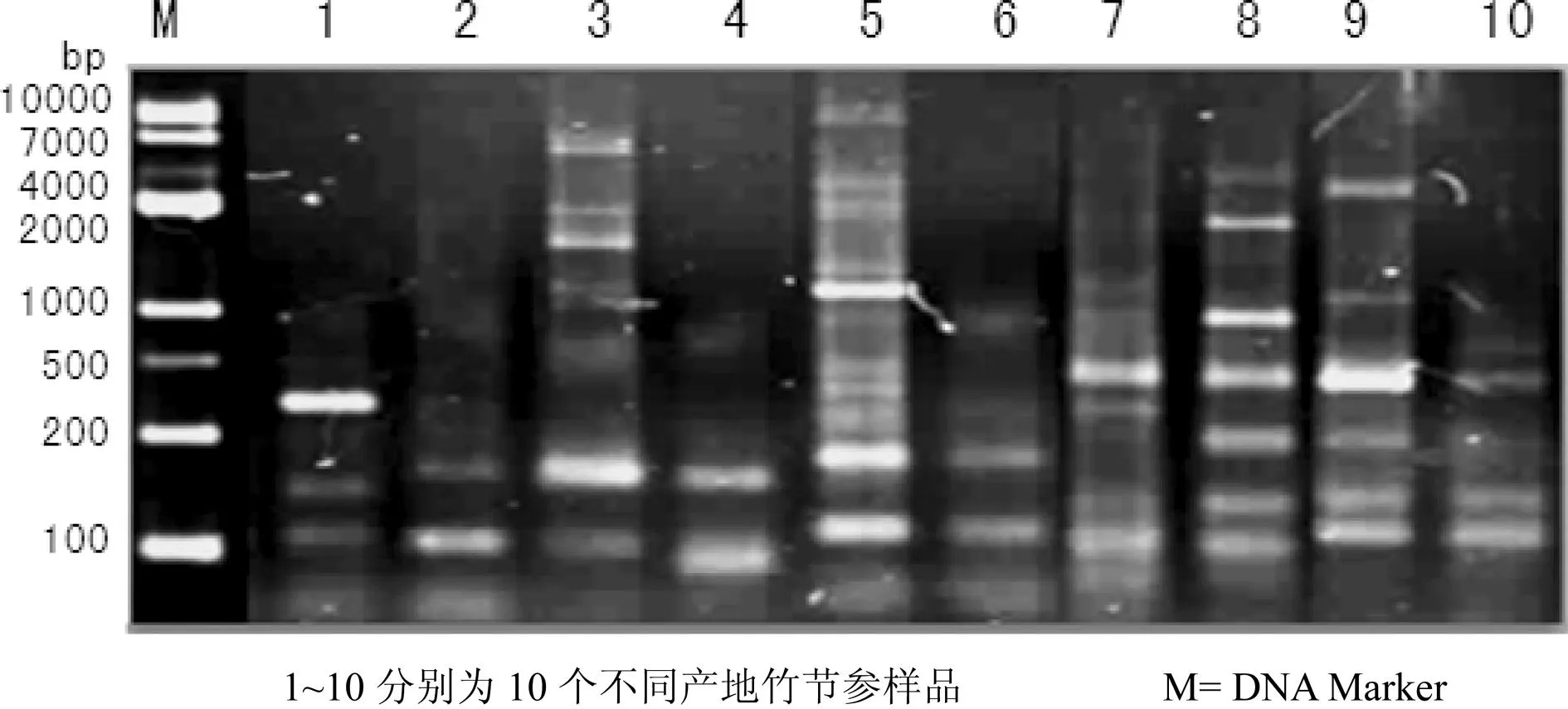
图8 引物Me3/Em1对10个不同产地竹节参样品SRAP-PCR扩增结果
4讨论
SRAP分子标记是在总结现有分子标记优缺点基础上开发出的一种新型的DNA分子标记技术,其扩增条带比RAPD、ISSR 分子标记更稳定,适用于不同植物的各种研究,目前已在数十种植物中应用,但在药用植物的生长发育、遗传多样性评估、品种鉴定及植物系统分类等方面的研究尚处于起步阶段,本研究首次构建并优化了竹节参的SRAP-PCR反应体系。但是受反应条件及物种差异的影响,不同物种间SRAP最佳反应体系差别很大。因此,应用SRAP标记之前,应该对反应条件进行优化,从而保证反应体系的重复性和稳定性。
目前国内外尚未见有关竹节参SRAP-PCR反应体系构建的相关研究。在竹节参植物遗传多样性的研究方面,我们构建了针对竹节参基因组DNA的SRAP-PCR反应体系,对dNTPs、DNA模板、引物、Taq DNA聚合酶浓度和复性第二阶段的退火温度等条件进行探索和研究。结果发现,这5个参数对SRAP-PCR扩增结果有不同程度的影响,其中模板浓度对扩增结果影响较小,这与对枸杞[26]、香蕉[27]、马铃薯[8]的研究结果相一致;相比较而言,dNTPs、引物、Taq DNA聚合酶浓度和复性温度对扩增结果影响比较大,这与辣椒[28]在这方面研究结果相一致。所构建优化并最终确定了竹节参SRAP-PCR扩增的最佳反应体系(25μl):DNA 40ng,dNTPs 0.2 mmol/L,Primer 0.36μmol/L,10×PCR Buffer 2.5 ul,Taq DNA polymerase 2U,退火温度50 ℃,这为SRAP分子标记在竹节参遗传多样性的研究中提供了一定的技术支持。
参考文献:
[1]田斌,辛培尧. 三七ISSR-PCR反应体系建立及优化[J]. 云南农业大学学报,2013,28(1):96-101.
[2]Yuri N Zhuravlev,Galina D Reunova. Genetic variability and population structure of endangered Panax ginseng in the Russian Primorye[J].Chinese Medicine,2010,5(21):2-9.
[3]李靖,程舟,杨晓伶,等.人参农家类型遗传多样性的ISSR分析[J].中草药,2007,38(9):1392-1395.
[4]杨天天. 栽培人参和西洋参种质资源遗传多样性研究[D]. 沈阳:东北林业大学,2007.
[5]罗志勇,周钢,周肆清,等.AFLP法构建人参、西洋参基因组DNA指纹图谱[J].药学学报,2000,35(8):626-629.
[6]Li G,Quirou C F.Sequence-related amplified polymorphism(SRAP),a new marker system based on a simple PCR reaction:its application to mapping and gene tagging in Brassica[J].Theor Appl Genet,2001,103:455-461.
[7]司鹏,戴洪义.苹果SRAP-PCR反应体系的建立[J].果树学报,2010,27(2):168-173
[8]李双双,赵瑞华.马铃薯基因组SRAP反应体系的建立和优化[J].山西师范大学学报自然科学版,2007,21(4): 79-82
[9]陈丽,杜才富,秦信蓉,等.39份油菜品种的SRAP遗传多样性分析[J].贵州农业科学,2012(12):1-4.
[10]潘俊杰,王刚.黄瓜SRAP遗传连锁图的构建及始花节位的基因定位[J].自然科学进展,2005,15(2):167-172
[11]Ferrjo M,Pico B,Nuez F. Genetic diversity of a germplasm collection of Cucubita pepo using SRAP and AFLP markers [J]. Theor Appl Genet,2003,107(2):271-282.
[12]雷剑,刘俊. 一个与马铃薯青枯病抗性连锁的SRAP标记筛选[J]. 中国马铃薯,2006,20(3):150-153.
[13]潘俊杰,王刚.黄瓜SRAP遗传连锁图的构建及始花节位的基因定位[J].自然科学进展,2005,15(2):167-172.
[14]国家药典委员会,中国药典,一部[S].北京,中国医药科技出版社,2010.
[15]贾放,王如峰.竹节参药材不同部位皂苷成分的分析研究[J].时珍国医国药,2012,23(7):1682-1684.
[16]林先明,由金文,等.珍贵中药材竹节参生物多样性研究[J].中药研究与信息,2005,7(12):30-32.
[17]林先明,谢玲玲,由金文等.竹节参名称及基原考[J].中药材,2007,3(6):742-743.
[18]Zhang C C, Yuan D.Research on Chemical Constituents and Biological Activities of Rhizome of Panax japonicus [Z]. Medicinal plant chemistry and tradional Chinese medicine resources sustainable development seminar.
[19]Kouichi Y, Shoji Y. New Triterpenoid Saponins from Fruits Specimens of Panax japonicas Collected in Kumamoto and Miyazaki Prefectures(1) [J].Chem.Pharm.Bull.2012, 60(3):354-362.
[20]Kouichi Yi, Shoji Y. New Triterpenoid Saponins from Leaves of Panax japonicas(3) . Saponins of the Specimens Collected in Miyazaki Prefecture[J]. Natural Product Communications, 2012,7(4):491-493.
[21]Rufeng Wang, Ping Chen, Fang Jia,et al. Optimization of polysaccharides from Panax japonicas C.A. Meyer by RSM and its anti-oxidant activity[J]. International Journal of Biological Macromolecules. 2012,50,331-336.
[22]Rufeng Wang, Ping Chen, Fang Jia.et al. Characterization and antioxidant activities of polysaccharides from Panax japonicas C.A. Meyer [J]. Carbohydrate Polymers. 2012, Dol:10,1016.
[23]Xiaolin Yang, Rufeng Wang, Shapeng Zhang.et al. Polysaccharides from Panax japonicas C.A. Meyer and their antioxidant activities. Carbohydrate Polymers[J]. 2014,01(101):386-391.
[24]李晓慧,王从彦.西瓜SRAP-PCR 程序和体系优化[J].安徽农业科学. 2007,35(27):8461-8463.
[25]Saghai-Maroof M A, Biyashev R M, Yang G P,et al. Allard RW (1984) Extraordarily polymorphic microsatellite DNA in barly:species diversity, chromosomal locations, and population dynamics[J]. Proc Natl Acad Sci 91:5466-5470.
[26]尹跃,曹有龙,陈晓静,等.枸杞SRAP反应体系建立和优化[J].福建农林大学学报,2013,42(3):297-301.
[27]魏军亚,刘德兵.香蕉基因组SRAP反应体系的建立和优化[J].植物研究,2009,29(3):352-356.
[28]任羽,王得元.辣椒SRAP-PCR 反应体系的建立与优化[J].分子植物育种,2004,2(5):689-693.
Optimization by SRAP-PCR reaction system in rare medicinal herbPanaxjaponicusC. A. Mey
SONGJia,ZHANGShao-Peng,SUNQiao,LITian-Pei,ZENGWan-Yong,CHENPing
(School of Biology and Pharmaceutical Engineering,Wuhan Polytechnic University,Wuhan 430023,China)
Abstract:Panax japonicus C. A. Mey, an important medicinal herb, its wild resources are becoming endangered. Genetic diversity research of P. japonicas is significant for the conservation and sustainable utilization of these resources. In this study, optimum SRAP-PCR reaction system for P. japonicus DNA was constructed for the first time. The DNA of rhizome in P. japoncius was abstracted as PCR template. And, the concentration gradient of dNTPs, primer, DNA and Taq polymerase and Tmwere assessed respectively to optimize SRAP-PCR reaction system.An optimal and stable SRAP-PCR system for P. japonicus(Total of 25 μl) was as follows: DNA 40 ng, dNTPs 0.2 mmol/L, primer 0.36 umol/L, 10×PCR Buffer 2.5 μl, Taq polymerase 2U, Tm 50.Then, 24 random primers were chosen for further test. 2 couple of primers, Me1/Em5 and Me3/Em1, which can get clear and repeatable bands, were obtained after PCR. Finally, 10 different P. japonicus DNA samples were used to test this method using these 2 primers, which showed that rich polymorphism among P. japoncius plants from different area. Thus, this stable and suitable SRAP-PCR system can be used as an important method of molecular markers analysis for Panax plants genetic diversity studying.
Key words:Panax japonicus; SRAP -PCR ; construction;optimization
DOI:10.3969/j.issn.2095-7386.2015.02.005
文章编号:2095-7386(2015)02-0020-05
基金项目:湖北省教育厅科学技术研究计划青年人才项目(Q20151706).
通信作者:易阳(1986-),男,讲师,E-mail:yiy86@qq.com.
作者简介:孙杰(1986-),男,硕士研究生,E-mail:15263238341@163.com.
收稿日期:2015-01-07.
中图分类号:Q 949.95;TQ 460.6
文献标识码:A

