‘澳洲青苹’果实解袋后果皮花青苷合成的变化
孟 蕊,王亚杰,张伯虎,武月妮,2,杨亚州,赵政阳,*
(1.西北农林科技大学园艺学院,陕西 杨凌 712100;2.陕西省白水县园艺站,陕西 白水 715600)
‘澳洲青苹’果实解袋后果皮花青苷合成的变化
孟 蕊1,王亚杰1,张伯虎1,武月妮1,2,杨亚州1,赵政阳1,*
(1.西北农林科技大学园艺学院,陕西 杨凌 712100;2.陕西省白水县园艺站,陕西 白水 715600)
以‘澳洲青苹’为材料,测定套袋果实(对照组)与解袋后(处理组)果实果皮色泽参数、花青苷含量、多酚类物质含量以及与花青苷合成相关的调控基因(MdMYB1、MdbHLH3、MdbHLH33、MdTTG1)和结构基因(MdCHS、MdDFR、MdANS、MdUFGT)表达水平的变化。结果显示:光是影响果实着色的重要因素,套袋遮光抑制了果实着色,套袋果实解袋后果皮L*、b*值逐渐降低,a*值逐渐升高,果实红色加深;套袋抑制了果皮花青苷和黄酮醇合成,套袋果实解袋后果皮中矢车菊素-3-O-半乳糖苷、槲皮素-3-半乳糖苷和槲皮素-3-芦丁糖苷的含量逐渐升高,而套袋对其他的酚类物质影响不显著;套袋抑制了与花青苷合成相关基因的表达,套袋果实解袋曝光后,果皮中与花青苷相关调控基因和结构基因的表达水平均存在不同程度的升高,并且与果皮中花青苷含量变化的趋势基本一致,表明‘澳洲青苹’果实解袋后,果皮中与花青苷合成相关的基因迅速表达,从而促进了果皮中花青苷合成,而套袋抑制了果皮中与花青苷合成的相关基因的表达,从而抑制了花青苷合成。
澳洲青苹;花青苷;多酚;基因表达;套袋
苹果是中国第一大水果,中国也是世界第一大苹果生产国。色泽是苹果果实最重要的外观品质,果实的着色程度主要取决于果皮中花青苷含量的高低。花青苷是一种重要的类黄酮化合物,不仅能够使植物的花、果实等呈现丰富的色彩,还具有抗癌、抗氧化、延缓衰老等多种功效,其对人体的保健功能近年来也引起了广泛的关注[1-4]。研究花青苷合成的机理,对提高苹果果实商品价值具有重要意义。
前人研究[5-6]表明,苹果果皮中含有的最主要花青苷组分为矢车菊素-3-O-半乳糖苷。植物花青苷是在苯丙烷类代谢的基础上,与绿原酸、槲皮素、原花青素等物质一起,经类黄酮途径合成。苹果果皮中花青苷的生物合成途径已经确立[7],涉及了由苯丙氨酸解氨酶(phenylalanine ammonia-lyase,PAL)、查尔酮合成酶(chalcone synthase,CHS)、查尔酮异构酶(chalcone isomerase,CHI)、二氢黄酮醇还原酶(dihydroflavonol 4-reductase,DFR)、花青苷合成酶(anthocyanidin synthase,ANS)和类黄酮糖基转移酶(UDP glycose: flavonoid 3-O-glucosyl transferase,UFGT)等参与的一系列酶促反应。植物体内的花青苷的合成除受到参与花青苷合成的酶影响外,在转录水平上主要受MYB、bHLH和WD40三类转录因子的调控。关于花青苷合成的转录调控,在玉米、拟南芥和矮牵牛等模式植物中研究较多,近年来在肉质果实中,如葡萄、番茄、苹果等,也取得了重要进展[8-11]。目前,在苹果果实中也已经过克隆得到了MdMYB1、MdMYB10、MdMYBA等多个基因,其中MdMYB1被证实是控制苹果果皮色泽的重要基因[8-9]。但是,植物体内花青苷合成的机理极为复杂,受多种因素的影响,仍有许多问题亟待进一步研究。
‘澳洲青苹’是一个古老的苹果品种,果实呈典型的绿色。套袋是一项重要的栽培技术,能够影响果实的色泽、风味等,在中国苹果产区中应用极为广泛。在中国渭北黄土高原,‘澳洲青苹’套袋果实解袋后也能着鲜艳的红色,为研究果实花青苷调控机理提供了重要的材料。本研究以‘澳洲青苹’为试材,利用高效液相色谱(high performance liquid chromatography,HPLC)以及实时定量聚合酶链式反应(polymerase chain reaction,PCR)技术,测定其果实解袋后果皮色泽、矢车菊素-3-O-半乳糖苷含量、多酚类物质含量以及与花青苷合成相关的调节基因、结构基因相对表达量,旨在探究非红色果实的花青苷合成、调控机制,为进一步研究苹果果实花青苷合成机理提供参考。此外,果皮也是苹果果实中类黄酮物质含量较高的部位[12],研究果皮中类黄酮的合成调控机理,也有助于提高果实的食用价值。
1 材料与方法
1.1 材料及套袋处理
材料为苹果品种‘澳洲青苹’,树龄8 a生,基砧为新疆野苹果,中间砧为M26。实验于2013年在西北农林科技大学白水苹果试验站进行,选取树势一致、生长势强劲的植株8 株,于盛花期后 40 d采用‘鸿泰’双层纸袋对果实进行套袋处理,于盛花期后175 d解袋,解袋时先解除外层纸袋,3 d后解除内层纸袋。在解除内层纸袋后 0、2、4、6、8、10 d进行采样,以解袋的果实为处理组,以一直未解袋(内外层纸袋均不解除)的果实作为对照组。采样时选取树冠外围同一高度同一部位的果实,每次采样时在每棵树随机选取不同方向的4 个果实,混合样品,刮取果实胴部果皮(约1 cm宽),液氮速冻后-80 ℃保存备用。
1.2 试剂与仪器
矢车菊素-3-O-半乳糖苷标准品、绿原酸、根皮苷、表儿茶素、原花青素B2、槲皮素-3-半乳糖苷和槲皮素-3-芦丁糖苷标准品 美国Sigma公司。
柱式RNAout 2.0 Kit 北京天恩泽公司;PrimeScriptR RT reagent Kit With gDNA Eraser、SYBR GreenⅠMaster 日本Takara公司;Minolta CR-400型色差计 日本柯尼卡-美达能公司;高效液相色谱仪(1525型高精度二元高压梯度泵、2707型自动进样器、2998光电二极管阵列检测器、C18色谱柱(250 mm×4.6 mm,5 μm)) 美国Waters公司;IQ5实时定量PCR仪 美国伯乐公司。
1.3 方法
1.3.1 指标测定
1.3.1.1 果皮色泽参数测定
在果皮赤道部位选5 个点,使用Minolta CR-400型色差计,采用国际照明委员会颁布的CIELAB评价体系测定果皮L*、a*、b*值。其中,L*值表示亮度,绝对值越大表示亮度越高;a*值表示红绿色度,a*值为正代表红色,为负代表绿色,绝对值越大表示颜色越深;b*值表示黄蓝色度,b*值为正代表黄色,为负代表蓝色,绝对值越大表示颜色越深。
1.3.1.2 果皮花青苷含量测定
样品预处理:取0.5 g果皮液氮研磨成粉末,加入10 mL 0.5%的盐酸-甲醇溶液,4 ℃避光浸提24 h后,12 000×g离心10 min,取1.5 mL上清液,经0.45 μm微孔过滤器过滤后,转移至自动进样瓶备用。每个样品设4 次重复。
高效液相色谱分析:洗脱条件参考刘玉莲等[5]的方法,略有改动:进样量10 μL,柱温40 ℃,检测波520 nm,流速1.0 mL/min;流动相为溶液A(甲醇)和溶液B(10%甲酸),利用溶液A进行梯度洗脱:0 min,17%;1 min,17%;15 min,35%;20 min,37%;25 min,100%。
1.3.1.3 果皮多酚类物质含量测定
样品预处理:取1.0 g果皮液氮研磨成粉末,加入30 mL 70%的甲醇溶液,30 ℃超声提取 30 min后,12 000×g离心10 min,取1.5 mL上清液,经 0.45 μm微孔过滤器过滤后,转移至自动进样瓶备用。每个样品设4 次重复。
高效液相色谱分析:洗脱条件:进样量10 μL,柱温30 ℃,检测波长280、320 nm,流速1.0 mL/min;流动相为溶液A(甲醇)和溶液B(1%乙酸溶液),利用溶液A进行梯度洗脱:0 min,5% A;25 min,30% A; 30 min,60% A;40 min,5% A。
1.3.2 实时定量PCR
利用柱式RNAout 2.0 Kit提取及纯化样品总RNA。利用PrimeScriptR RT reagent Kit With gDNA Eraser(Perfect Real Time)试剂盒,进行反转录,得到cDNA。根据基因序列设计特异性引物(表1)进行实时定量PCR扩增。PCR反应体系为:SYBR GreenⅠMaster 10 μL,上、下游引物(10 μmol/L)各0.8 μL,cDNA模板2 μL,灭菌蒸馏水6.4 μL。PCR 反应程序为:95 ℃、3 min;95 ℃、10 s,58℃、30 s,72 ℃、15 s,40 个循环;72 ℃、7 min。以Actin(GenBank序列号为 AB638619)为内参基因,每个反应设3 次重复。实验结果用2−ΔΔCt法对数据进行定量分析。

表1 实时定量PCR引物序列Table1 Sequences of the primer pairs for real-time PCR
1.4 数据分析
采用SPSS 18.0软件对色泽参数、花青苷含量、多酚类物质含量和基因相对表达量的均值和方差进行分析,显著性差异分析采用邓肯极差法,不同字母表示在P = 0.05水平上差异显著。
2 结果与分析
2.1 ‘澳洲青苹’果实解袋后果皮色泽的变化

图1 ‘澳洲青苹’果实解袋后果皮颜色的变化Fig.1 Color development in apple skin of ‘Granny Smith’ after bag removal
如图1所示,解袋0 d的‘澳洲青苹’果实不着色,随着解袋时间的延长,果实红色加深(未显示)。如图2所示,对照组‘澳洲青苹’果实L*、a*、b*值基本保持不变,且L*值一直维持在较高水平,a*值一直为负,说明套袋提高了果面亮度,抑制了果实着色;处理组‘澳洲青苹’果实解袋后,L*、b*值下降,a*值升高,表现出亮度下降、红色加深的趋势。果皮色泽参数在解袋后2 d到解袋后8 d变化最为明显,其中a*值的变化趋势与果实红色变化趋势一致(图1)。

图2 ‘澳洲青苹’果实解袋后果皮L*(A)、a**(BB)和b*(C)值的变化Fig.2 Changes in L*, a* and b* in the skin of ‘Granny Smith’after bag removal
2.2 ‘澳洲青苹’果实解袋后果皮中矢车菊素-3-O-半乳糖苷含量的变化
矢车菊素-3-O-半乳糖苷是苹果果皮中最主要的花青苷组分,也是‘澳洲青苹’果实着色后,果皮含有的主要花青苷组分[5],可以说明果皮中花青苷含量变化的趋势。处理组‘澳洲青苹’果实在解袋后果皮中矢车菊素-3-O-半乳糖苷含量迅速上升,而对照组果实果皮中则一直未检测到矢车菊素-3-O-半乳糖苷合成(图3)。如图3所示,‘澳洲青苹’果实在解袋后第2~10天花青苷合成最为迅速,矢车菊素-3-O-半乳糖苷含量也由第2天的0.37 mg/100 g上升到第10天的10.34 mg/100 g。‘澳洲青苹’果皮中矢车菊素-3-O-半乳糖苷含量的变化趋势与a*值的变化趋势以及果实红色加深趋势基本一致。

图3 ‘澳洲青苹’果实解袋后果皮矢车菊素--33--O-半乳糖苷含量的变化Fig.3 Changes in Cy 3-O-gal concentration in the skin of ‘Granny Smith’ after bag removal
2.3 ‘澳洲青苹’果实解袋后果皮中多酚类物质含量的变化

表2 ‘澳洲青苹’果实解袋后果皮中多酚物质含量的变化Table2 Changes in concentrations of phenolic compounds in the skin ooff ‘Granny Smiitthh’ after bag removalmg/g
如表2所示,处理组‘澳洲青苹’果实解袋后,果皮中各酚类物质含量的变化趋势不一致。果皮中绿原酸含量,在果实解袋后略有降低。由表2可知,对照组和处理组果实果皮中根皮苷含量在解袋后的前6 d都呈现降低趋势,但处理组果实果皮中根皮苷含量在解袋后6 d后又开始上升,同时对照组果皮中根皮苷含量继续下降,最终处理组果实果皮中根皮苷含量要显著高于对照组(P<0.05)。果皮中主要的黄酮醇类物质——槲皮素-3-半乳糖苷和槲皮素-3-芦丁糖苷的含量,在果实解袋后迅速上升,在解袋后8 d达到峰值,其中槲皮素-3-半乳糖苷含量最高(表2)。处理组果皮中主要原花青素类物质——表儿茶素和原花青素B2的含量,在解袋后4 d升至最高,且显著高于对照组(P<0.05),随后又略有下降;而对照组中原花青素类物质含量与处理组变化趋势基本一致(表2)。
2.4 ‘澳洲青苹’果实解袋后果皮中与花青苷合成相关调控基因表达分析
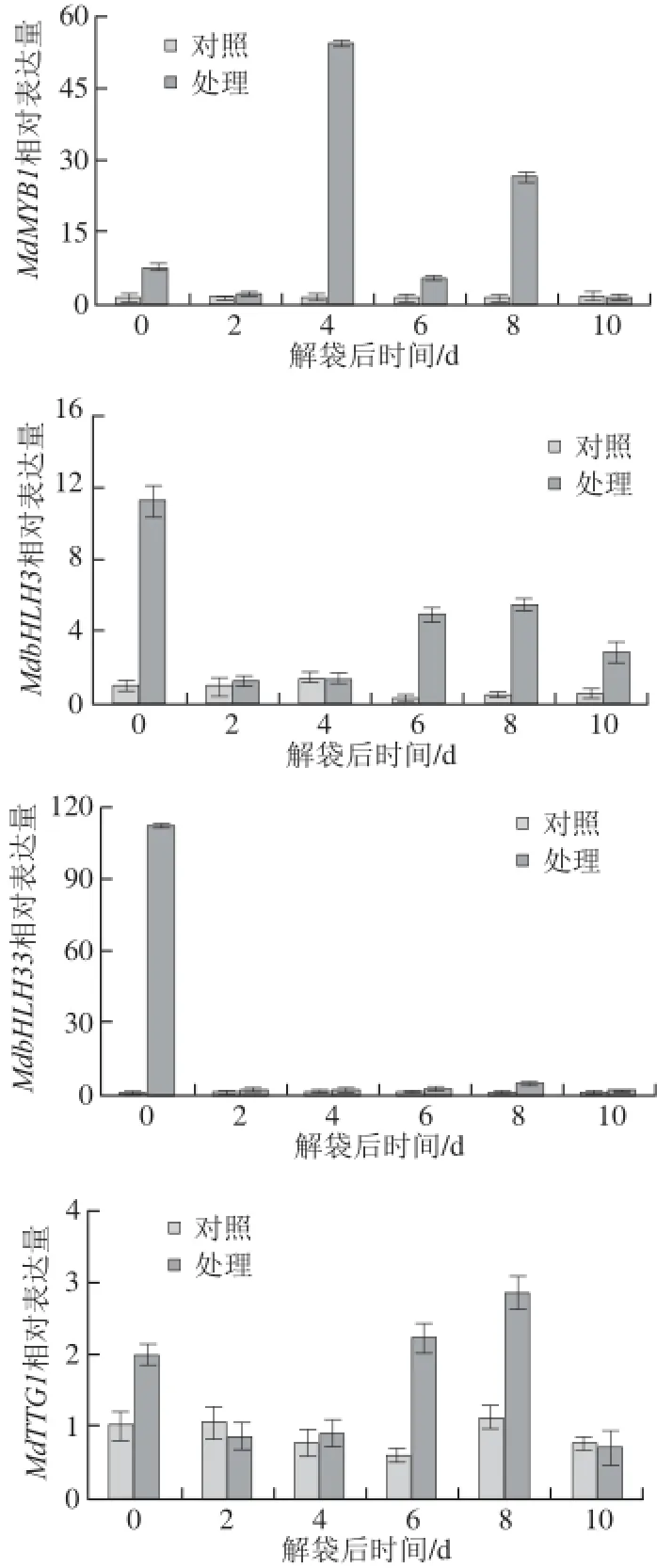
图4 ‘澳洲青苹’果实解袋后与花青苷合成相关调控基因表达水平的变化Fig.4 Changes in expression levels of genes involved in the regulation of anthocyanin biosynthesis in the skin of ‘Granny Smith’after bag removal
如图4所示,与对照组相比,处理组‘澳洲青苹’果实解袋后,果皮中与花青苷合成相关的调控基因的表达水平都有所上升。MdMYB1的相对表达量在果实解袋后明显上调,且显著高于对照组(P<0.05)。MdMYB1的表达水平呈波动式上升,在解袋后0、4、8 d处于较高水平,在解袋后4 d达到峰值。除MdMYB1外,其他3 个转录因子基因——MdbHLH3、MdbHLH33和MdTTG1的表达水平在果实解袋后0 d立即上调,其中MdbHLH3、MdbHLH33的相对表达量较对照组上调了10 倍以上,在解袋后2、4 d,MdbHLH3、MdbHLH33和MdTTG1的表达水平有所下降,从解袋后6 d又开始上升,在解袋后8 d达到高峰后,又开始下降。与处理组相比,未解袋的‘澳洲青苹’果实果皮中各基因表达水平变化较小,且一直处于较低水平。在解袋后2 d,对照组与处理组果皮中与花青苷合成相关的调控基因的表达水平都较低。
2.5 ‘澳洲青苹’果实解袋后果皮中与花青苷合成相关结构基因表达分析
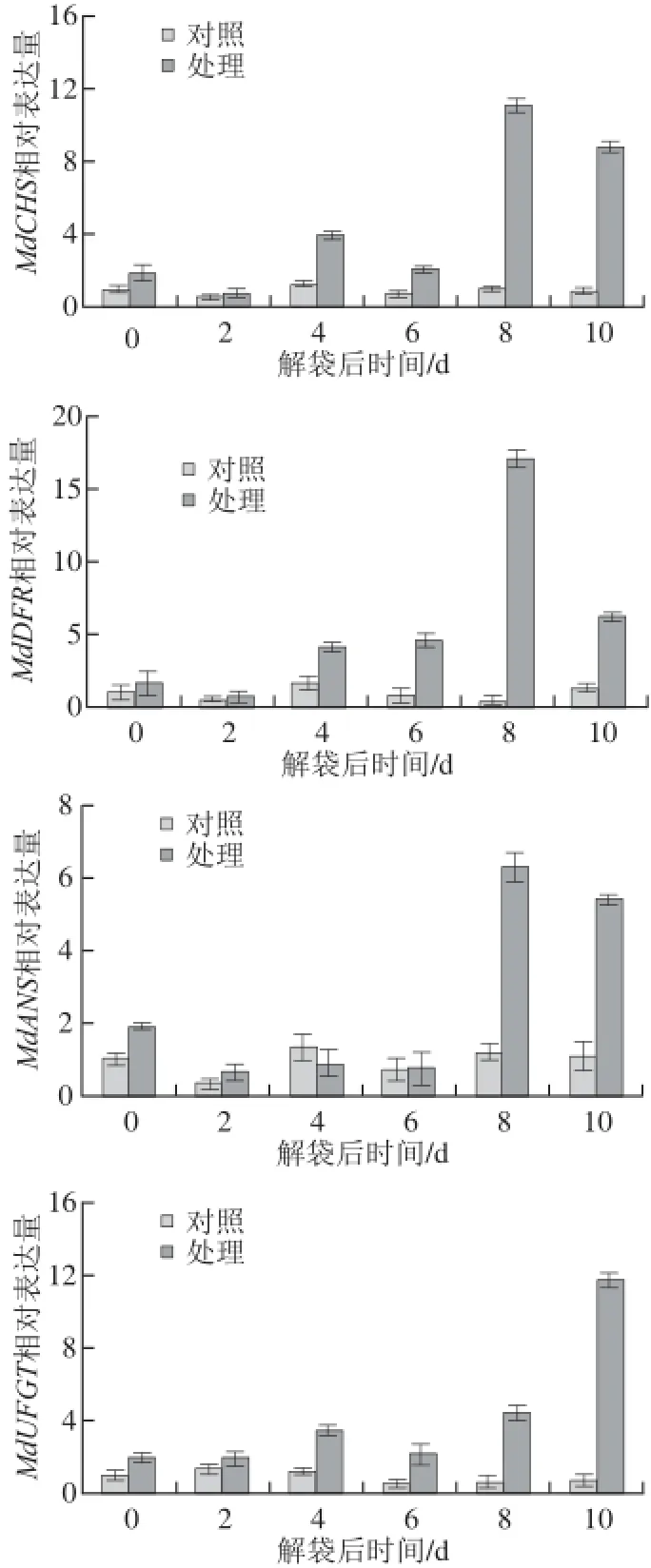
图5 ‘澳洲青苹’果实解袋后与花青苷合成相关结构基因表达水平的变化Fig.5 Changes in expression levels of anthocyanin-related structural genes in the skin of ‘Granny Smith’ after bag removal
如图5所示,与解袋果实相比,对照组‘澳洲青苹’果皮中相关结构基因——MdCHS、MdDFR、MdANS和MdUFGT的表达水平变化较小,并且一直维持在较低水平。处理组‘澳洲青苹’果实在解袋后,果皮中与花青苷合成相关的结构基因的表达水平持续上升,其中MdCHS、MdDFR、MdANS的表达水平在解袋后8 d达到峰值后略有下降,MdUFGT的表达水平在解袋后10 d达到峰值。
3 讨 论
套袋是一项重要的栽培措施,能够改善苹果果实色泽,影响果实的品质,在中国苹果产区应用广泛[13-14]。在对红色苹果品种的研究中发现,套袋能够显著抑制苹果果实花青苷的合成,而套袋后的解袋过程能够促进花青苷的迅速合成[15]。本研究发现,在渭北黄土高原地区,绿色苹果品种‘澳洲青苹’果实经套袋处理后,也能够着鲜艳的红色。并且‘澳洲青苹’果皮色泽的变化与矢车菊素-3-O-半乳糖苷含量变化趋势一致,‘澳洲青苹’套袋果实不着色,果皮中也未检测到花青苷合成,而套袋果实解除内袋后果皮中矢车菊素-3-O-半乳糖苷迅速积累,a*值不断升高,红色加深,这一现象与前人[15-16]在红色品种中的研究结果基本一致。
植物体内含有的其他多酚类物质,诸如酚酸、二氢查尔酮、黄酮醇、原花青素,与花青苷一样,都经由类黄酮代谢途径产生。近年来,苹果多酚的抗氧化等功能也引起了广泛关注,关于花青苷合成与其他酚类物质代谢的关系也成为了研究热点,但前人的结论并不一致。许多研究者认为苹果中花青苷合成与其他酚类物质代谢没有明显的联系,二者的合成调控机制可能是彼此独立的[7-8,17]。本研究中也发现,果皮中原花青素、绿原酸和根皮苷的含量在果实解袋后,与对照组相比,没有显著的差异,与花青苷合成没有明显的相关性,但是果皮中黄酮醇,即槲皮素-3-半乳糖苷和槲皮素-3-芦丁糖苷的含量变化在解袋后迅速上升,与花青苷合成趋势相似。Ju Zhigao等[17]发现套袋抑制了花青苷合成,但却对简单酚类物质、类黄酮物质含量没有影响,而Feng Fengguo等[18]发现套袋降低了‘乔纳金’果皮中多酚类物质的含量,但解袋曝光后,酚类物质含量会有所上升。本研究中发现‘澳洲青苹’果实解袋后,仅黄酮醇的含量会有所上升,与前人的研究结果并不完全一致,关于多酚类物质代谢与花青苷合成之间的关系,还需要进一步研究。
影响苹果花青苷合成的调控基因,即编码相关转录因子的基因,主要包括MYB、bHLH和WD40 3 类:其中MYB转录因子是目前研究最多的一类转录因子,已有多人的研究结果表明MdMYB1基因是诱导红色苹果品种果实中花青苷合成的关键基因[8,11,19];bHLH类转录因子、WD40类转录因子对于苹果花青苷合成也具有直接或者间接的促进作用[11]。本研究中发现,‘澳洲青苹’套袋果实未解袋时果皮中各调控基因的表达一直处于较低水平;果实解袋后,各调控基因表达水平都存在不同程度的上调,可见绿色苹果品种‘澳洲青苹’着色过程也与MYB、bHLH、WD40三类转录因子密切相关。但是,‘澳洲青苹’在解袋后,果皮中各调控基因的表达水平变化趋势略有不同,其中MdTTG1、MdbHLH3表达水平变化趋势较为一致,且与果皮花青苷含量变化正相关,而MdMYB1的表达水平的升高要早于花青苷合成的开始。因此推断,在‘澳洲青苹’果实解袋后的着色过程中,MdMYB1可能与MdTTG1和MdbHLH基因相互作用,共同调控花青苷合成。在对苹果愈伤组织进行研究时,研究者发现MdTTG1能够与bHLH转录因子互作,MdbHLH3可以与MdMYB1互作,促进苹果果实花青苷合成[10,20]。
参与苹果果实花青苷代谢途径的酶,目前研究较多的包括PAL、CHS、CHI、DFR、ANS、UFGT:其中UFGT被多个研究者认为是控制红色苹果果实着色的关键酶[21-22],UFGT活性和MdUFGT基因表达的缺失是导致‘Malay’苹果白色突变体不着色的主要原因[23];而其他几种酶虽被认为对苹果花青苷合成具有较为重要的作用,但研究者的看法并不统一[16,21,24]。Ubi等[25]发现CHS、DFR、ANS、UFGT基因在红色苹果品种着色过程中表达水平与花青苷积累相关,这些基因的共同表达促进了花青苷的合成,而在绿色品种中这些基因不表达。本研究中也发现,处理组‘澳洲青苹’果实在解袋后,果皮中相关结构基因——MdCHS、MdDFR、MdANS和MdUFGT的表达水同步上调,与果皮花青苷含量升高密切相关,由此推测绿色苹果品种‘澳洲青苹’果皮花青苷合成过程中,可能不存在关键酶,结构基因受到了转录因子的调控,同步上调,促进了花青苷合成,这一结果也与前人在红色品种中研究结果一致[6,8]。此外,这些结构基因的表达高峰出现在调控基因之后,这可能是结构基因受到调控基因的诱导后表达的结果。Xie Xingbin等[20]也发现MdbHLH3可以与MdUFGT、MdDFR启动子结合,启动这些基因的表达,促进苹果果实花青苷合成。
通过本研究发现,套袋抑制了‘澳洲青苹’果皮中与花青苷合成相关基因的表达,从而抑制了果皮花青苷的合成,套袋后的解袋过程又通过促进果皮中相关基因的表达,诱导了果皮花青苷的合成,绿色苹果品种‘澳洲青苹’果皮花青苷合成的机制与红色苹果品种相似。此外,套袋对果皮多酚类物质(除槲皮素外)含量并没有显著的影响,但果皮中黄酮醇的含量变化与花青苷含量变化一致,其与花青苷是否受到共同调控还需进一步研究。
[1] COOPER-DRIVER G A. Contributions of Jeffrey Harborne and coworkers to the study of anthocyanins[J]. Phytochemistry, 2001, 56(3): 229-236.
[2] MARTIN C, GERATS T. Control of pigment biosynthesis genes during petal development[J]. Plant Cell, 1993, 5(10): 1253-1264.
[3] SARKAR F H. Nutraceuticals and cancer[M]. Netherlands: Springer Netherlands, 2012: 201-229.
[4] PENG T, SATIO T, HONDA C, et al. Screening of UV-B-induced genes from apple peels by SSH: possible involvement of MdCOP1-mediated signaling cascade genes in anthocyanin accumulation[J]. Physiologia Plantarum, 2013, 148(3): 432-444.
[5] 刘玉莲, 车飞, 郭延平, 等. 苹果着色期花青苷和糖组分含量变化及关联性[J]. 食品科学, 2013, 34(17): 47-52.doi: 10.7506/spkx1002-6630-201317011.
[6] HONDA C, KOTODA N, WADA M, et al. Anthocyanin biosynthetic genes are coordinately expressed during red coloration in apple skin[J]. Plant Physiology and Biochemistry, 2002, 40(11): 955-962.
[7] TAKOS A M, UBI B E, ROBINSON S P, et al. Condensed tannin biosynthesis genes are regulated separately from other flavonoid biosynthesis genes in apple fruit skin[J]. Plant Science, 2006, 170(3): 487-499.
[8] TAKOS A M, JAFFE F W, JACOB S R, et al. Light-induced expression of a MYB gene regulates anthocyanin biosynthesis in red apples[J]. Plant Physiology, 2006, 142(3): 1216-1232.
[9] 刘晓芬, 李方, 殷学仁, 等. 花青苷生物合成转录调控研究进展[J].园艺学报, 2013, 40(11): 2295-2306.
[10] AN Xiuhong, TIAN Yi, CHEN Keqin, et al. The apple WD40 protein MdTTG1 interacts with bHLH but not MYB proteins to regulate anthocyanin accumulation[J]. Journal of Plant Physiology, 2012, 169(7): 710-717.
[11] PENG T, MORIGUCHI T. The molecular network regulating the coloration in apple[J]. Scientia Horticulturae, 2013, 163: 1-9.
[12] 聂继云, 吕德国, 李静, 等. 苹果果实中类黄酮化合物的研究进展[J].园艺学报, 2009, 36(9): 1390-1397.
[13] 王少敏, 高华君, 张骁兵. 套袋对红富士苹果色素及糖、酸含量的影响[J]. 园艺学报, 2002, 29(3): 263-265.
[14] 高华君, 王少敏, 王江勇. 套袋对苹果果皮花青苷合成及着色的影响[J]. 果树学报, 2006, 23(5): 750-755.
[15] JU Zhiguo. Fruit bagging, a useful method for studying anthocyanin synthesis and gene expression in apples[J]. Scientia Horticulturae, 1998, 77(3): 155-164.
[16] JU Zhiguo, YUAN Yongbing, LIOU Chenglian, et al. Relationships among phenylalanine ammonia-lyase activity, simple phenol concentrations and anthocyanin accumulation in apple[J]. Scientia Horticulturae, 1995, 61(3/4): 215-226.
[17] JU Zhiguo, YUAN Yongbing, LIU Chenglian, et al. Relationships among simple phenol, flavonoid and anthocyanin in apple fruit peel at harvest and scald susceptibility[J]. Postharvest Biology and Technology, 1996, 8(2): 83-93.
[18] FENG Fengjuan, LI Mingjun, MA Fengwang, et al. The effects of bagging and debagging on external fruit quality, metabolites, and the expression of anthocyanin biosynthetic genes in ‘Jonagold’ apple (Malus domestica Borkh.)[J]. Scientia Horticulturae, 2014, 165: 123-131.
[19] ESPLEY R V, HELLENS R P, PUTTERILL J, et al. Red colouration in apple fruit is due to the activity of the MYB transcription factor, MdMYB10[J]. Plant Journal, 2007, 49(3): 414-427.
[20] XIE Xingbin, LI Shen, ZHANG Ruifen, et al. The bHLH transcription factor MdbHLH3 promotes anthocyanin accumulation and fruit colouration in response to low temperature in apples[J]. Plant Cell Environment, 2012, 35(11): 1884-1897.
[21] LIU Yulian, CHE Fei, WANG Lixin, et al. Fruit coloration and anthocyanin biosynthesis after bag removal in non-red and red apples (Malus×domestica Borkh.)[J]. Molecules, 2013, 18(2): 1549-1563.
[22] JU Zhiguo, LIU Chenglian, YUAN Yongbing. Activities of chalcone synthase and UDPGal: fl avonoid-3-O-glycosyltransferase in relation to anthocyanin synthesis in apple[J]. Scientia Horticulturae, 1995, 63(3): 175-185.
[23] KOTEPONG P, KETSA S, DOOM W G. A white mutant of Malay apple fruit (Syzygium malaccense) lacks transcript expression and activity for the last enzyme of anthocyanin synthesis, and the normal expression of a MYB transcription factor[J]. Functional Plant Biology, 2011, 38(1): 75-86.
[24] JU Zhiguo, YUAN Yongbing, LΙU Chengliang, et al. Dihydrofl avonol reductase activity and anthocyanin accumulation in ‘Delicious’,‘Golden Delicious’ and ‘Ιndo’ apples[J]. Scientia Horticulturae, 1997, 70(1): 31-43.
[25] UBI B E, HONDA C, BESSHO H, et al. Expression analysis of anthocyanin biosynthetic genes in apple skin: effect of UV-B and temperature[J]. Plant Science, 2006, 170(3): 571-578.
Anthocyanin Biosynthesis in the Apple Skin of ‘Granny Smith’ after Bag Removal
MENG Rui1, WANG Yajie1, ZHANG Bohu1, WU Yueni1,2, YANG Yazhou1, ZHAO Zhengyang1,*
(1. College of Horticulture, Northwest A&F University, Yangling 712100, China; 2. Baishui Horticultural Station of Shaanxi Province, Baishui 715600, China)
Changes in fruit color, anthocyanins and phenolic compounds concentrations and the relative expression of MdMYB1, MdbHLH3, MdbHLH33, MdTTG1, MdCHS, MdDFR, MdANS and MdUFGT were determined in apple skin of bagged and bag-removed ‘Granny Smith’ fruits. Light is a key factor for fruit coloration. Red color development, fl avonol accumulation and anthocyanin biosynthesis in apple fruit skin were depressed by fruit bagging, while the values of L* and b* dropped, a* value and the concentrations of cyaniding-3-galactose, quercetin-3-galactoside and quercetin-3-rhamnosyl glucoside were increased radically in apple skin of ‘Granny Smith’ after bag removal, indicating the deepening of red color in the skin; fruit debagging had no signifi cant effects on chlorogenic acid, phlorizin and procyanidine accumulation. Similar to anthocyanins, transcript levels of MdMYB1, MdbHLH3, MdbHLH33, MdTTG1, MdCHS, MdDFR, MdANS and MdUFGT, the genes involved in anthocyanin biosynthesis were also depressed by fruit bagging. All the genes were induced by light after bag removal. It is demonstrated that fruit bagging inhibits anthocyanin biosynthesis by supressing the expression of genes involved in anthocyanin biosynthesis, and these genes could be induced by bag removal, leading to anthocyanin accumulation in apple skin.
Granny Smith; anthocyanin; polyphenol; gene expression; bagging
S661.1
A
1002-6630(2015)22-0216-06
10.7506/spkx1002-6630-201522041
2015-02-04
国家现代农业产业技术体系建设专项(CARS-28);“十二五”农村领域国家科技计划项目(2013BAD02B01-2);“十二五”国家科技支撑计划项目(2014BAD16B06)
孟蕊(1989—),女,博士研究生,研究方向为果树育种与生物技术、苹果果实品质改良。E-mail:yiran4114@163.com
*通信作者:赵政阳(1964—),男,教授,博士,研究方向为果树育种与生物技术、苹果果实品质改良。E-mail:zhaozy@nwsuaf.edu.cn

