液相制备油茶叶提取物组分及其结构鉴定
曹清明,钟海雁,邬靖宇,包莉圆,孙亚娟
(中南林业科技大学 a.经济林培育与保护省部共建教育部重点实验室;b.食品科学与工程学院,湖南 长沙 410004)
液相制备油茶叶提取物组分及其结构鉴定
曹清明a,b,钟海雁a,b,邬靖宇b,包莉圆b,孙亚娟b
(中南林业科技大学 a.经济林培育与保护省部共建教育部重点实验室;b.食品科学与工程学院,湖南 长沙 410004)
为了综合开发利用油茶资源,对油茶叶提取物的组分进行了制备和鉴定。将经过大孔树脂和柱分离纯化收集的组分II、III和VIII等油茶叶提取物3个组分进行了HPLC制备,得到了8个纯度较高的化合物,通过薄层显色、高清晰质谱和NMR,鉴定了其中4个化合物为:二氢白藜芦醇(1)、槲皮素(3)、槲皮素-3-鼠李糖苷(6)、1-(3′, 5′-二甲氧基)苯基2-[4″-O-β-D-吡喃葡萄糖基(6→1)-O-α-L-吡喃鼠李糖基]苯乙烷(8),其中槲皮素和槲皮素-3-鼠李糖苷是油茶中最常见的2个黄酮类物质,1-(3′,5′-二甲氧基)苯基2-[4′-O-β-D-吡喃葡萄糖基(6→1)-O-α-L-吡喃鼠李糖基]苯乙烷为第2次报道,但提取率远高于首次报道,二氢白藜芦醇在山茶属植物中属首次报道。
液相色谱;制备;高清晰质谱;结构鉴定;核磁
茶油不饱和脂肪酸含量接近90%[1-4],其脂肪酸组成与橄榄油极为相似,在许多品质指标上也较为接近,随着人们追求健康绿色需求的增大,具有中国特色的茶油越来越受到人们的重视。为了提高油茶的利用率,其副产物活性成分的研究也成为热点,主要侧重于油茶籽[5-7]、油茶粕[8-10]、茶油品质[11-13]、油茶种质资源[14-15]、油茶果皮[16-19]等方面,对油茶叶的研究报道相对较少。
研究表明,油茶叶含有脂肪、蛋白质、还原糖、氨基酸、茶皂素[20]、叶绿素[21]以及黄酮类化合物[22]等成分。油茶叶中提取物具有多种功效作用,包括抗氧化[22]、抗菌、降血脂和抗癌等功效,民间用来治疗无名肿毒、犬咬及火烧成疮等疾病[23]。
分离纯化可简化样品[24],快速获得纯度较高的单体化合物。油茶叶成分复杂,将其乙醇提取物进行大孔树脂粗分离[25]和柱层析法分离[26],有利于对油茶叶组成成分的提取,也有利于对其成分的功能性质进行探究。
制备型高效液相色谱法可以是一种特殊的柱层析方法,携带混合物的流动相经过固定相时,由于各物质性质的差异,在固定相上滞留的时间有长短之分,因而根据滞留时间的长短按先后顺序在固定相中流出,从而达到分离效果[27]。本试验中以油茶叶为材料,在D-101大孔树脂分离和硅胶柱层析分离纯化样品的基础上,利用高效液相半制备纯度较高的化合物。
1 材料与方法
1.1 试验材料
(1)新鲜油茶叶 采自湖南省天际岭国家森林公园,由中南林业科技大学谭晓风教授鉴定为普通油茶Camellia oleifera叶。
(2)试剂 甲醇,美国Fluka公司生产;乙醇,国药集团生产;二氯甲烷,国药集团生产;二甲基亚砜(DMSO),国药集团生产;D-101大孔树脂,天津富邦化工科技有限公司生产;硅胶层析用硅胶,青岛海洋公司生产。
(3)仪器 分析用液相色谱仪为依利特高效液相色谱仪,配UV1201检测器;分析色谱柱为Unitary C18 4.6 mm×250 mm,5 μm,浙江华谱新创科技有限公司生产;制备色谱柱为C18,10 mm×250 mm,5 μm,浙江华谱新创科技有限公司生产;创新通恒科技有限公司生产的LC3000型液相色谱仪(半制备液相色谱);创新通恒科技有限公司生产的LC6000高效液相色谱仪(DAC制备色谱)。紫外可见分光光计(UV-6300),上海美谱达仪器有限公司生产;高速万能粉碎机,天津泰斯特仪器公司生产;旋转蒸发仪(R-205B),上海申胜仪器公司生产;恒温水浴锅,北京医疗电子仪器厂生产;超声波清洗器(JK-500B),合肥金尼克机械制造有限公司生产;氮吹仪,北京优晟联合科技有限公司生产; UV-6300扫描型紫外可见分光光度计,上海美谱达仪器有限公司生产;安捷伦LC-MS组成系统,Agilent 1260安捷伦1260无限生物惰性四元泵(G5611A);Agilent 1260高性能生物惰性自动进样器(G5667A);Agilent 1290无限柱温箱(G1316C);G1315D二极管阵列检测器;Agilent 6530 QTOF 质谱系统;超导傅立叶变换核磁共振仪,AVANCE 400MHZ,瑞士Bruker公司生产。
1.2 试验流程
粗细分离得到化合物的过程如图1所示。
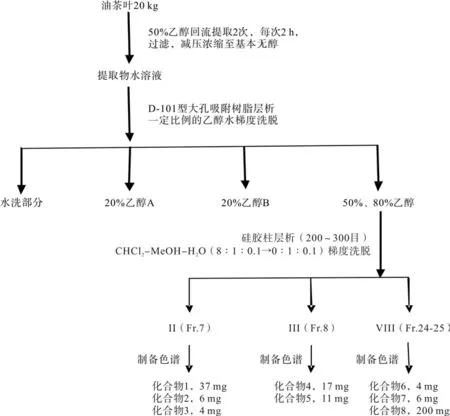
图1 化合物制备流程Fig. 1 Process of compounds preparation
1.3 试验方法
1.3.1 油茶叶50%乙醇提取物的制备
油茶干燥叶粉末20 kg,用50%乙醇按料液比1∶3加热回流提取2次,每次提取2 h,过滤,减压浓缩为浓缩前的1/2,得油茶叶提取液,备用。
1.3.2 高效液相半制备
(1)高纯度化合物的制备 将硅胶制备的接收液用适量DMSO溶解,根据高效液相色谱谱图的出峰时间收集制备单体化合物。
(2)化合物纯度检测 将制备的单体化合物,用液相色谱检测,根据谱图的峰面积判断制备样品的纯度。色谱检测条件:流动相A为甲醇,B为0.2%甲酸。洗脱梯度:50%甲醇0 min;50%甲醇15 min;80%甲醇0~25 min;85%甲醇25~35 min。进样量5 μL,检测波长254 nm,流速1 mL/min。
1.3.3 结构鉴定
对样品成分进行质谱分析,质谱条件见表1。
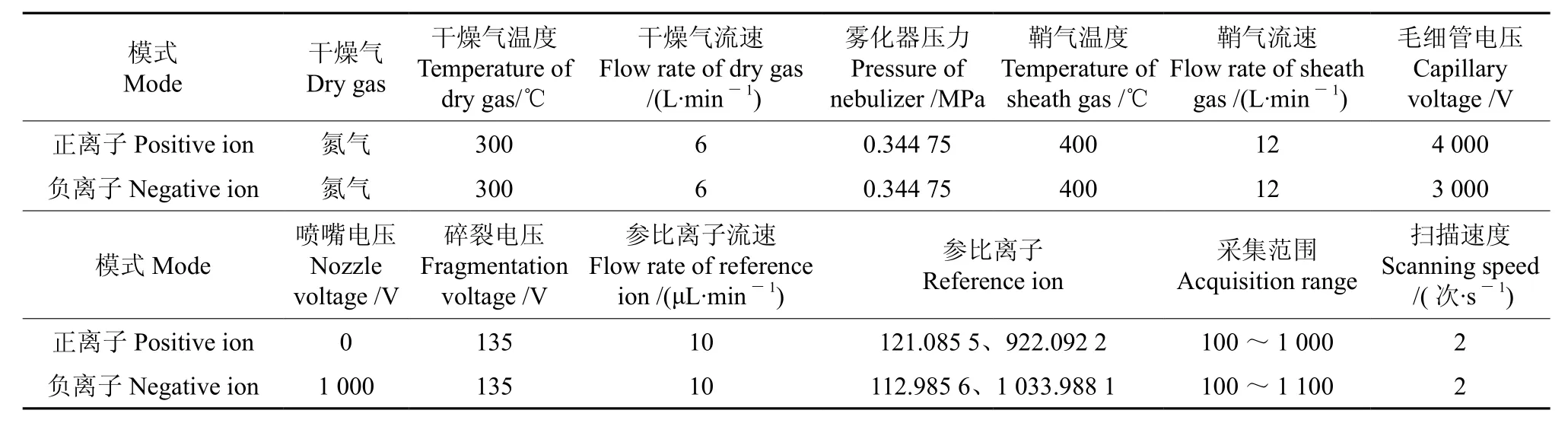
表1 质谱参数Table 1 Mass spectrum parameters
色谱条件为:流动相A 0.2%甲酸溶液,流动相B甲醇。溶剂梯度为0~35 min内流动相B由0%增至100%,流速为0.2 mL/min;进样量5 μL;检测波长254 nm。
NMR:核磁共振所有H谱均为400 MHz,所有13C谱均为100 MHz。核磁共振检测条件:核磁共振一维和二维脉冲序列采用仪器的相应标准程序,1H-NMR谱采样脉冲宽度90°,累加32次;13C-NMR谱采样脉冲宽度90°,累加2 000次,H-H COSY、HSQC、HMBC这3种试验采样数据阵均为F2×F1=2 048×256,零填充至2 048×1 024进行FT变换,窗函数处理谱图。
1.3.4 数据处理
质谱处理软件:Agilent MassHunter Workstation Software,Version B.04.00,Build 4.0.479.0。 色 谱处理软件:Agilent 1200 Chemstations软件。利用质谱分子式计算器对碎片离子峰进行分析。
2 结果与分析
2.1 HPLC制备高纯度化合物
2.1.1 组分II(7)中化合物的制备
图2是组分II的液相色谱图,分别制备1~5号峰,并对接收到的5段接收液进行纯度检验。
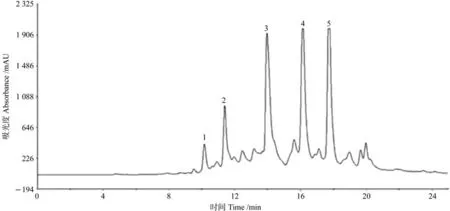
图2 组分II(7)液相色谱制备Fig. 2 HPLC preparation of part II (7)
由图2可知,1号和2号杂质含量较高,3、4、5号峰纯度在90%以上,达到做结构鉴定的要求。将这3个峰对应的接收液浓缩称重得到3个化合物:化合物1(3号峰)37 mg;化合物2(4号峰)6 mg;化合物3(5号峰)4 mg。经计算可得,化合物1提取得率37 mg/kg,化合物2的提取得率6 mg/kg,化合物3提取得率4 mg/kg。
2.1.2 组分III(8)中化合物的制备
图3是组分III的液相色谱图,分别收集制备1~3号峰,并对接收到的3段接收液进行纯度检验。
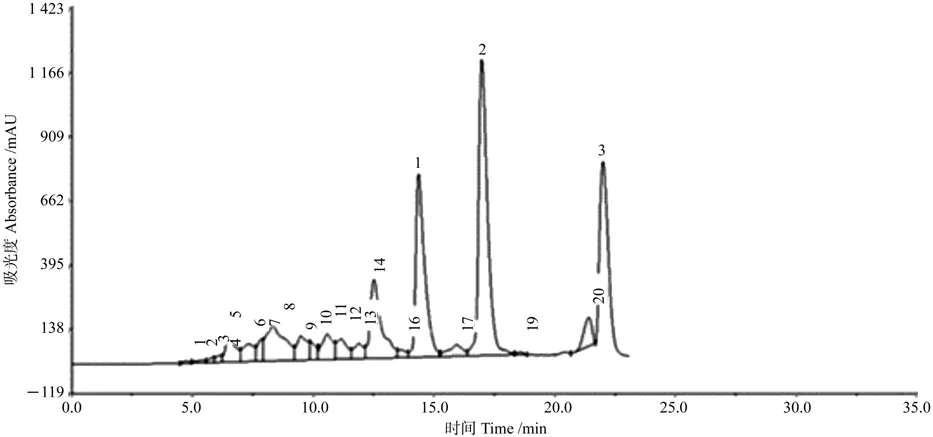
图3 组分III(8)液相色谱制备Fig. 3 HPLC preparation of part III (8)
由图3可知,1号和2号有单一色谱峰且峰形尖锐,由色谱峰面积计算纯度在90%以上,而3号峰接收液中含有2个相连的明显色谱峰,纯度要求低于结构鉴定水平。制备得到化合物4(1号峰)17 mg,化合物5(2号峰)11 mg。经计算可得,化合物4的提取得率为17 mg/kg,化合物5的得率为11 mg/kg。
2.1.3 组分VIII(19~22)中化合物的制备
图4是组分VIII的液相色谱图,分别收集制备1~4号峰,并对接收到的4个化合物进行纯度检验。
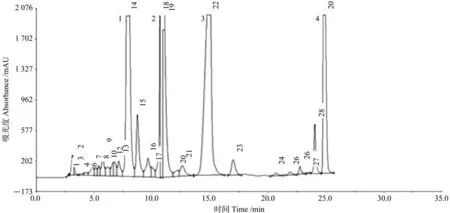
图4 组分VIII(19~22)液相色谱制备Fig. 4 HPLC preparation of part III (19-22)
由图4可知,1号峰代表的物质虽然在低剂量的纯度检验中仅有1个明显峰,但是峰形较宽,纯度不够,2~4号峰代表的物质检测所得色谱峰只含有1个明显色谱峰且色谱峰峰形尖锐,根据峰面积计算得到的纯度均在90%以上,达到做结构鉴定的要求。浓缩后得到化合物6(2号峰)4 mg;化合物7(3号峰)6 mg;化合物8(4号峰)200 mg,经计算可得,化合物6的提取得率为4 mg/kg,化合物7的提取得率为6 mg/kg,化合物8的提取得率为200 mg/kg。
2.2 单体化合物的结构鉴定
本试验采用薄层显色、高清质谱和核磁共振法等方法,鉴定了从油茶叶中分离得到的4个化合物的结构,另外4个样品由于数量太少或不纯等原因未能得到鉴定。
2.2.1 化合物1结构解析
白色针状结晶,溶于甲醇、乙醇和丙酮,难溶于氯仿和水,三氯化铁反应呈紫色,提示结构为酚类化合物。HRESI-MS(Positive)给出m/z:231.102 4 [M+H]+,(Calcd for C14H14O3,231.101 6)。
在 1H-NMR 中,δ6.98(2H; m; 8.5 Hz) 与δ6.70(2H; m; 8.5 Hz)形成典型的对位取代苯的AA′BB′自旋系统;δ6.16(2H; d; 2.0 Hz)与δ6.12(1H;t; 2.0 Hz)形成典型的1,2,4-三取代苯AX2的自旋系统。在13C-NMR中,δ37.93和39.46为亚甲基碳信号,其余均为苯环的不饱和碳信号。将碳谱和氢谱数据与文献[28]中报道的化合物2对照,基本一致,因此,可鉴定单体化合物为二氢白藜芦醇,结构式如图5所示。
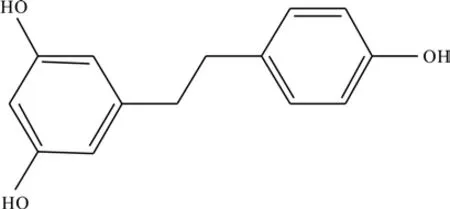
图5 二氢白藜芦醇的结构式Fig. 5 Structural formula of dihydroresveratrol
2.2.2 化合物3结构解析
黄色粉末,三氯化铁反应呈阳性,Mg-HCl反应呈阳性,提示为黄酮类化合物,EI-MS显示其分子离子峰m/z:303.0494[M+H]+,(Calcd for C15H10O7,303.0499)。
13C NMR(100 MHz,CD3OD)中,δ177.356(C-3),165.597(C-7),162.507(C-5),158.245(C-9),148.774(C-1),148.036(C-4'),146.227(C-3'),137.250(C-2),124.161(C-1'),121.689(C-6'),116.245(C-5'),116.051(C-2'),104.527(C-4),99.267(C-6),94.432(C-8);1H NMR(400 MHz, CD3OD)中δ7.7(1H, d, J=1.76 Hz, H-2'),δ7.6(1H, dd,J=8.4 Hz,H-6'),δ6.8(1H, d,J=8.5 Hz, H-5),δ6.3(1H, d,J=1.25 Hz, H-8),δ6.1(1H, d, J=1.51 Hz, H-6)。
综上所述,可以推断化合物3为槲皮素。
2.2.3 化合物6结构解析
黄色针状结晶(甲醇),溶于甲醇、乙醇和丙酮,难溶于氯仿和水,盐酸镁粉反应显阳性,三氧化铝反应呈黄绿色荧光,Molish反应呈阳性,提示结构为黄酮苷类化合物。ESI-MS(Positive)给 出m/z:449.108 5[M+H]+,m/z303.050 4[M-Rha+H]+,(Calcd for C21H20O11,449.107 8),显示化合物1是由槲皮素苷元和1个鼠李糖基组成。
在1H-NMR中,可见2个苯环间位质子信号δ6.20(1H, brs)和 δ6.36 (1H, brs)分别归属于 A 环的H-6和H-8;另有一组ABX偶合系统的芳香质子信号 δ6.92(1H, d,J= 8.2 Hz),δ7.31(1H, d,J=8.2 Hz)和 δ7.34(1H, s)分别归属于B 环的 H-5',H-6'和H-2';δ5.35(1H, brs)为鼠李糖的端基质子信号,δ0.95(1H, d,J=6.0 Hz)为鼠李糖的甲基质子信号。在13C-NMR中,可见一组鼠李糖基碳信号δ105.90,73.26,71.89,72.00,72.13,17.63。 将碳谱和氢谱数据与文献[22]中报道的化合物2以及文献[29]中报道的化合物10对照,基本一致,因此,可鉴定单体化合物为槲皮素3-O-α-L-鼠李糖,结构式如图6所示。
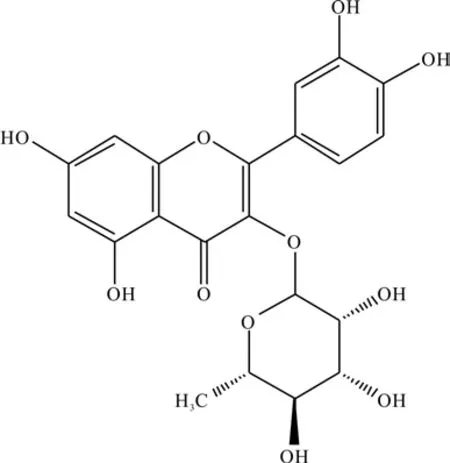
图6 槲皮素3-O-α-L-鼠李糖的结构式Fig. 6 Structural formula of quercetin 3-O-α-L-rhamnoside
2.2.4 化合物8结构解析
白色针状结晶,溶于甲醇、乙醇和丙酮,难溶于氯仿和水,Molish反应呈阳性,提示为糖苷类化合物。ESI-MS(Positive)给出m/z:531.223 1[M–2H2O+H]+,(Calcd for C28H38O12,531.223 5),m/z259.133 1 [M–Rha–Glc+H]+,显示单体是由 3,5-二甲氧基-4'-羟基-二苯乙烯和1个芸香糖组成的二氢白藜芦醇糖苷。
在1H-NMR中,δ7.15(2H; d; 8.5 Hz)与δ6.93(2H; d; 8.5 Hz)形成对位取代苯的AA′BB′自旋系统,δ6.38 (2H; d; 2.0 Hz)与 δ6.29(1H; t; 2.0Hz)形成1,2,4-三取代苯的AX2的自旋系统,δ3.68归属于2组等价的连氧甲基质子;δ4.75(1H, d,J=7.5 Hz)为葡萄糖基的端基质子信号,δ4.58 (1H, d,J=1.6 Hz)为鼠李糖基的端基质子信号,δ1.13(3H;d; 6.5 Hz)为鼠李糖基甲基质子信号。在13C-NMR中,可以观察到2组糖基碳信号,分别归属于葡萄糖基和鼠李糖基,δ55.48为连氧甲基碳信号。将碳谱和氢谱数据与文献[30]中报道的化合物3对照,基本一致。因此,可鉴定单体化合物为1-(3′,5′二甲氧基 )-苯基 -2-[4′-O-β-D-吡喃葡萄糖基(6→1)-O-α-L-吡喃鼠李糖基]-苯乙烷,结构式如图7所示。

图7 1-(3′,5′二甲氧基 )-苯基 -2 -[4′-O-β-D-吡喃葡萄糖基(6→1)-O-α-L-吡喃鼠李糖基]-苯乙烷的结构式Fig. 7 Structural formula of 1-(3′,5′-dimethoxy)-phenyl-2-[4′-O-β-D-glucopyranosyl (6→1)-O-α-L-rhamnopyranosyl]-phenylethane
3 结 论
高效液相色谱具有分离度高、灵敏度高、重复率好、分析快速等特点。高沸点不易挥发的、受热易分解的极性活性成分、有机和无机离子化合物等都可以利用高效液相进行分离制备,该方法所得的化合物纯度高。
对于油茶叶多酚化合物的深入研究,可以为油茶叶的利用打下理论基础。试验中对油茶叶提取物在大孔树脂和柱层析纯化分离的基础上,用液相色谱对3个组分的12个峰进行制备,得到了8个纯度90%以上的化合物。通过薄层显色、高清晰质谱和NMR,鉴定了其中4个化合物:二氢白藜芦醇、槲皮素、槲皮素-3-鼠李糖苷、1-(3′,5′-二甲氧基)苯基 2-[4′-O-β-D-吡喃葡萄糖基(6→1)-O-α-L-吡喃鼠李糖基]-苯乙烷,其余4个样品由于数量太少或者纯度不够未能得到鉴定。其中槲皮素和槲皮素-3-鼠李糖苷是油茶叶中常见的化合物,二氢白藜芦醇属于首次报道。
油茶树在幼龄期进行修剪整形及每年春末夏初间打叶产生的大量油茶叶,若能合理利用可以大大提高油茶的经济效益。总之,油茶资源的深入研究,可以产生显著的经济效益和社会意义。
[1]高 伟,何小三,孙 颖,等.不同采收方式对油茶油脂含量的影响[J].经济林研究,2013,31(4):177-181.
[2]朱 勇,王湘莹,马锦林,等.不同物种油茶籽仁含油率及其茶油的脂肪酸组成[J].经济林研究,2013,31(2):134-137.
[3]佘佳荣,晁 燕,谭利娟.基于气相色谱法的湖南油茶籽油掺杂判定[J].中南林业科技大学学报,2014,34(5): 88-91.
[4]曹永庆,姚小华,任华东,等.油茶果实矿质元素含量和油脂积累的相关性[J].中南林业科技大学学报,2013,33(10):38-41.
[5]师 江,刘兴勇.基于营养成分的变化确定油茶最佳采摘期[J].食品与机械,2014,30(1):71-74.
[6]李 好,钟海雁,方学智,等.油茶籽成熟过程中抗氧化物质的变化规律[J].食品与机械,2013,29(5):6-9.
[7]Du Li Chun, Li W B, Min C J. Flavonoid triglycosides from the seeds ofCamellia oleiferaAbel[J]. Chinese Chemical Letters,2008, 19(11): 1315-1318.
[8]陈虹霞,王成章,叶建中,等.油茶饼粕中黄酮苷类化合物的分离与结构鉴定[J].林产化学与工业,2011,31(1): 13-16.
[9]Chen Lin Yan, Chen Jing, Xu Han Hong. Sasanquasaponin fromCamellia oleiferaAbel induces cell cycle arrest and apoptosis in human breast cancer MCF-7 cells[J]. Fitoterapia, 2013, 84:123-129.
[10]Zhang X F, Han Y Y, Bao G H,et al. A New Saponin from Tea Seed Pomace (Camellia oleiferaAbel) and Its Protective Effect on PC12 Cells[J]. Molecules,2012,17(10):11721-11728.
[11]Feasus,M E L,C S. Triacylglyceride, antioxidant and antimicrobial features of virginCamellia oleifera,C reticulataandC sasanquaoils[J]. Molecules,2013,8(4):4573-4587.
[12]Lee C, Shih P, Hsu C,et al. Hepatoprotection of tea seed oil(Camellia oleiferaAbel) against CCl4-induced oxidative damage in rats[J]. Food and Chemical Toxicology,2007,45(6):888-895.
[13]Lee C,Yen G. Antioxidant Activity and Bioactive Compounds of Tea Seed (Camellia oleiferaAbel) Oil[J]. J Agric Food Chem,2006,54(3):779-784.
[14]刘应珍,邹天才.贵州山茶属植物资源及其开发利用探讨[J].贵州科学,2008,26(2):75-80.
[15]孙佩光,陈晓阳,奚如春,等.油茶种质资源评价研究进展[J].林业科技开发,2012,(3):1-6.
[16]侍银宝,钟海雁.油茶果皮多酚粗提物对DNA氧化损伤的影响[J].食品与机械,2013,2(6):143-146.
[17]Ye Y,Xing H T,Guo Y. Hypolipidemic effect of a novel biflavonoid from shells ofCamellia oleifera(Abel)[J]. Indian Journal of Experimental Biology,2013,51:458-463.
[18]Zhang L L,Wang Y M,Wu D M,et al. Comparisons of antioxidant activity and total phenolics ofCamellia oleiferaAbel fruit hull from different regions of China[J]. J Med Plants Res,2010,4(14):1420-1426.
[19]Zhang Liang Liang,Wang Yong Mei,Wu Dong Mei,et al.Microwave-assisted extraction of polyphenols fromCamellia oleiferafruit hull[J]. Molecules,2011,16(6):4428-4437.
[20]彭 凌,朱必凤. 油茶肉质果和肉质叶营养成分分析与评价[J].武汉植物学研究,2010,28(4):486-490.
[21]陈良秋,杨伟波,王兴胜,等.不同油茶品种幼苗叶片叶绿素含量比较[J].安徽农业科学,2010,38(22):12036-12037.
[22]张建良,裘爱泳. 油茶叶中油脂抗氧成分研究[J]. 无锡轻工业学院学报,1990,9(3):37-42.
[23]叶文峰,陈 新,刘秀娟,等.树叶中具有生理活性的黄酮类化合物研究进展[J].江西师范大学学报:自然科学版,2000,24(3): 278-282.
[24]Meng L, Liu R, Sun A,et al.Separation and purification of rutin and acaciin from the chinese medicinal herb Herba Cirsii by combination of macroporous absorption resin and highspeed counter-current chromatography[J]. J Chromatogr Sci,2009,47(5):329-332.
[25]Al-Dabbas M M, Al-Ismail K, Kitahara K,et al.The effects of different inorganic salts, buffer systems, and desalting of Varthemia crude water extract on DPPH radical scavenging activity[J]. Food Chemistry,2007,104(2):734-739.
[26]康少华,芦明春. 硅胶柱层析法分离大豆异黄酮苷元的研究[J].中国酿造,2009,(1):29-32.
[27]于世林. 高效液相色谱方法及其应用[M].第2版.北京:化学工业出版社,2005.
[28]Adesanya S A,Ogundana S K,Roberts M F. Dihydrostilbene phytoalexins fromDioscorea bulbiferaandD dumentorum[J].Phytochemistry,1989, 28(3):773-774.
[29]马丽媛,李 林,唐 玲,等. 油茶粕正丁醇组分水解产物化学成分的研究[J].时珍国医国药,2011,22(12):2868-2870.
[30]Chen Y L, Tang L, Feng B M,et al.New bibenzyl glycosides from leaves ofCamellia oleiferaAbel with cytotoxic activities[J].Fitoterapia,2011,82(3):481-484.
Compounds and structure identification in extracts fromCamellia oleiferaleaves by HPLC preparation
CAO Qing-minga,b, ZHONG Hai-yana,b, WU Jing-yub, BAO Li-yuanb, SUN Ya-juanb
(a.Key Laboratory of Cultivation and Protection for Non-Wood Forest Trees of Ministry of Education; b. College of Food Science and Engineering, Central South University of Forestry & Technology, Changsha 410004, Hunan, China)
In order to comprehensively develop and utilizeCamellia oleiferaresources, compounds in extracts fromC. oleiferaleaves were separated and identified. Three extracted parts of II, III and VIII fromC. oleiferaleaves were separated, purified and collected by using macroporous resin and column chromatography, and eight high-purity compounds were achieved by HPLC preparation. Four compounds were identified by methods of TLC colouring, high resolution LC-MS, and NMR, including dihydroresveratrol (1), quercetin (3), quercetin 3-O-β-D-rhamnoside (6) and 1-(3′, 5′-dimethoxy) phenyl-2-[4″-O-β-D-glucopyranosyl (6 → 1)-O-α-L-rhamnopyranosyl]phenylethane (8). Among the four compounds, the compounds 3 and 6 were very popular flavonoids inC. oleifera, and this was the second time that the compounds 8 was reported, but the extraction rate was higher than that in the first report. This was the first time that dihydroresveratrol was reported inCamellia.
liquid chromatography; preparation; high resolution mass spectrum; structure identification; nuclear magnetic
10.14067/j.cnki.1003-8981.2015.03.012 http: //qks.csuft.edu.cn
2015-05-11
国家自科科学基金项目“高抗氧活性油茶生物酚组分的结构表征及其作用机理研究”(31070612/C161103)。
曹清明,副教授,博士研究生。
钟海雁,教授。E-mail:zhonghaiyan631210@126.com
曹清明,钟海雁, 邬靖宇,等.液相制备油茶叶提取物组分及其结构鉴定[J].经济林研究,2015,33(3):68-74.
S609;S794.4
A
1003—8981(2015)03—0068—07
[本文编校:闻 丽]

