融合自组装双亲短肽提高碱性果胶酶热稳定性*
刘松,汪明星,堵国成,陈坚
1(工业生物技术教育部重点实验室,江苏无锡,214122)
2(江南大学生物工程学院,江苏无锡,214122)
碱性果胶酶(PGL,E.C.4.2.2.2)是一种在碱性环境下具有高活性的一类果胶裂解酶,可以通过反式消去作用切断聚乳糖醛酸的α-1,4-糖苷键并释放出不饱和的寡聚半乳糖醛酸[1]。基于其催化特性,PGL主要应用于纺织工业中的织物精炼过程。传统的精炼工艺是在高温强碱环境下去除织物中的果胶,该工艺能耗高,且废液对环境污染极大。在生物精炼工艺中,PGL可以高效去除织物中的果胶,节能减排效果明显[1]。此外,PGL还广泛应用于食品行业和造纸行业,如降解橄榄中的果胶提高出油率[2]、通过分解阴离子多糖果胶提高纸浆质量[3]。
复杂的应用环境如纺织精炼等对PGL在高温条件下的稳定性和催化活性提出了更高的要求[2]。目前主要通过菌株选育来获得高热稳定性的PGL,主要来源于地衣芽孢杆菌(Bacillus licheniformis)[4]、海栖热袍菌(Thermotoga maritima)[5]和部分芽孢杆菌[6]等。然而,已发现的耐热酶比酶活为9.9 ~35 U/mg[4-6],远不能满足应用需求。此外,由于缺乏野生菌PGL高效发酵策略,这些来源的热稳定PGL难以实现工业化生产。因此,提高已实现高产的重组PGL的热稳定性和催化活性,具有重要应用前景和现实意义。
近年来,基于蛋白质工程的方法已广泛用于酶催化性能的改造。然而,传统的蛋白质工程技术,如定点突变、随机突变和饱和突变等,高度依赖于酶分子晶体结构分析或建立高通量的突变体筛选平台[7]。这些局限性使得研究者难以在短时间内获得理想的酶突变体。作者在前期工作中,首次发现N-端融合酿酒酵母Zuotin蛋白[8]等来源的6种自组装双亲短肽(SAP),使脂肪氧合酶的55℃半衰期提高2.3~4.5倍,同时其比酶活亦显著提升[9]。该分子改造策略一个显著特点是,无需深入了解酶分子的结构信息和建立高通量筛选平台,较传统技术更高效。目前,这种融合SAP的分子改造技术已广泛应用于环糊精葡萄糖基转移酶[10]、腈水合酶[11]和碱性淀粉酶[12]等酶的热稳定性或催化活性改造。
在前期研究中,作者将Bacillus sp.WSHB04-02 PGL成功能表达于毕赤酵母,PGL产量达到1 593 U/mL[13]。为进一步提高酶的热稳定性,将6种SAP融合至Bacillus PGL的N-端,获得了热稳定性和比酶活均有提高的PGL。
1 材料与方法
1.1 实验材料
1.1.1 菌株
E.coli JM109,E.coli BL21(DE3),Bacillus sp.WSHB04-02和pET-22b(+)均为本实验保存。
1.1.2 主要试剂
限制性内切酶Nco I、Nde I和Xho I均购自Ther-mo公司,DNA定点突变试剂盒MutanBEST Kit、Primer star DNA聚合酶、胶回收试剂盒、DNA连接酶、感受态制备试剂盒和琼脂糖均购于TaKaRa公司。异丙基-β-D硫代半乳糖苷(IPTG)、质粒提取试剂盒与氨苄青霉素均购自生工生物工程(上海)股份有限公司;胰蛋白胨与酵母粉购自Oxoid公司;NuPAGE®Novex® Bis-Tris预制凝胶购自Life Technologies公司;考马斯亮蓝染色液G250/R250和标准分子质量蛋白均购自碧云天生物技术研究所;聚半乳糖醛酸(PGA)购自Sigma公司;其他常规试剂均为分析纯,都是进口分装或者国产。
1.1.3 培养基
LB培养基:酵母粉5 g/L,胰蛋白胨10 g/L,NaCl 10 g/L,pH 7.0。TB培养基:酵母粉24 g/L,胰蛋白胨12 g/L,甘油5 g/L,K2HPO472 mmol/L,KH2PO417 mmol/L,pH 7.0。
1.2 实验方法
1.2.1 PGL与SAP融合表达质粒的构建
6个SAP的编码基因由上海生工生物工程有限公司合成(表1),并分别在其5’端和3’端引入6×Histag和PT linker基因。将带有融合标签和PT linker的短肽DNA克隆至质粒pET-22b(+)的Nde I和Nco I位点之间,得到含SAP的表达质粒,pET-22b(+)/S1,pET-22b(+)/S2,pET-22b(+)/S3,pET-22b(+)/S4,pET-22b(+)/S5和pET-22b(+)/S6。利用引物P1和P2(表2)经PCR扩增得到的Bacillus sp.WSHB04-02 PGL基因,分别克隆至上述含SAP表达载体的Nco I和Xho I,得到PGL与SAP融合表达的载体。

表1 SAP氨基酸序列及结构特点Table 1 Amino acid sequences and characteristics of SAPs

表2 PGL基因扩增引物序列Table 2 Primer sequences for PGL gene amplification
1.2.2 重组菌发酵
重组质粒转化 E.coli BL21(DE3)得到表达PGL融合酶的重组菌。
种子培养:将重组菌接种于LB培养基(含100 μg/mL氨苄青霉素,2%葡萄糖),于37℃、200 r/min摇床上振荡培养10 h。
摇瓶发酵:种子液以体积分数3%的接种量接入TB培养基(100 μg/mL氨苄青霉素),于37℃、200 r/min培养至菌体浓度OD600=0.6,加入终浓度0.04 mmol/L IPTG于30℃下诱导48 h。
1.2.3 PGL的纯化
取发酵液于8 000 r/min离心10 min,获得含PGL的发酵上清液。将上清液置于冰上,缓慢加入硫酸铵粉末,至终质量分数为20.9%,离心收集上清液。将样品用0.25 μmol/L微孔滤膜过滤,所得样品用5 mL苯基疏水柱(HiTrapTMPhenyl FF,GE)进行纯化。柱纯化条件如下:用5~10倍柱体积的缓冲液A(20 mmol/L甘氨酸-氢氧化钠缓冲液,质量分数20.9%硫酸铵,pH 7.5)平衡疏水柱,之后以1 mL/min的流速进样;进样结束,用5个柱体积的A液继续冲平柱子;流速改为3 mL/min,分别以0~100%的洗脱缓冲液B(20 mmol/L甘氨酸-氢氧化钠缓冲液,pH 7.5)进行线性洗脱。取测得PGL酶活的洗脱液在20 mmol/L甘氨酸-氢氧化钠缓冲液(pH 7.5)中过夜透析,4℃保存。
1.2.4 PGL酶活测定
PGL酶活测定体系:含0.2%PGA的甘氨酸-NaOH 缓冲液(0.2 mol/L,0.44 mmol/L 的 CaCl2,pH 9.4)2 mL,待测样品20 μL,无活性的酶液为空白对照。PGL酶活测定条件:将反应体系置于45℃下水浴15 min,用3 mL磷酸溶液(0.03 mol/L)终止反应,在235 nm处测定吸光度值。PGL酶活单位定义:单位时间裂解PGA产生1 μmol/L不饱和PGA所用的酶量。计算方法如下:

式中:PGL酶活力单位为U/mL;b,比色皿厚度,cm;4 600,不饱和PGA于235 nm处的摩尔吸光系数,L/(mol·cm);t,酶促反应时间,min。
1.2.5 SDS-PAGE凝胶电泳分析
采用 Life Technologies公司预制胶 NuPAGE®Novex® Bis-Tris,具体操作方法见使用说明书。使用浓缩胶浓度为5%,分离胶浓度为12%,以0.1%考马斯亮蓝R-250进行染色。
1.2.6 蛋白浓度测定
采用碧云天的Bradford蛋白浓度测定试剂盒,具体操作详见使用说明书。基于纯酶的蛋白浓度和酶活,测定PGL及SAP-PGL融合酶的比酶活。
1.2.7 PGL最适反应温度与半衰期的测定
重组 PGL 及突变体在45、50、55、60、65 和 70 ℃进行酶催化反应,测PGL在不同温度条件下的酶活力,确定其最适反应温度。
重组PGL及突变体的热稳定性用55℃下酶活力半衰期(t1/2,min)来表示。将纯化后的PGL用20 mmol/L甘氨酸-氢氧化钠缓冲液(pH 7.5)稀释至100 μg/mL,并在55℃保温,间隔测定残余酶活,将残余酶活按照文献所述方式拟合并计算t1/2[14]。
1.2.8 PGL最适反应pH的测定
在不同pH下按照标准方法测定酶活力,以处理前酶活定为100%。按2.2.4所示方法,将反应pH调为8.6~10.6不等的5个梯度,30℃下保温24 h,测PGL在不同pH条件下的酶活力,考察其最适反应pH。
1.2.9 PGL催化动力学常数的测定
在0.05~2 g/L不等的PGA浓度下,按照2.2.4所示方法测定不同底物浓度下的酶活,并由Graph-Pad Prism 5计算得到Km和kcat。
1.2.10 PGL结构分析
利用PIC在线服务器(http://pic.mbu.iisc.ernet.in/index.html)计算SAP及SAP-PGL氢键作用、盐桥数量、疏水作用等。
2 结果与讨论
2.1 SAP-PGL融合酶的制备
SAP是一类由亲疏水性氨基酸残基交替排列而成的短肽,它能在特定条件下自发组装成有序的纳米结构。本研究选取了6种SAP用于制备SAP-PGL融合酶(表1)。其中,SAP-1和SAP-2分别源自Zuotin蛋 白[15]和 Carnobacterium maltaromaticum CP5[16],SAP-3、SAP-4、SAP5 和 SAP6 由 Lazar等设计[17]。为避免PGL主体结构受SAP的影响而丧失催化活性,本研究利用最常用的蛋白质linker—PT linker(PTPPTTPTPPTTPTPT)将SAP连接至Bacillus PGL的N-端,并在SAP的N-端融合亲合纯化标签His-tag以便进行亲和纯化(图1)。将构建得到的6种融合酶的表达质粒转化E.coli BL21(DE3)表达。SAP-1、SAP-2、SAP-3、SAP-4、SAP-5和 SAP-6 与 LOX 融合分别得到融合酶 S1-PGL、S2-PGL、S3-PGL、S4-PGL、S5-PGL和S6-PGL。

图1 SAP-LOX融合表达质粒的构建Fig.1 Construction of the SAP-PGL fusion plasmids
取含有融合酶的发酵上清液进行分离纯化。尽管融合酶N-端含有His-Tag,但是除S1-PGL之外的其他5种融合酶与Ni2+亲和层析柱的结合效率低,无法进行亲和纯化。这可能是由于5种融合酶的His-Tag被包埋于酶蛋白分子内部而无法与Ni2+亲和层析柱有效作用[9]。因此,采用苯基疏水柱对融合酶进行纯化。在线性洗脱条件下,天然酶PGL在30%~40%无盐缓冲液中被洗脱,而SAP-PGL融合酶则在50%~70%无盐缓冲液被洗脱。这些现象表明,PGL在融合SAP表面疏水度进一步增强。上述含酶的洗脱液经过夜透析得到电泳纯样品(图2)。

图2 SAP-PGL融合酶的SDS-PAGE蛋白电泳分析Fig.2 SDS-PAGE analysis of purified SAP-PGL fusions
2.2 融合SAP对PGL热稳定性的影响
为比较PGL与SAP-PGL的热稳定性,测定了纯化后的PGL及SAP-PGL融合酶55℃半衰期t1/2(表3)。结果显示,融合酶 S1-PGL、S2-PGL、S3-PGL、S4-PGL、S5-PGL 和 S6-PGL 分别较 PGL t1/2提高 16、43、72、15、23和9倍。其中,S3-PGL的55℃ t1/2达到21.53 h,表现出极高的热稳定性。同时,除S2-PGL之外,其他5种SAP-PGL的最适反应温度均较PGL提高5℃。目前,关于分子改造提高PGL热稳定性的报道较少。Xiao等[18]采用一种基于熔解温度导向型的序列比对(Melting-Temperature-Guided Sequence Alignment)的定点突变策略,得到的黄单胞菌(Xanthomonas campestris)PGL突变体R236F在45℃的t1/2达到21.25 h,较野生酶提高23倍。很显然,本研究得到S3-PGL较X.campestris PGL突变体R236F具有更高的热稳定性。上述结果表明,融合SAP能显著提高PGL的热稳定性。

表3 SAP-PGL融合酶的55℃半衰期与最适反应温度Table 3 The t1/2values of SAP-PGL fusions at 55℃
2.3 融合SAP对PGL催化活性的影响
为进一步分析融合SAP对PGL催化活性的影响,以PGA为底物测定了SAP-PGL融合酶的催化动力学常数和比酶活,结果如表4所示。与PGL相比,SAP-PGL融合酶的Km均略有提高,表明融合SAP降低了PGL与底物PGA的亲和力。S1-PGL、S2-PGL和S5-PGL的kcat较SAP提高超过50%,其他融合酶kcat增加不明显或有所下降。与SAP相比,S1-PGL的kcat/Km和比酶活分别提高3.52倍和2.56倍,表明融合SAP-1提高了PGL底物专一性和催化效率。然而,其余5种融合酶的kcat/Km和比酶活均显著下降。目前,从自然界筛选得到的高热稳定性PGL中,如B.licheniformis[4]、Bacillus sp strain P-4-N[6]和 T.maritime MSB8[5]等,比酶活仅为9.9 ~35 U/mg,严重制约了其应用价值。尽管Xiao等[18]通过分子改造提高了PGL的热稳定性,但其比酶活未见显著增长,仅为208 U/mg。本研究获得的S1-PGL t1/2(55℃)和比酶活分别达到6.16 h和458.52 U/mg,具有理想的应用性能。
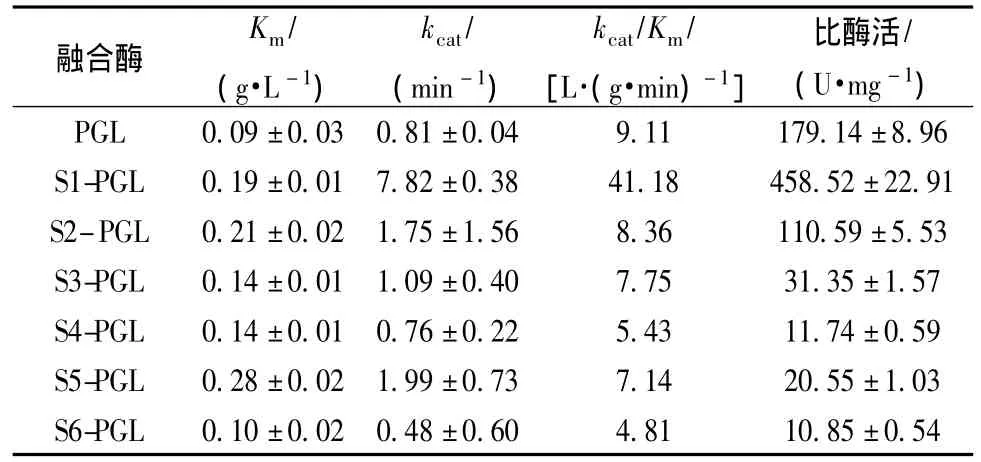
表4 突变体酶学常数Table 4 Kinetic constants of SAP-PGL fusions
2.4 融合SAP对PGL最适反应pH的影响
PGL主要用于织物前处理等碱性应用环境,故分析了SAP-PGL的最适反应pH。将突变体分别置于pH 9.0~10.6的4种缓冲液中,测定其反应活性。如图3所示,S1-PGL、S2-PGL和S3-PGL与PGL的最适反应pH一致,S4-PGL、S5-PGL和S6-PGL最适反应pH提升至10.6(图3)。因此,所有SAP-PGL融合酶最适反应pH均在碱性范围内,符合其工业应用环境要求。
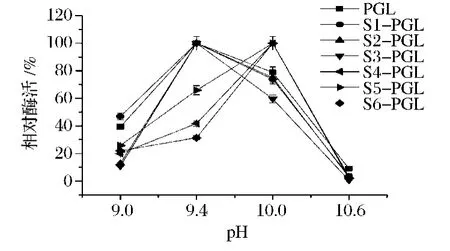
图3 pH对SAP-PGL催化活性的影响Fig.3 The effect of pH on the activities of SAP-PGL fusions
2.5 融合SAP提高PGL热稳定性和催化活性的机制
一般认为,短肽融合提高酶分子稳定性的机制主要有两种:分子局部刚性的增加[19]和酶分子的寡聚化作用[9]。Takano等发现 C-端短肽(IGCIILT)主要通过增加氢键、二硫键和疏水相互作用增强S.tokodaii RNase HI C-端刚性[19]。前期研究中,作者通过动态光散射分析观察到融合SAP使脂肪氧合酶的粒径增加,表明融合酶存在一定的寡聚化,而寡聚化是多亚基蛋白稳定化的重要方式[20]。在凝胶过滤色谱分析过程中,未能见到SAP-PGL多聚体分子的出现(结果未显示),表明SAP-PGL不是通过寡聚化作用来获得高热稳定性的。本研究利用PIC在线服务器分析了SAP-PGL融合酶分子内作用力变化(表5)。结果显示,除S6-PGL之外,各融合酶中的疏水相互作用有一定程度增加。此外,S1-PGL、S2-PGL、S5-PGL和S6-PGL分子中的氢键较PGL增加3个、3个、2和5个。因此,分子内作用的增加可能是SAP-PGL融合酶热稳定提高的重要原因。SAP-3、SAP-5和SAP-6是由不同linker连接两个相同SAP序列得到的短肽(表1),短肽柔性依次提高[9]。如表3所示,S3-PGL、S5-PGL和S6-PGL的热稳定性依次下降,表明高柔性的SAP不利于酶热稳定性的提高。
与PGL相比,仅有S1-PGL的比酶活显著提高,其他融合酶的比酶活则明显下降。融合短肽的长度可能是影响其催化活性的重要原因之一。如表1所示,双亲短肽SAP-1由16个氨基酸残基组成,而其他5条 SAP的氨基酸残基分别超过40个[9]。因此,SAP-1融合至PGL后可能形成的空间位阻相对较少,对底物和产物出入酶催化活性中心的影响较小,融合较长短肽则造成较大的影响。S1-PGL的kcat明显高于PGL及其他融合酶,而其Km并未在较水平。这表明S1-PGL比酶活的提高主要是由于底物转换数的增加。关于S1-PGL比酶活提高的机制还有待其晶体结构的解析。
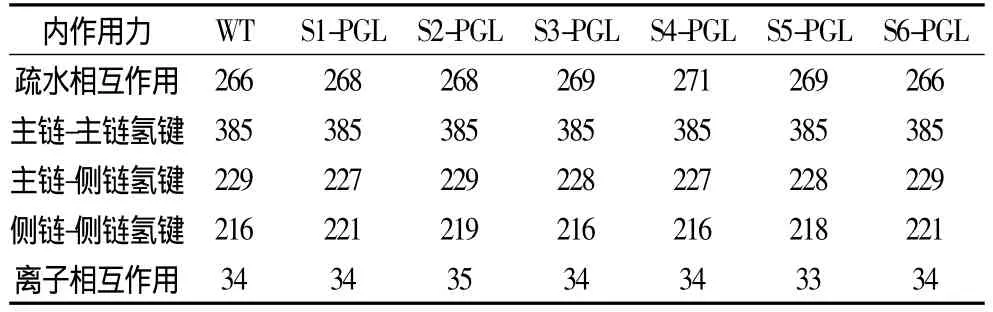
表5 PGL及其SAP-PGL融合酶分子内作用力分析Table 5 Interactions potentially involved in the stability of PGL and SAP-PGL fusions
3 结束语
关于 PGL高效生产已有大量报道,芽孢杆菌[21-22]和毕赤酵母[13]等是主要的生产菌株。然而,PGL应用性能(如热稳定性、催化活性等)优化方面的研究较少,对其应用的推广造成不利影响。为提高PGL热稳定性,本研究考察了N-端融合自组装双亲短肽(SAP)对PGL热稳定性的影响。将6种具有不同疏水性和柔性的SAP融合至Bacillus sp.WSHB04-02 PGL N-端,得到融合酶 S1-PGL、S2-PGL、S3-PGL、S4-PGL、S5-PGL和S6-PGL。与 PGL相比,融合酶的55℃半衰期(t1/2)提高9.69~72.03倍。其中,PGLS1比酶活达458.52 U/mL,较PGL提高1.5倍;其他融合酶比酶活则较PGL下降38.27% ~93.94%。上述结果表明,N-端融合SAP能有效提高PGL热稳定性和催化活性。本研究得到的具有高热稳定性和高催化活性S1-PGL具有突出的应用前景。然而,末端融合SAP提高酶分子稳定性的机制尚无明确结论和直接证据。在下一步工作中,将通过晶体结构解析揭示S1-PGL稳定化的分子机制,为基于融合SAP的酶分子改造策略的广泛应用奠定基础。
[1] WANG Y,WANG Z,DU G,et al.Enhancement of alkaline polygalacturonate lyase production in recombinant Pichia pastoris according to the ratio of methanol to cell concentration[J].Bioresource Technology,2009,100(3):1 343-1 349.
[2] Kashyap D R,Vohra P K,Chopra S,et al.Applications of pectinases in the commercial sector:a review[J].Bioresource Technology,2001,77(3):215-27.
[3] Reid I,Ricard M.Pectinase in papermaking:solving retention problems in mechanical pulps bleached with hydrogen peroxide[J].Enzyme and Microbial Technology,2000,26(2–4):115-123.
[4] Berensmeier S,Singh S A,Meens J,et al.Cloning of the pelA gene from Bacillus licheniformis 14A and biochemical characterization of recombinant,thermostable,high-alkaline pectate lyase[J].Applied Microbiology and Biotechnology,2004,64(4):560-567.
[5] Kluskens L D,van Alebeek G J W M,Voragen A G J,et al.Molecular and biochemical characterization of the thermoactive family 1 pectate lyase from the hyperthermophilic bacterium Thermotoga maritima[J].Biochemical Journal,2003,370(2):651-659.
[6] Hatada Y,Kobayashi T,Ito S.Enzymatic properties of the highly thermophilic and alkaline pectate lyase Pel-4B from alkaliphilic Bacillus sp strain P-4-N and the entire nucleotide and amino acid sequences[J].Extremophiles,2001,5(2):127-133.
[7] Bommarius A S,Blum J K,Abrahamson M J.Status of protein engineering for biocatalysts:how to design an industrially useful biocatalyst[J].Current Opinion in Chemical Biology,2011,15(2):194-200.
[8] ZHANG S,Lockshin C,Herbert A,et al.Zuotin,a putative Z-DNA binding protein in Saccharomyces cerevisiae[J].The EMBO Journal,1992,11(10):3 787.
[9] LU X Y,LIU S,ZHANG D X,et al.Enhanced thermal stability and specific activity of Pseudomonas aeruginosa lipoxygenase by fusing with self-assembling amphipathic peptides[J].Applied Microbiology and Biotechnology,2013,97(21):9 419-9 427.
[10] Han R,Li J,Shin H D,et al.Fusion of aelf-assembling amphipathic oligopeptides with cyclodextrin glycosyltransferase improves2-O-D-glucopyranosyl-L-ascorbic acid synthesis with soluble starch as the glycosyl donor[J].Applied and Environmental Microbiology,2014,80(15):4 717-4 724.
[11] LIU Y,CUI W,LIU Z,et al.Enhancement of thermo-stability and product tolerance of Pseudomonas putida nitrile hydratase by fusing with self-assembling peptide [J].Journal of Bioscience and Bioengineering,2014,118(3):249-252.
[12] YANG H,LU X,LIU L,et al.Fusion of an oligopeptide to the N terminus of an alkaline alpha-amylase from Alkalimonas amylolytica simultaneously improves the enzyme's catalytic efficiency,thermal stability,and resistance to oxidation[J].Applied and Environmental Microbiology,2013,79(9):3 049-3 058.
[13] WANG Z,WANG Y,ZHANG D,et al.Enhancement of cell viability and alkaline polygalacturonate lyase production by sorbitol co-feeding with methanol in Pichia pastoris fermentation[J].Bioresource Technology,2010,101(4):1 318-1 323.
[14] XU Z,LIU S,LU X,et al.Thermal inactivation of a recombinant lipoxygenase from Pseudomonas aeruginosa BBE in the absence and presence of additives[J].Journal of Agricultural and Food Chemistry,2014,94(9):1 753-1 757.
[15] ZHANG S,Lockshin C,Herbert A,et al.Zuotin,a putative Z-DNA binding protein in Saccharomyces cerevisiae[J].EMBO J,1992,11(10):3 787-3 796.
[16] Soliman W,Bhattacharjee S,Kaur K.Adsorption of an antimicrobial peptide on self-assembled monolayers by molecular dynamics simulation [J].Journal of Physical Chemistry B,2010,114(34):11 292-11 302.
[17] Lazar K L,Miller-Auer H,Getz G S,et al.Helix-turn-helix peptides that form alpha-helical fibrils:turn sequences drive fibril structure[J].Biochemistry,2005,44(38):12 681-12 689.
[18] XIAO Z H,Bergeron H,Grosse S,et al.Improvement of the thermostability and activity of a pectate lyase by single amino acid substitutions,using a strategy based on melting-temperature-guided sequence alignment[J].Applied and Environmental Microbiology,2008,74(4):1 183-1 189.
[19] Takano K,Okamoto T,Okada J,et al.Stabilization by fusion to the C-terminus of hyperthermophile Sulfolobus tokodaii RNase HI:a possibility of protein stabilization tag[J].PloS One,2011,6(1):e16226.
[20] Vieille C,Zeikus G J.Hyperthermophilic enzymes:sources,uses,and molecular mechanisms for thermostability[J].Microbiology and Molecular Biology Review,2001,65(1):1-43.
[21] LI G,RAO L,XUE Y,et al.Cloning,Expression,and characterization of a highly active alkaline pectate lyase from alkaliphilic Bacillus sp N16-5 [J].Journal of Microbiology and Biotechnology,2010,20(4):670-677.
[22] ZOU M,LI X,SHI W,et al.Improved production of alkaline polygalacturonate lyase by homologous overexpression pelA in Bacillus subtilis[J].Process Biochemistry,2013,48(8):1 143-1 150.

