龙眼胚性愈伤组织中TFL1基因克隆及其表达分析
陈裕坤,林玉玲,赖钟雄
(福建农林大学园艺植物生物工程研究所,福建福州350002)
TFL1(TERMINAL FLOWER 1)是花序分生组织特异基因[1],与 FT(FLOWERING LOCUS T)、MFT(MOTHER OF FT AND TFL1)构成FT/TFL1基因家族的3个亚家族,具有保守的磷脂酰乙醇胺结合域(PEBP结构域)[2-3]。TFL1是开花抑制基因[4],拟南芥tfl1突变体的开花时间提早,花序分生组织转变为花分生组织,在顶端开花[5];超量表达TFL1基因导致拟南芥营养生长和花序生长都延长,开花时间推迟[6]。Wigge等[7]研究表明,TFL1基因通过营养生长阶段低水平表达延长植物的营养生长,通过在花序分生组织中大量表达来维持花序的无限生长,从而抑制花分生组织特异基因的表达,最终导致植物开花时间延迟。在多年生的高山南芥中,TFL1阻止幼年植株感受低温春化[8];TFL1在柑橘中调控童期性状[9];促使将梨的PcTFL1-1和PcTFL1-2基因经RNAi干扰后所获得的转基因植株开花提早[10];将苹果的TFL1基因干扰后,其童期明显缩短[11],说明TFL1基因在多年生植物中与维持童期性状有关。
TFL1作为重要的开花抑制基因,在龙眼的研究中未见报道。近年来,福建农林大学园艺植物生物工程研究所实验室对龙眼体胚发生过程开展相关的分子生物学研究,建立了龙眼胚性愈伤组织转录组数据库[12],对龙眼体胚发生过程中的miRNAs进行了鉴定[13]。该研究在这些基础上,克隆了龙眼胚性愈伤组中TFL1的cDNA全长和gDNA序列,借助生物信息学方法初步推测DlTFL1的功能,预测调控DlTFL1的潜在miRNAs,并研究其在“四季蜜”龙眼不同组织部位中的表达模式,为进一步研究DlTFL1在龙眼成花表达调控和开花中的作用机理提供理论依据。
1 材料与方法
1.1 供试材料
龙眼松散型胚性愈伤组织(“红核子”品种LC2细胞系),由赖钟雄于1994年诱导并由福建农林大学园艺植物生物工程研究所长期进行继代保存[14-16]。龙眼胚性愈伤组织的转录组由福建农林大学园艺植物生物工程研究所提供,SRR accession numbers:SRA050205。“四季蜜”品种龙眼不同组织部材料采自莆田农业科学研究所。
1.2 方法
1.2.1 DNA和RNA提取与cDNA合成。松散形胚性愈伤组织总DNA的提取参考王凤华等[17]的方法。参照林玉玲等[18]、赖呈纯等[19]和李惠华等[20]的方法,提取龙眼胚性愈伤组织和“四季蜜”龙眼不同组织部位的总RNA,用于合成RT-PCR扩增和qPCR扩增的cDNA。
1.2.2 引物设计及PCR扩增
(1)转录组中已知序列扩增 将福建农林大学园艺植物生物工程研究所实验室龙眼转录组数据库中注释为TFL1的Unigene序列,经GenBank数据库比对分析后,采用DNAMAN7.0分别设计其上下游引物,以龙眼松散型胚性愈伤组织cDNA为模板扩增TFL1的部分序列。
(2)3′-RACE 和 5′-RACE 引物设计 采用RACE法,根据转录组分析所得的序列分别设计2条3′-RACE 引 物 , 结 合 GeneRacerTM3′Primer和GeneRacerTM3′Nested Primer引物,以龙眼松散型胚性愈伤组织cDNA为模板,进行巢式PCR反应扩增3′末端序列;根据转录组分析所获得序列分别设计2条 5′-RACE 引物,并结合 GeneRacerTM5′Primer和GeneRacerTM5′Neste Primer引物,以龙眼松散型胚性愈伤组织cDNA为模板,进行巢式PCR反应扩增5′末端序列。
(3)拼接验证与gDNA扩增 对转录组分析所得序列、3′末端序列和5′末端序列的测序结果进行全长拼接,设计拼接验证引物,PCR反应验证拼接结果。同时利用拼接验证的引物,以龙眼胚性愈伤组织DNA为模板,PCR扩增获得其gDNA序列。所有的引物序列及扩增用途见表1。
PCR反应体系和扩增程序参照赖呈纯等[19]的方法,根据扩增不同的目的片段,对PCR扩增程序进行相应的调整。获得目的片段后切胶回收,TA克隆后进行PCR检测,并送深圳华大基因公司测序。
1.2.3 生物信息学分析。使用DNAMAN7.0进行核苷酸序列的拼接以及氨基酸序列的多重比对;采用Gene Structure Display Server进行基因组序列分析;使用ExPASy Protparam在线软件预测DlMFT和DlTFL1的理化性质;信号肽预测软件为SignalP 4.0 Server;亚细胞定位预测采用 PSORTPrediction(plant);EMBnet TMpred预测蛋白质跨膜结构;NetPhos2.0预测蛋白质磷酸化位点;PredictProtein预测蛋白质的其他功能位点;经NCBI Blastp预测蛋白质的功能保守结构域,以PSIPRED预测蛋白质二级结构,Phyre2预测蛋白质三级结构;采用Mega6.06的Neighbor-Joining(邻近相连法)构建核苷酸序列的分子系统进化树(P-distance法),并用bootstrap法(重复1 000次)评估系统进化树。
1.2.4 潜在调控DlTFL1基因的miRNA预测。为了解miRNA与DlTFL1的相互调控关系,以林玉玲等[13]新鉴定的龙眼中保守或特异的miRNA序列为探针,以龙眼DlTFL1为靶基因预测的候选序列,采用psRNA Target在线软件,预测可能参与调控DlTFL1基因表达的miRNA。

表1 基因克隆引物序列
1.2.5 DlTFL1在“四季蜜”龙眼不同组织部位中的表达分析。参照林玉玲等[18]建立的多基因内参体系,以检测DlTFL1在“四季蜜”龙眼的根、叶、花蕾、花、小果、大果、果肉、果皮和种子中的表达情况。该试验采用LightCycler480仪器和Takara SYBR ExScriptTM试剂,根据qPCR引物设计原则设计DlTFL1的上下游引物(表1),将龙眼的9个不同组织部位(根、成熟叶、花蕾、花、小果、大果、果肉、果皮和种子)的cDNA模板的混合样进行5倍梯度系列稀释制作标准曲线,通过软件自动分析qPCR的扩增效率(E),E=10(-1/slope)。将 9个不同组织部位的cDNA稀释15倍后作为模板进行qPCR扩增,qPCR反应体系和扩增程序参照林玉玲等[18]。每个反应设置3个重复,根据扩增曲线计算Ct值,获得不同阶段DlTFL1的mRNA相对含量,通过内参基因的校正最终得到DlTFL1的在“四季蜜”龙眼不同组织部位的相对表达量。
2 结果与分析
2.1 龙眼胚性愈伤组织DlTFL1 cDNA全长序列及gDNA序列获得与分析
将龙眼转录组数据[13]中注释为TFL1的核苷酸序列(Unigene52977)及其推导的氨基酸序列分别在NCBI上经Blastn和Blastp分析,与数据库中TFL1的核苷酸和氨基酸序列具有较高的同源性,初步推断该片段为龙眼胚性愈伤组织中DlTFL1的部分cDNA序列。
根据龙眼转录组序列,分别设计3′-RACE和5′-RACE引物,采用RACE法扩增DlTFL1的3′末端和5′末端序列,经二轮PCR后均可扩增出与预期相符的片段。测序结果表明,DlTFL1的5′-RACE片段大小为308 bp,3′-RACE片段大小为458 bp。经DNAMAN7.0拼接,DlTFL1的cDNA全长为866 bp;采用RT-PCR法对拼接结果进行验证,测序结果表明DlTFL1的序列长为838 bp(图1),与拼接结果相符合,GenBank登录号为KJ200346。核苷酸序列分析结果表明,DlTFL1 cDNA全长866 bp,开放阅读框为528 bp,编码175个氨基酸,5′-UTR为69 bp,3′-UTR为269 bp,终止密码子为TGA,PolyA尾巴为24 bp,具有典型的PolyA加尾信号“AATAAA”。将所获得的全长序列及其推导的氨基酸序列经Blastn和Blastp分析发现,与黑杨、毛果杨、小油桐、桃、葡萄、甜橙等的核苷酸与氨基酸序列的同源性较高,均在77%~83%,2个关键位点His88和Asp144均很保守。
采用与拼接验证相同的引物扩增DlTFL1的gDNA序列,获得与预期相符合的目的片段,经测序验证表明DlTFL1的gDNA序列长为1 492 bp(图1),GenBank登录号为KJ480957。序列分析结果表明,DlTFL1的gDNA序列的由4个外显子和3个内含子组成(图2)。
2.2 龙眼胚性愈伤组织DlTFL1生物信息学分析

图1 DlTFL1的PCR扩增

图2 DlTFL1的gDNA序列
利用ExPASy Protparam预测DlTFL1的理化性质,其分子式为C900H1394N244O255S6,分子量为19 904.8 kD,等电点7.89,含21个带正电氨基酸和20个带负电氨基酸,不稳定系数为39.44,总亲水性值为-0.271,因此DlTFL1为稳定的亲水蛋白。SignalP4.0 Server和EMBnet TMpred软件预测DlTFL1没有信号肽和跨膜结构。经PSORT Prediction亚细胞定位预测可知DlTFL1定位在细胞质中。根据NetPhos 2.0预测,DlTFL1含有 12个蛋白磷酸化位点(Ser:5,Thr:4,Tyr:3);经 PredictProtein 预测其他功能位点可知,DlTFL1有1个PEBP家族信号,1个cAMP与cGMP依赖性蛋白激酶磷酸化位点、3个蛋白激酶C磷酸化位点、1个酪蛋白激酶II磷酸化位点、1个酪氨酸激酶磷酸化位点、1个N-端酰基化位点。Introprotein预测表明DlTFL1含有PEBP家族的保守结构域。

图3 DlTFL1二级结构
采用PSIPRED在线软件预测蛋白质的二级结构,DlTFL1主要由无规则卷曲和α-螺旋组成(图3),其中α-螺旋9.1%、β-折叠32%、无规则卷曲58.9%。采用Phyre2在线软件,以PEBP-like超家族的d1qoua(覆盖率>90%,可信度100%)为模板建立DlTFL1的三级结构模型(图4)。

图4 DlTFL1三级结构
2.3 植物TFL 1氨基酸序列多重比对与进化树分析
为研究植物TFL1家族的关系,根据NCBI数据库中麻风树(Jatropha curcas)、毛果杨(Populus trichocarpa)、拟南芥 (Arabidopsis thaliana)、大豆(Glycine max)、甜橙(Citrus sinensis)和葡萄(Vitis vinifera)等20种植物的TFL1氨基酸序列,利用Mega6.06软件的邻近相邻法(NJ法)构建TFL1的系统进化树(图5),结果表明龙眼TFL1与麻风树、葡萄、毛果杨和棉花等TFL1具有较近的亲缘关系。
2.4 调控DlTFL1的m iRNA预测
psRNA Target预测结果(表2)表明,龙眼DlTFL1可能受到dlo-miR1114/2936/2948/4352/774这5种miRNA的调控,其中miR1114/2948/774以抑制靶标基因的翻译方式调控DlTFL1的表达,而miR2936/4352以裂解mRNA的方式抑制靶标基因的表达。
2.5 DlTFL1的在“四季蜜”龙眼不同组织部位的表达分析

图5 植物TFL1进化树分析
qPCR结果表明,DlTFL1在“四季蜜”龙眼不同组织部位中mRNA的表达水平存在着明显差异,其中在花蕾中的表达量最高,在根、叶和成花中的表达量较低,而在小果、大果、果肉、果皮和种子中甚至不表达(图6)。说明在“四季蜜”龙眼的不同组织部位中,DlTFL1的转录水平呈现出了明显的组织特异性和时空差异,在花蕾中的大量表达说明DlTFL1可能对“四季蜜”龙眼的花早期的器官发育有促进作用,在开花阶段的表达量较低,对龙眼的开花可能具有抑制作用。
3 讨论
3.1 DlTFL1是植物TFL1同源基因,可能具有抑制开花的功能
植物茎端和花序分生组织特性由2套互补的基因维持,花分生组织特异基因LEAFY、AP1等对花起启动作用,而TFL1通过抑制LFY、AP1、CAL的表达延长营养生长,从而抑制成花转变[21-22]。该研究从“红核子”龙眼胚性愈伤组织中克隆了DlTFL1的cDNA全长序列和gDNA序列,DlTFL1的核苷酸及其推导的氨基酸序列与黑杨、毛果杨、小油桐、桃、葡萄、甜橙等的核苷酸与氨基酸同源性较高,2个关键位点His88和Asp144均很保守,具有保守的PEBP结构域;gDNA序列与其他植物相同,含有4个外显子和3个内含子;DlTFL1可能还受到miRNA的调控。序列分析和系统进化树分析证明DlTFL1是植物TFL1同源基因,可能具有类似的抑制植物开花的功能。
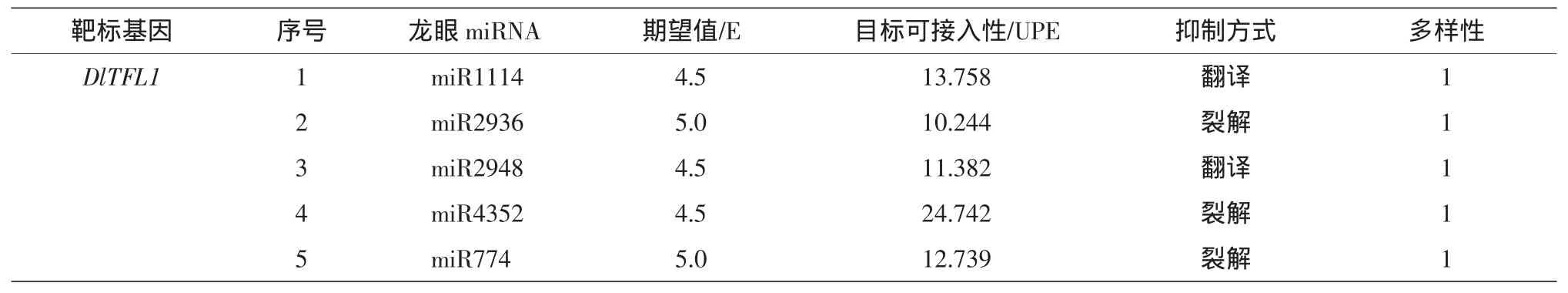
表 2 潜在调控DlTFL1的m iRNAs

图6 DlTFL1在“四季蜜”龙眼不同组织部位的相对表达量
3.2 DlTFL1对龙眼花器官的发育可能具有促进作用
TFL1基因在营养生长和花序生长阶段的顶端分生组织中表达,以维持茎端和花序分生组织的无限性,从而调控营养和生殖生长的进程[1,5]。TFL1蛋白是一种可移动的信号,均匀分布在分生组织中,但无法进入分生组织侧面细胞从而保证原基细胞维持自己的特性[23]。李超琼和罗莉等[24-25]的研究表明,小油桐 JcTFL1a、JcTFL1c(JcTFL3)主要在其童期和未开花植物的根部表达,其他组织中几乎没有表达;JcTFL1b主要在成年期植株的茎和幼果中表达,而过表达JcTFL1b(JcTFL2)拟南芥表现出晚花的性状。该研究中DlTFL1在花蕾中的表达量最高,在根、成熟叶和成花中的表达量相对较低,而在其他组织部位中没有表达。说明DlTFL1可能与“四季蜜”龙眼花早期的发育有关,同时还可能具有抑制龙眼开花的功能。关于DlTFL1的具体功能研究还有待进行亚细胞定位、基因功能验证等,以进一步探讨DlTFL1在龙眼花期调控与花发育等过程中的作用。
[1]SHANNON S,MEEKS-WAGNER D R.A mutation in the Arabidopsis TFL1 gene affects inflorescence meristem development[J].The Plant Cell,1991,3:877-892.
[2]孙洪波,贾贞,韩天富.PEBP家族基因在植物发育调控中的作用[J].植物生理学通讯,2009,45(8):739-747.
[3]常丽丽,吴连城,库丽霞,等.植物FLOWERING LOCUS T/TERMINAL FLOWER1基因家族的研究进展[J].西北植物学报,2008,28(4):843-851.
[4]SHANNON S,MEEKS-WAGNER D R.Genetic interactions that regulate inflorescence development in Arabidopsis[J].The Plant cell,1993,5(6):639-655.
[5]BRADLEY D,RATELIFFE O,VINEENT C.Inflorescence commitment and architecture in Arabidopsis[J].Science,1997,275:80-83.
[6]RATCLIFFE O J,AMAYA I,VINCENT C A,et al.A common mechanism controls the life cycle and architecture of plants[J].Development,1998,125(9):1609-1615.
[7]WIGGE P A,KIM M C,JAEGER K E,et al.Integration of spatial and temporal information during floral induction in Arabidopsis[J].Science,2005,309(5737):1056-1059.
[8]WANG R,ALBANI M C,VINCENT C,et al.A TFL1 confers an age-dependent response to vernalization in perennial Arabis alpina[J].The Plant Cell,2011,23(4):1307-1321.
[9]PILLITTERI L J,LOVATT C J,WALLING L L.Isolation and characterization of a TERMINAL FLOWER homolog and its correlation with juvenility in citrus[J].Plant Physiology,2004,135(3):1540-1551.
[10]FREIMAN A,SHLIZERMAN L,GOLOBOVITCH S,et al.Development of a transgenic early Xowering pear(Pyrus communis L.)genotype by RNAi silencing of PcTFL1-1 and PcTFL1-2[J].Planta,2012,235(6):1239-1251.
[11]GYLLENSTRAND N,CLAPHAM D,KÄLLMAN T,et al.A Norway spruce FLOWERING LOCUS T homolog is implicated in control of growth rhythm in conifers[J].Plant Physiology,2007,144:248-257.
[12]LAI Z,LIN Y.Analysis of the global transcriptome of longan(Dimocarpus longan Lour.)embryogenic callus using Illumina paired-end sequencing[J].BMC Genomics,2013,14:561.doi:10.1186/1471-2164-14-561.
[13]LIN Y,LAI Z.Comparative analysis reveals dynamic changes in miRNAs and their targets and expression during somatic embryogenesis in longan(Dimocarpus longan Lour.)[J].PLoS ONE,2013,8(4):e60337.doi:10.1371/journal.pone.0060337.
[14]LAI Z X,CHEN C L,ZENG L H,et al.Somatic embryogenesis in longan(Dimocarpus longan Lour.)[J].Forestry Sciences,2000,67:415-432.
[15]赖钟雄,潘良镇,陈振光.龙眼胚性细胞系的建立与保持[J].福建农业大学学报,1997,26(2):160-167.
[16]赖钟雄,陈振光.龙眼胚性愈伤组织的高频率体细胞胚胎发生[J].福建农业大学学报,1997,26(3):271-276.
[17]王凤华,赖钟雄,郑金贵,等.龙眼胚性愈伤组织体胚发生的同步化调控及其DNA与RNA的提取方法[J].热带作物学报,2003,24(3):33-37.
[18]LIN Y L,LAI Z X.Reference genes selection for qPCR analysis during somatic embryogenesis in longan tree[J].Plant Science,2010,178(4):359-365.
[19]赖呈纯,赖钟雄,方智振,等.龙眼胚性愈伤组织线粒体ATP合酶β亚基基因克隆及其在龙眼体胚发生过程中的表达分析[J].中国农业科学,2010,43(16):3392-3401.
[20]李惠华,赖钟雄,林玉玲,等.龙眼胚性愈伤组织ACC氧化酶基因的克隆及其在龙眼体胚发生过程中的表达分析[J].中国农业科学,2010,43(18):3798-3808.
[21]ALVAREZ J,GULI C L,YU X H,et al.Terminal flower:a gene affecting inflorescence development in Arabidopsis thaliana[J].The Plant Journal,1992,2(1):103-116.
[22]RATCLIFFE O J,AMAYA I,Vincent C A,et al.A common mechanism controls the life cycle and architecture of plants[J].Development,1998,125:1609-1615.
[23]CONTI L,BRADLEY D.TERMINAL FLOWER1 is a mobile signal controlling Arabidopsis architecture[J].The Plant Cell,2007,19(3):767-778.
[24]罗莉.小油桐开花控制基因FT/TFL1的克隆及功能初步分析[D].广州:中山大学,2010.
[25]CHAO Q L,LI L,QIAN T F,et al.Identification and characterization of the FT/TFL1 gene family in the biofuel plant Jatropha curcas[J].Plant Molecular Biology Reporter,2014,doi:10.1007/s11105-014-0747-8.

