纳米金颗粒在靶向放射治疗中的应用
刘蒙蒙 王 坤 陈 楠 王丽华
(中国科学院上海应用物理研究所 嘉定园区 中国科学院界面物理与技术重点实验室上海同步辐射光源物理生物与生物成像中心 上海 201800)
纳米金颗粒在靶向放射治疗中的应用
刘蒙蒙 王 坤 陈 楠 王丽华
(中国科学院上海应用物理研究所 嘉定园区 中国科学院界面物理与技术重点实验室上海同步辐射光源物理生物与生物成像中心 上海 201800)
放射治疗是生物医学中治疗恶性肿瘤的一种重要手段。放射治疗采用高剂量、高穿透性的X射线、γ射线以及电子光子束辐照癌变的肿瘤细胞,通过破坏其脱氧核糖核酸(Deoxyribonucleic acid, DNA)而将其杀死或破坏。但是,较高的放射剂量和较长的治疗时间会对生命体产生极大的生物毒性。为降低放射治疗的生物毒性,减弱放射治疗带来的副作用,靶向放射治疗成为放射治疗研究的热点。纳米金颗粒具备优异的辐射敏化性质和光学性质,同时兼具良好的生物相容性,因此纳米金协助的放射治疗迅速成为靶向治疗的重要发展方向。在体外以及前临床试验中,基于纳米金的多功能纳米体系,有效提高了肿瘤治愈率、降低了毒副作用并延长了病人的存活时间。本文总结了在靶向治疗中多功能纳米金体系的设计思路,重点综述了纳米金体系在体外实验及前临床实验中实际应用效果,并对其发展方向进行了展望。
放射治疗,纳米金颗粒,肿瘤
自1895年Rontgen[1]发现X射线、居里夫人发现放射性元素Ra[2]后,放射线很快就被应用于治疗癌症等恶性疾病。放射治疗的射线照射细胞后,会直接作用于胞内细胞核引发脱氧核糖核酸(Deoxyribonucleic acid, DNA)损失,或通过电离细胞内水产生自由基间接造成DNA损失,从而消灭肿瘤细胞。放射治疗获得了巨大的成功,但是大量的癌症病人仍然无法避免放射治疗后的癌症复发、转移以及严重的副作用。例如,在前列腺癌的治疗中,50%的病人在放射治疗后5年内会发生生化指数异常,而这些异常通常会导致癌症的复发[3]。因此,开发低毒性、靶向性治疗方法是放射治疗的发展方向。纳米材料尤其是纳米金材料可以靶向地标记到肿瘤组织,并特异性地在肿瘤组织累积和提高放射治疗效率,成为纳米材料协助靶向放射治疗的新方向。
金元素具有较大的原子序数(Z=79),使得纳米金颗粒吸收放射能量的能力是周围软组织的1000倍,而后发生光电效应,发射出光电流,其产生的光电流穿透深度约为100μm,增强放射性射线对深层癌症细胞的杀伤作用[4],从而可以有效地增强放射治疗的效果,尤其是在深表肿瘤的治疗中。更重要的是纳米金具有非常优良的光学性质,它可以同入射波长与其尺寸相当的入射光发生局部表面等离子共振(Local Surface Plasmon Resonance, LSPR),一方面增强纳米金周边的电磁场,产生强烈的亮点,可应用于成像;另一方面将入射能量转化为热量,大幅提高纳米金周边的局部温度,可以应用于光热治疗来辅助放射治疗。同时,纳米金颗粒具有较好的生物相容性、较低的生物毒性以及很强的表面吸附载带能力,可修饰大量的目标分子、药物分子以及成像造影剂等功能分子。因此,发展基于纳米金颗粒的多功能探针成为靶向放射治疗的重要研究方向。本文主要从三个方面介绍纳米金颗粒在放射治疗中的应用:多功能纳米金探针的设计、影响因素以及设计成型的探针;多功能纳米金体系在体外实验、前临床实验的表现,以及在传统放射治疗中可能的应用;基于纳米金的靶向放射治疗未来的发展方向以及可能遇到的困难。
1 用于放射治疗的纳米探针的设计
纳米金颗粒是近年发展起来的新型纳米材料。在肿瘤放射治疗领域,纳米金颗粒具有无可比拟的优势:粒径合适的纳米金颗粒可以通过渗透滞留增强效应(Enhance Permeability and Retention Effect, EPR)积累在结构松散、血管发达的肿瘤位置,从而达到靶向目标[5]。表面修饰配体的纳米金颗粒可以通过配体-受体的特异性结合,直接靶向到癌症细胞表面,降低生物毒性[6]。利用某些化学键的光敏性,光控在深表肿瘤位置释放药物[7]。因此,适用于放射治疗的纳米金探针的设计主要考虑尺寸、形状、表面性质等对其的影响(图1)[8]。
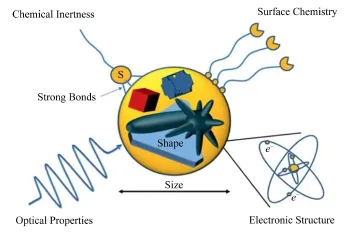
图1 纳米金主要的特性以及其对于尺寸、形状的依赖[6]e-:纳米金内部的电荷,S:连接纳米金的巯基基团Fig.1 The properties of Au nanoparticles and theirdependence on particle size and shape[6].e-: Electrons in the gold atoms of the nanoparticle, S: Sulfur atoms in thiols
1.1尺寸影响
纳米金尺寸不同,其理化性质也不同,对于肿瘤细胞的影响重大。一般尺寸较小的颗粒表面曲率较大,表面可以吸附的配体分子数较少,同时成像背景较低,但是其分散性非常好。尺寸大的颗粒易于发生聚集,不易分散[9]。纳米金尺寸的变化可以影响纳米金在肿瘤位置的累积、扩散、摄取等过程[10-13]。
Ferrari组[10]发现纳米金颗粒的尺寸对其与肿瘤毛细血管相互作用影响显著,之后其它课题组进一步研究尺寸的影响作用,并发现尺寸小于6nm的纳米金颗粒在注射后几分钟内会被清除,而较大尺寸的纳米金颗粒则会在网状内皮组织积累[10]。此外,Perrault组[11]经过详细的实验,发现在种植了MDA-MB-435 肿瘤的裸鼠体内,直径为100nm的纳米金颗粒在肿瘤区域的积累效率最好,效率是直径60-80nm纳米颗粒的4.3倍和直径20nm纳米颗粒的9倍。
尺寸的大小不仅会影响纳米金在肿瘤体内的积累,也会显著影响纳米金在肿瘤组织内的扩散。Perrault组[11]发现小颗粒的纳米金可以在肿瘤内快速地扩散,而大尺寸的纳米金(约100nm)则局限在血管周边,Wong组[12]发现尺寸不一的纳米金通过肿瘤组织后,平均尺寸降低到10nm。此外,Huang组[13]表明尺寸小于10nm纳米金具有更精确的定位能力和和更强的渗透能力。
纳米金的尺寸同样影响其细胞摄取率。Chithrani[14]研究哺乳动物细胞对纳米金颗粒的摄取效率,发现纳米金颗粒的动力学以及摄取饱和浓度与纳米金颗粒的物理维度高度相关。在2-100nm尺寸内,50nm的纳米金颗粒具有最高的摄取效率。较大尺寸的纳米金倾向于在癌症位置积累,小尺寸的纳米金则倾向于在癌症组织内扩散,而中等尺寸的纳米金则倾向于被癌症细胞摄取。
1.2形状影响
纳米金颗粒的形貌对于其与肿瘤毛细血管相互作用也有明显的影响。目前常用的纳米金结构有纳米金球、纳米金棒、纳米金笼等。在不同的纳米金颗粒形状中,球形纳米金颗粒相较于其他形状的纳米金颗粒具有更高的摄取效率。例如球形的纳米金颗粒摄取效率是柱状纳米金颗粒的5倍。这主要是因为颗粒表面的曲率不同,使得其与细胞的接触面积不同,从而影响其摄取效率[14]。纳米金棒有两个共振峰,波长较长的共振峰在700-800nm,对红外光有明显的吸收,可以更好地应用于光热治疗[15]。而纳米金笼结构具有更大的比表面积,可以载带更多的药物分子,在载带体系中获得很好的应用[16]。
1.3表面性质
为提高纳米金颗粒的放射治疗效率,在设计纳米金颗粒探针时,需要尽量提高纳米金在肿瘤细胞位置处的分布率,降低在健康组织内的积累。为控制纳米颗粒在癌症位置的累积、扩散以及摄取,我们在纳米金颗粒探针上修饰不同的纳米药物。第一代纳米药物是通过简单地修饰纳米金颗粒表面,来提高摄取效率以及降低细胞毒性[17]。第二代纳米药物是通过在表面修饰特异性的配体,使其可以与癌症细胞表面受体特异性结合,从而特异地靶向癌症细胞表面。例如,Choi组[6]在纳米金表面修饰转铁蛋白,利用转铁蛋白与癌症细胞表面受体特异性结合,将纳米金特异性地积累到癌症细胞表面,从而提高纳米金的靶向效率。
第三代纳米药物是在纳米金表面进行更加复杂的修饰,形成一个具有生物追踪以及给药反馈能力的药物释放体系。其中,光激发药物释放体系取得了显著的成绩。在该体系中,纳米金被筛选到尺寸在40-60nm之间,以获得更好摄取效率[13]。此外形状被筛选为纳米核壳或纳米笼,以负载更多的药物分子[16]。同时纳米金颗粒的表面进行了聚乙二醇(Polyethyleneglycol, PEG)处理,从而使其能够在肿瘤位置长期地保持高浓度[10]。随后在纳米金表面使用对光敏化学键来链接大量抗癌药物。在该纳米金颗粒进入肿瘤组织内部后,由于光的激发,光敏化学键断开,从而将药物释放并定向杀死癌症细胞[7]。
我们组也做了许多该方面的工作,包括在纳米金表面修饰DNA来提高纳米金在细胞内的分散性。
2 纳米金协助的放射治疗方法的应用
纳米金颗粒具有优异的辐射敏化性以及光学性质,可以很好地应用于靶向放射治疗中。通过精细的设计,纳米金颗粒可以正向累积到肿瘤组织中,纳米金本身可以增强该区域的放射效率。其次,纳米金可以将吸收的入射光能量转化为热量,杀伤该区域癌症细胞,同时纳米金表面的药物也可以释放在该区域,进一步提高治疗效果。
2.1纳米金作为辐射敏化剂应用于辐射治疗
由于纳米金颗粒具有优良的放射致敏性,可以有效地提高放射效率,大量的工作研究了纳米金对于放射治疗效果的增强因子并获得了广泛的关注。Rahman组[18]发现在80keV辐照能量下,纳米金增强因子为25,而在6MeV辐照能量下,纳米金增强因子为4。同时 Butterworth[4]发现加入纳米金后,在辐照能量为2Gy条件下,增强因子为1-2,且该增强因子随纳米金浓度而上升。此外,Berbeco组[19]发现在MV辐照强度下,加入纳米金的Hela细胞受到的生物损伤更大,同时对位于深表的癌症细胞增强因子较大。Kumer组[10,20]发现加入纳米金后如图2所示(图2中rDEF代表加入纳米金后细胞损失与不加纳米金细胞损失的比例),相同辐照强度下细胞死亡率提高约20%,而细胞损失上升70%-130%。同时,纳米金协助治疗不会产生附加的副作用,纳米金在没有辐照时,对细胞几乎没有生物毒性。
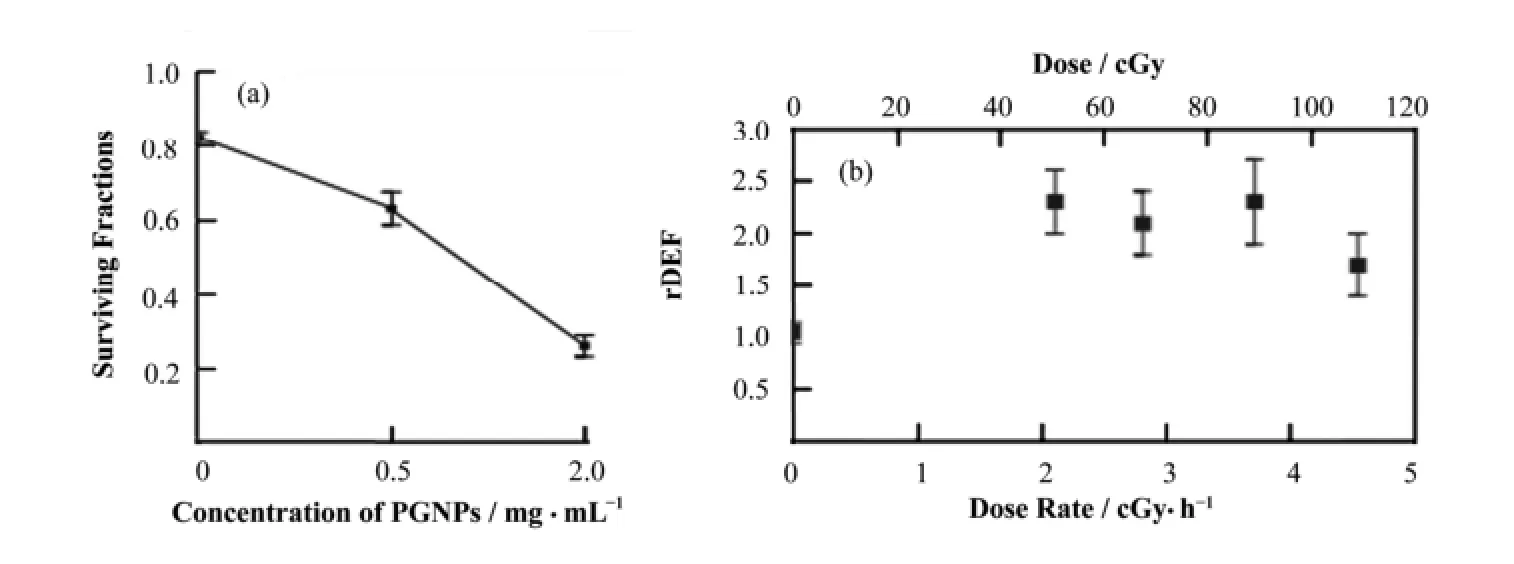
图2 体外纳米金对于放射治疗的增强作用[8,18](a) 辐照能量220 kV (2 Gy)的X射线辐照后,细胞的存活率与加入纳米金浓度的关系,(b) X射线辐照后,Hela细胞受到的不可逆损伤与加入纳米金浓度的关系Fig.2 In vitro DNA damage enhancement by gold nanoparticle during irradiation[8,18]. (a) Surviving fraction of HeLa cells irradiated with 220 kV X-rays (2 Gy) as a function of Au nanoparticle concentration, (b) Comparison of unrepaired (residual) radiation damage for HeLa cells incubated with and without Au nanoparticles
大部分的体内实验均是在keV量级的辐照强度下获得较大的增强效果。Hainfeld组[21]将纳米金静脉注射到种植了皮下EMT-6乳腺癌的小鼠体内,发现纳米金可以被特异性地运输到癌症位置,且在肿瘤组织浓度高达7mg.g-1,而正常组织的浓度是其1/8。放射治疗后,小鼠的一年存活率也由单纯放射治疗的20%提高到86%。随后,Hainfeld[22]将纳米金应用于种植了鳞状细胞癌的小鼠,实验发现加入纳米金后肿瘤体积倍增时间由53d延长到76d,同时小鼠生存时间超过200d的存活率也从25%提高到67%。Al Zaki[23]发现加入了纳米金后,肿瘤小鼠的平均存活时间较单纯放射治疗的小鼠延长了1.7倍。
纳米金的加入对应用低辐照能量及中辐照能量的放射治疗有明显的增强效果,但是对于高辐照能量的放射治疗增强效果不明显。这主要是由于重金属与低辐照能量(keV)射线产生光电效应,相较于周围软组织吸收明显,而在高辐照能量(MeV)射线下,吸收系数与周围软组织基本没有差别。
2.2纳米金的光热效应辅助放射性治疗
光热治疗通常利用局部高温杀伤肿瘤细胞。由于纳米金拥有LSPR效应,可以很好地把能量转化为热量,使局部温度大幅度提高,从而纳米金颗粒也被应用于光热治疗中。温和的光热疗法可以改变细胞的正常功能并加速细胞的凋亡,而强烈的光热疗法直接破坏细胞的细胞膜杀死细胞。
El-Sayed组[24]发现,使用标记表皮生长因子受体(Epidermal Growth Factor Receptor, EGFR)的纳米金分别处理表皮细胞和两个宫颈瘤细胞系,可以有效地降低其对514nm 激光的耐受性(图3)。这是由于癌症细胞表面通常过表达EGFR受体,其可以特异性与修饰了EGFR纳米金结合,纳米金在514nm激光作用下发生LSPR效应,在较低的激光功率下就可以有效地提高周边的局部温度,杀伤其结合的癌细胞。而正常的细胞表面无纳米金,需要较高的功率提高周边的温度,从而可以使用较低的光强就可以杀死癌细胞而不影响正常细胞。随后,El-Sayed[15]进一步改进了光热疗法,使用纳米金棒代替纳米金球,并用更易转换为热量的红外线代替普通的激光,发现在1mW的激光功率下,就可以实现对癌细胞较强的杀伤作用。
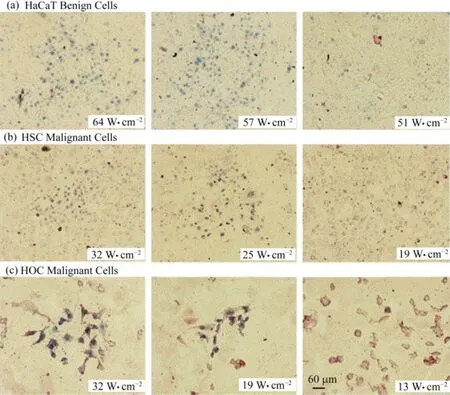
图3 三种不同细胞的514nm激光的耐受性[22](a) HaCaT是体细胞,在高于57 W.cm-2可以被杀死,(b), (c) HSC 313和HOC 3细胞是两种口腔鳞状细胞癌细胞株,分别在高于25 W.cm-2和19 W.cm-2的功率下被杀死Fig.3 HaCaT benign cells (a), HSC malignant cells (b) and HOC malignant cells (c) irradiated at different laser powers and then stained with trypan blue[22]. (a) HaCaT benign cells were killed at and above 57 W.cm-2, (b) HSC malignant cells were killed at and above 25 W.cm-2, (c) HOC malignant cells were killed at and above 19 W.cm-2
2.3多功能纳米金用于成像引导的放射治疗方法
2010年Nagesha[25]进一步改进了图像引导放射治疗方法,将惰性放射纳米金颗粒修饰化学药物,从而使得该纳米金颗粒同时兼具成像和释放药物两重功能。该多功能纳米金既可以作为放射敏化剂,也可以作为剂量描绘的探针,从而可以实现成像和治疗同时进行并降低探针对周围组织的毒性。
Huang[26]将表面修饰了叶酸的多功能纳米金棒用于体内X线断层摄影术。将纳米金皮下注入小鼠体内,通过X-ray 以及X线断层摄影看到注射位置有明显的亮点,证明纳米金可以用于X线观察。而将纳米金棒静脉注射到种植了胃癌MGC803的裸鼠体内,12h后大量的纳米金棒在肿瘤位置累积,结果如图4所示,而正常的组织并没有发现累积现象,从而证明纳米金棒可以实现靶向到癌症位置并实时成像的双重功能。
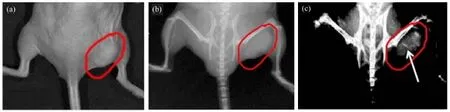
图4 静脉注射表面修饰叶酸的纳米金后,对小鼠在不同的时间点进行实时X射线成像[23](a) 肿瘤组织的照片,(b)和(c)分别为注射纳米金后0h、12h的X射线成像Fig.4 Real-time in vivo X-ray images after intravenous injection of GNR-SiO2-FA in nude mice at different time points[23].(a) Photograph of the tumor tissue, (b) X-ray image at 0 h, (c) X-ray image at 12 h
2.4纳米金在放射治疗中的其他应用
纳米金颗粒可以在较低的辐照强度下具有较高的增强因子,因此也可以被广泛地应用于小剂量的放射治疗中,如永久性短近距离放射治疗、中辐照强度近距离放射治疗、浅表肿瘤治疗等。适宜尺寸的纳米金可以大量地累积在肿瘤血管细胞周围,因此也可以作为肿瘤血管阻断剂。肿瘤血管阻断剂主要作用于肿瘤组织的营养供应系统,对于肿瘤组织内部的细胞具有更大的破坏性,结合纳米金靶向杀死肿瘤组织表层的肿瘤细胞,可以更好地发挥效果。同时由于纳米金几乎没有生物学毒性,可以有效地克服其他血管阻断剂带来的急性冠状动脉综合症及血栓的副作用[27]。
3 展望
基于纳米金颗粒的放射治疗方法已经取得了诸多进展,而其方法的未来发展方向则是多功能纳米金的综合应用,例如在放射治疗的同时使用光热治疗,既可以降低放射治疗的辐射强度,也可以降低对正常组织的伤害。结合放射治疗和光刺激药物释放体系,提高对深表肿瘤的治疗效果。此外,在对肿瘤进行放射治疗的同时,利用纳米金特殊的光学特性对肿瘤的血管位置以及肿瘤区域成像也是以后发展的重要方向。如最近发展的在辐照强度千伏下观察纳米金L-edge X射线荧光发射,可以有效地增加观察深度[28]。
同时,由于肿瘤内部高度的各向异性以及持续的变化性、不同肿瘤表达水平的不同、原发肿瘤与转移肿瘤的区别以及肿瘤自身生长变化及给药后肿瘤的变化等原因,需要对纳米金颗粒的尺寸大小在肿瘤微环境中的行为影响有更细致的研究。以后研究思路可能是针对每一个特定肿瘤筛选出对其治疗效果最佳的纳米颗粒。在筛选过程中需要充分利用肿瘤微环境的生化性质,如低pH值,外部的力量包括电刺激、磁场、超声、热和光,同时也应该考察修饰的配体带来的纳米金尺寸及细胞摄取效率的变化。
1 Rontgen W C. On a new kind of rays[J]. Radiology, 1945,45(5): 428-435. DOI: 10.1148/45.5.428
2 Reid R W. Marie Curie[M]. New American Library, 1974: 61-63
3 Agarwal P K, Sadetsky N, Konety B R, et al. Treatment failure after primary and salvage therapy for prostate cancer: likelihood, patterns of care, and outcomes[J]. Cancer, 2008,112(2): 307-314. DOI: 10.1002/cncr.23161
4 Butterworth K T, Coulter J A, Jain S, et al. Evaluation of cytotoxicity and radiation enhancement using 1.9 nm gold particles: potential application for cancer therapy[J]. Nanotechnology, 2010,21(29):295101. DOI: 10.1088/ 0957-4484/21/29/ 295101
5 Greish K. Enhanced permeability and retention of macromolecular drugs in solidtumors: a royal gate for targeted anticancer nanomedicines[J]. Journal of Drug Targeting, 2007,15(7–8): 457-464. DOI: 10.1080/ 10611860701539584
6 Choi C H, Alabi C A, Webster P, et al. Mechanism of active targeting in solid tumors with transferrincontaining gold nanoparticles[J]. Proceedings of the National Academy of Sciencesof the United States of America, 2010,107(3): 1235-1240. DOI: 10.1073/pnas. 0914140107
7 Voliani V, Signore G, Vittorio O, et al. Cancer phototherapy in living cells by multiphoton release of doxorubicin from gold nanospheres[J]. Journal of Materials Chemistry B, 2013,1(34): 4225-4230. DOI: 10.1039/C3TB20798F
8 Cao-Milán R, Liz-Marzán L M. Gold nanoparticle conjugates: recent advances toward clinical applications[J]. Expert Opinion on Drug Delivery, 2014,11(5): 741-752. DOI: 10.1517/17425247.2014.891582
9 Rodríguez-Fernández J, Pérez-Juste J, García De Abajo F J, et al. Seeded growth of submicron Au colloids with quadrupole plasmon resonance modes[J]. Langmuir, 2006,22(16): 7007-7010. DOI: 10.1021/la060990n
10 Kumar R, Korideck H, Ngwa W, t al. Third generation gold nanoplatform optimized for radiation therapy[J]. Translational Cancer Research, 2013,2(4): 228-239
11 Perrault S D, Walkey C, Jennings T, et al. Mediating tumor targeting efficiency of nanoparticles through design[J]. Nano Letters, 2009,9(5): 1909-1915. DOI: 10.1021/nl900031y
12 Wong C, Stylianopoulos T, Cui J, et al. Multistage nanoparticle delivery system for deep penetration into tumor tissue[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011,108(6): 2426-2431. DOI: 10.1073/pnas.1018382108
13 Huang K, Ma H, Liu J, et al. Size-dependent localization and penetration of ultra-small gold nanoparticles in cancer cells, multicellular spheroids, and tumors in vivo[J]. ACS Nano, 2012,6(5): 4483-4493. DOI: 10.1021/nn301282m
14 Chithrani B D, Chan W C. Elucidating the mechanism of cellular uptake and removal of protein-coated gold nanoparticles of different sizes and shapes[J]. Nano Letters, 2007,7(6): 1542-1550. DOI: 10.1021/nl070363y
15 Huang X, Qian W, El-Sayed I H, et al. The potential use of the enhanced nonlinear properties of gold nanospheres in photothermal cancer therapy[J]. Lasers in Surgery and Medicine, 2007,39(9): 747-753. DOI: 10.1002/ lsm.20577
16 Yavuz M S, Cheng Y, Chen J, et al. Gold nanocages covered by smart polymers for controlled release with near-infrared light[J]. Nature Materials, 2009,8(12): 935-939. DOI: 10.1038/nmat2564
17 Liu C J, Wang C H, Chen S T, et al. Enhancement of cell radiation sensitivity by pegylated gold nanoparticles[J]. Physics in Medicine and Biology, 2010,55(4): 931-945
18 Rahman W N, Bishara N, Ackerly T, et al. Enhancement of radiation effects by gold nanoparticles for superficial radiation therapy[J]. Nanomedicine, 2009,5(2): 136-142
19 Berbeco R I, Korideck H, Ngwa W, et al. DNA damage enhancement from gold nanoparticles for clinical MV photon beams[J]. Radiation Research, 2012,178(6): 604-608
20 Ngwa W, Korideck H, Kassis A I, et al. In vitro radiosensitization by gold nanoparticles during continuous low-dose-rate gamma irradiation with I-125 brachytherapy seeds[J]. Nanomedicine, 2013,9(1): 25-27
21 Hainfeld J F, Slatkin D N, Smilowitz H M. The use of gold nanoparticles to enhance radiotherapy in mice[J]. Physics in Medicine and Biology, 2004,49(18): 309-315
22 Hainfeld J F, Dilmanian F A, Zhong Z, et al. Gold nanoparticles enhance the radiation therapy of a murine squamous cell carcinoma[J]. Physics in Medicine and Biology, 2010,55(11): 3045-3059. DOI: 10.1088/ 0031-9155/55/11/004
23 Al Zaki A, Joh D, Cheng Z, et al. Gold-loaded polymeric micelles for computed tomography-guided radiation therapy treatment and radiosensitization[J]. ACS Nano, 2014,8(1): 104-112. DOI: 10.1021/nn405701q
24 El-Sayed I H, Huang X, El-Sayed M A. Selective laser photo-thermal therapy of epithelial carcinoma using anti-EGFR antibody conjugated gold nanoparticles[J]. Cancer Letters, 2006,239(1): 129-135
25 Nagesha D K, Tada D B, Stambaugh C K K, et al. Radiosensitizer-eluting nanocoatings on gold fiducials for biological in-situ image-guided radio therapy (BIS-IGRT)[J]. Physics in Medicine and Biology, 2010,55(20): 6039-6052
26 Huang P, Bao L, Zhang C, et al. Folic acid-conjugated silica-modified gold nanorods for X-ray/CT imaging-guided dual-mode radiation and photo-thermal therapy[J]. Biomaterials, 2011,32(36): 9796-9809. DOI: 10.1016/j.biomaterials.2011.08.086
27 Van Heeckeren W J, Bhakta S, Ortiz J, et al. Promise of new vascular-disrupting agents balanced with cardiac toxicity: is it time for oncologists to get to know their cardiologists[J]. Journal of Clinical Oncology, 2006,24(10): 1485-1488
28 Ricketts K, Guazzoni C, Castoldi A, et al. An X-ray fluorescence imaging system for gold nanoparticle detection[J]. Physics in Medicine and Biology, 2013,58(21): 7841-7855. DOI: 10.1088/0031-9155/58/21/7841
Radiotherapy enhancement with gold nanoparticles
LIU Mengmeng WANG Kun CHEN Nan WANG Lihua
(Division of Physical Biology & Bioimaging Center,Shanghai Synchrotron Radiation Facility,Key Laboratory of Interfacial Physics and Technology,Shanghai Institute of Applied Physics,Chinese Academy of Sciences,Jiading Campus,Shanghai 201800,China)
Background:Radiation therapy (RT) is a major part of the treatment of cancer and other tumor diseases by using penetrability radiation, such as X-ray, γ-ray. RT works by directly damaging the deoxyribonucleic acid (DNA) of tumor cells or indirectly creating charged particles (free radicals) within the cells, which can in turn damage DNA. As RT focused at the tumor tissue and provided a much larger absorbed dose than that in the surrounding healthy tissue, its side effect is much lighter than chemotherapy.Purpose:To destroy the whole of disease cells with minimal damage to the surrounding normal cells, which is the ultimate goal of RT, target-RT modalities have been developed.Methods:Owing to its excellent optical properties, Gold nanoparticle has drawn much attention. It has been proved that Gold nanoparticle is a good radiosensitizer of transferring keV energy radiation to micrometer-range photo-/Auger electrons. Recent development of nanotechnology has provided great opportunities for developing new RT modalities to enhance RT therapeutic efficacy by using gold nanoparticles.Results:A lot of multi-function nanoparticle systems have been designed to enhance RT therapeutic efficiency.Conclusion:Gold nanoparticles assisted target-RT has achieved greater therapeutic efficiency with less side effects and longer live time.
Radiation therapy, Gold nanoparticles, Tumor tissue
TL99
10.11889/j.0253-3219.2015.hjs.38.090501
国家自然科学基金(No.U1232114、No.1179004)、国家重点基础研究发展计划(No.2012CB932603)资助
刘蒙蒙,女,1988年出生,2015年于中国科学院上海应用物理研究所获博士学位,无机化学专业
王丽华,E-mail: wanglihua@sinap.ac.cn
2015-03-10,
2015-03-23
CLCTL99

