氧化介孔碳球纳米粒作为紫杉醇载体的研究
·论著·
氧化介孔碳球纳米粒作为紫杉醇载体的研究
王欢1,佘岚2,王琳召1,马志强2,张欣荣2,杨峰1,2(1. 福建中医药大学药学院,福建 福州 350108;2. 第二军医大学药学院无机化学教研室,上海 200433)
[摘要]目的制备氧化介孔碳球纳米粒(oMCN),考察其理化性质以及作为抗肿瘤药物紫杉醇递送载体的研究。方法采用低浓度水热法合成介孔碳球纳米粒,观察其形貌特征,测定其介孔性质参数、粒径、Zeta电位、载药量大小,利用透析法研究体外释药行为,用CCK-8法考察体外抗肿瘤活性。结果oMCN的比表面积为704.63 m2/g、孔容积为0.57 cm3/g、孔径分布约为3.23 nm、平均粒径为140 nm、Zeta电位为 -36 mV、载药量高达45.6%,72 h体外累积释药量为57.6%,具有良好的药物负载与缓释性能,对小鼠肺癌LLC细胞具有显著的抑制作用。结论oMCN作为抗肿瘤药物紫杉醇的载体具有较好的应用前景。
[关键词]介孔碳;纳米粒;氧化修饰;肿瘤;载药系统
[基金项目]国家自然科学
[作者简介]王欢,硕士研究生,研究方向:药物缓控释给药系统. E-mail: wang568855641@163.com
[通讯作者]杨峰,副教授,硕士生导师,研究方向:药物缓控释给药系统. E-mail: yangfeng1008@126.com
[中图分类号]R94[文献标志码]A
DOI[]10.3969/j.issn.1006-0111.2015.02.005
[收稿日期]2014-09-18[修回日期]2015-01-10
Oxidized meosporous carbon nanospheres as carriers for paclitaxel
WANG Huan1,SHE Lan2,WANG Linzhao1,MA Zhiqiang2, ZHANG Xinrong2,YANG Feng1,2(1.School of Pharmacy, Fujian University of Traditional Chinese Medicine, Fuzhou 350108,China; 2.Department of Inorganic Chemistry, School of Pharmacy, Second Military Medical University, Shanghai 200433, China)
Abstract[]ObjectiveTo prepare oxidized mesoporous carbon nanospheres and investigate potential application as drug delivery carriers for paclitaxel.MethodsPhysicochemical properties such as morphology, diameter, pore diameter and pore volume were characterized. Drug-loading capacity was measured and drug release behavior in vitro was investigated by dialysis method. In vitro antitumour effect was evaluated by CCK-8 methods.ResultsThe synthesized oxidized mesoporous carbon nanospheres had an average diameter of 140 nm, Zeta potential of -36 mV, high specific surface area of 704.63 m2/g,high drug-loading capacity of 45.6%.ConclusionOxidized mesoporous carbon nanospheres have promising application in anti-cancer drug delivery system.
[Key words]mesoporous carbon; nanoparticles; surface modification;tumour; drug delivery system
介孔材料是指具有孔径在2~50 nm之间有序孔道结构的材料,它们具有较大的比表面积、孔容积和有序开放的孔道结构,在吸附、催化、能量储存等领域有较为广泛的应用[1-3]。Vallet等[4]2001年首次报道了以介孔分子筛作为药物的缓释载体,近年来基于介孔碳材料在药物传递系统的应用得到了研究者们的密切关注[5-8]。本研究中,笔者合成纳米粒径的介孔碳球,对其表面氧化修饰改善碳材料固有的疏水性质,制得氧化介孔碳球纳米粒(oMCN),以抗肿瘤药物紫杉醇(paclitaxel,PTX)为模型药物,考察了oMCN作为紫杉醇药物载体的可能应用前景。
1材料与方法
1.1仪器与试剂电阻炉(SK2-1-10,上海意丰电炉有限公司),紫外分光光度仪(Lambda25,DerkinElmer公司),纳米粒度-Zeta电位测定仪(ZetasizerNano ZS,英国马尔文公司),荧光显微镜(Olympus公司),台式超速离心机(Centifuge5424,Hitachi公司),恒温振荡培养箱(Thermo Fisher Scientific公司)。紫杉醇原料药(PTX,江苏红豆杉药业有限公司), 异硫氰酸荧光素(FITC,大连美仑生物有限公司),LLC细胞株(第二军医大学医学免疫学国家重点实验室),其他为实验室常用仪器与试剂。
1.2实验方法
1.2.1介孔碳球纳米粒的制备及其表面修饰根据文献[9]报道方法合成介孔碳球纳米粒(MCN),步骤如下:0.6 g苯酚固体先于45 ℃水浴中融化,随即加入15 ml、0.1 mol/L的氢氧化钠溶液,搅拌10 min后再加入2.1 ml的甲醛溶液(37%),升温至70 ℃继续搅拌30 min,即制备了低分子量的酚醛树脂。另称取0.96 g的三嵌段共聚物F127溶于15 ml的去离子水中,加入到上述混合液中,66 ℃下以(340±20)r/min速率搅拌2 h后,加入50 ml的去离子水稀释,继续搅拌约16 h直至瓶底出现沉积物。整个反应过程中,溶液颜色从无色到粉红、最后到深红色。取17.7 ml的反应液再加45 ml水稀释,密封于水热斧中,在130 ℃下处理24 h。以10 000 r/min离心10 min收集产物,室温干燥。最后干燥粉末在N2氛围中700 ℃条件下焙烧3 h,即得MCN。
精密称取100 mg的MCN,超声分散于50 ml的双氧水中,持续超声处理4 h。为防止水温过高,每0.5 h换一次超声池里的水。100 ℃干燥收集固体粉末,即得oMCN。
1.2.2材料的表征利用FTIR分析产物的特征官能团结构,记录500~4 000 cm-1范围内的扫描图谱。利用小角X射线散射(SAXS)考察样品介观结构特征,管压40 kV,管流35 mV,记录时间30 min。d值通过公式(d= 2π/q)计算。采用透射电镜考察纳米粒的形貌特征。利用比表面积分析仪测定材料的结构参数,采用BET和BJH方法计算比表面积和孔径分布,相对压力P/P0=0.99时的吸附量计算孔容。采用激光粒度仪考察材料粒径大小、分布及Zeta电位。
1.2.3PTX的负载及载药量的计算采用溶剂浸渍平衡与溶剂挥发过程装载抗肿瘤药物PTX。步骤如下:将oMCN粉末超声分散于10 ml浓度为2 mg/ml的紫杉醇-乙醇溶液中,超声处理30 min后,继续搅拌24 h。之后在室温中,减压状态下缓慢旋转蒸发2 h以去除有机溶剂。再用乙醇与水交替洗涤固体3次,离心收集沉淀,40 ℃下真空干燥,即得装载有PTX的oMCN,命名为oMCN@PTX。
对于载药量的计算,首先精密称取5 mg的oMCN@PTX固体粉末,超声分散于200 ml的甲醇溶液中,搅拌12 h使载体中的药物充分释放溶解。溶液高速离心后,过厚度0.22 μm滤膜。利用紫外可见分光光度法测定滤液在227 nm处的吸光度(A)值。代入PTX标准曲线,计算oMCN@PTX分散体系中PTX的含量,并按以下公式计算载药率与包封率:
载药率=(载药纳米粒中的药物含量/载药纳米粒的总量)×100%
包封率=(载药纳米粒中的药物含量/投药量)×100%
1.2.4PTX的体外释放研究精密称取oMCN@PTX粉末,分散于2 ml的DMSO溶液中,分散液密封于透析管中(截留分子量为10 000 g/mol),投入30 ml pH值7.4的磷酸缓冲液中,在37 ℃的恒温箱中以100 r/min的速率振荡,定时取样2 ml,并补充新鲜的等温、等体积磷酸缓冲液。所有样品在4 ℃下15 000 r/min离心30 min,紫外分光光度法测定227 nm处的A值。计算PTX在各个时间点累积释药率Q,计算公式如下:
V0:释放介质的总体积;Ct=各个时间点释放介质中的PTX浓度(μg/ml);V:每次取样的体积;W:投入的oMCN@PTX的总质量;X:oMCN@PTX的载药量(%)。
1.2.5细胞摄取实验将对数期生长的LLC细胞调整浓度为5×105个/ml,铺于6孔板中,用含有10%胎牛血清的1640培养基在37 ℃及5%的CO2条件下培养24 h,待细胞贴壁后弃去上清液,加入浓度约为50 μg/ml的oMCN@FITC培养基溶液与细胞共孵育2 h。用4%的多聚甲醛溶液固定细胞20 min后,再用含有20 μl的DAPI的200 μl的PBS溶液染核20 min,PBS洗尽残余染料后用荧光显微镜观察碳球纳米粒被LLC细胞摄取情况。
1.2.6细胞毒性实验用CCK-8法评价oMCN的生物安全性及oMCN@PTX的细胞毒性。调整LLC细胞浓度为5×104个/ml,以每孔100 μl培养在96孔板中,24 h后分别加入不同浓度的oMCN、oMCN@PTX和PTX(PTX先用DMSO溶解再用含血清培养基稀释,DMSO含量<0.1%),设为实验组,同时设立空白溶剂组和阴性对照组。24 h后加入10%的100 μl的CCK-8培养基溶液,继续在37 ℃下及5%的CO2中培养2 h,颜色变化后用酶标仪测量在450 nm处的A值,计算细胞相对存活率大小,公式如下:
细胞相对存活率(%)=
2结果
2.1MCN的制备及表征按照文献[9]方法,笔者先以三嵌段共聚物F127为模板,酚醛树脂为碳源,利用低浓度水热的方法合成了MCN材料。然后,为了改善碳材料固有的疏水特性,又以双氧水为氧化剂用湿热氧化法对碳球表面进行氧化处理,以期引入亲水性的官能团,提高纳米粒的亲水性和分散性。红外光谱(FTIR)图(图1)清晰地表明所合成的oMCN除了具有类似MCN典型的芳香烃结构外,在1 722 cm-1处出现了羰基伸缩振动峰,在1 190 cm-1处出现了碳氧单键伸缩振动峰,表明我们成功地在纳米粒表面引入了含氧官能团。

图1 MCN与oMCN的红外光谱(FTIR)图谱
利用透射电镜(TEM)对材料进行形貌的表征。结果如图2示,MCN与oMCN为规则的球型,大小均一,两者粒径都在140 nm左右。氧化前后纳米粒表面介孔孔道都排列有序,说明利用双氧水湿热氧化并不会破坏纳米粒原有的介观结构。


图2 材料的透射电镜(TEM)照片 A.×20 000, MCN;B.×200 000, MCN;C.×40 000, oMCN;D.×80 000, oMCN

图3 材料的理化性质表征结果图 A. MCN与oMCN的小角X射线散射图谱;B.oMCN的N 2吸附脱附等温线与孔径分布图; C. MCN与oMCN的粒径分布图;D.MCN与oMCN的Zeta电位分布图
2.2oMCN对PTX的负载及释放根据不同浓度的PTX甲醇溶液在227 nm处的A值,笔者首先作了PTX溶液浓度 (C) 与吸光度值 (A) 的标准曲线 (图4A), 建立直线回归方程,为A=0.063 38+0.034 37C,该曲线在浓度1.25~40 μg/ml范围内具有较高的相关性(r=0.999 82)及较小的标准偏差(s=0.015 03)。
利用oMCN对PTX进行负载,将PTX溶解于乙醇,配制成较高浓度的溶液,再与oMCN充分搅拌混合,使PTX充分吸附于oMCN的介孔孔道里。待乙醇挥发干净后,用水与乙醇重复洗涤以除去未被吸附或者吸附于oMCN浅表面的PTX分子,即得到载有药物的纳米粒oMCN@PTX。将oMCN@PTX分散在过量的甲醇中,使PTX充分释放并溶解,利用标准曲线方程测得溶出液中PTX的含量,计算载药率为45.56%,结果比一般的纳米载体要高,这是因为PTX是芳香族化合物,而oMCN为具有缺陷石墨烯结构的基面,药物和载体可以通过π-π堆积力和疏水作用紧密结合[10,11]。在体外释放的研究中,我们采用疏水环境作为oMCN@PTX的溶出介质,因为PTX为难溶性药物,在水性环境中大多保留在孔道内,而当载体被细胞吞噬达到细胞的疏水环境后,药物就能缓慢释放出来[12]。 如图4B所示,游离的药物在12 h时几乎释放完全,而oMCN@PTX显示出良好的缓释性能,前12 h以内约有29.2%的药物迅速释放,之后缓慢释药,直至48 h时到达平台期,可以使血药浓度在治疗窗内保持平缓,72 h总释放量为57.6%。以上结果表明,oMCN十分适合作为疏水性药物的载释容器。
2.3细胞摄取实验为了考察LLC细胞对oMCN的摄取,笔者选取小鼠肺癌细胞LLC为研究对象。首先,以绿色荧光物质异硫氰酸荧光素(FITC)标记oMCN,制备了oMCN@FITC,利用荧光显微镜观察LLC对纳米粒的摄取。如图5所示,黑色的粒子周围具有明显的绿色荧光,且环绕着细胞核分布在细胞液中,为oMCN@FITC释放的FITC所致。结果说明oMCN可以负载客体分子透过细胞膜,并且在细胞液中释放客体分子。
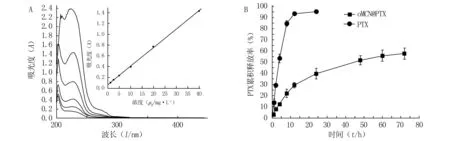
图4 PTX溶液紫外吸收曲线,吸光度-浓度标准曲线及药物的体外释放曲线 A.不同浓度的PTX甲醇溶液的紫外吸收曲线与吸光度-浓度标准曲线;B.游离PTX与oMCN@PTX体外释放曲线

图5 LLC与oMCN@FITC在37 ℃下共孵育2 h后的荧光显微镜图像(×200) A.可见光下直接观察内吞情况;B.DAPI染核后的蓝色荧光图像;C.oMCN@FITC的绿色荧光图像;D.A、B、C图的融合图像
2.4细胞毒性实验采用CCK-8法评价载药体系对LLC的细胞毒性,如图6A所示,单独药物与oMCN@PTX对LLC细胞的毒性都有剂量依赖性,随着药物浓度增加,对细胞的杀伤力随之增强。特别在6.25~50 μg/ml浓度范围内,oMCN@PTX的杀伤力明显强于单纯药物(P=4.1×10-4<0.05),可能是载体oMCN能更有效地负载PTX进入细胞,并释放药物。通过计算,单纯药物与oMCN@PTX的IC50值分别为7.065与4.936 μg/ml。如图6B所示,考察了空白载体对LLC的毒性,发现即使oMCN的浓度达到50 μg/ml,与LLC细胞作用24 h后,细胞存活率仍达到80%,说明oMCN本身对LLC的毒性小,而oMCN@PTX对细胞的杀伤力来自其释放的药物分子。

图6 载药系统与空白载体对LLC细胞的细胞毒性结果图 A.不同浓度的单纯药物与oMCN@PTX与LLC细胞作用24 h后的细胞相对存活率; B.不同浓度的空白载体oMCN与LLC细胞作用24 h和48 h的细胞相对存活率
3讨论
本研究成功合成了MCN,并用双氧水作为温和氧化剂在纳米粒表面引入了含氧官能团,显著改善了纳米粒的分散性,提高了亲水性。笔者制备的oMCN粒径约为140 nm,Zeta电位为-36 mV。根据肿瘤组织特异的EPR效应,合适的粒径大小赋予了纳米粒被动靶向能力。oMCN比表面积为704.63 m2/g,孔容积为0.57 cm3/g,孔径为3.23 nm。此外,oMCN通过疏水作用以及π-π堆积力可以负载大量的PTX分子,载药量达45.56%,对药物具有缓释效果,十分适合作为难溶性药物的载体。体外实验证明,oMCN可以有效地负载客体分子透过细胞膜,在细胞质中释放药物,该载药体系对LLC细胞具有良好的杀伤力,杀伤效果高于单独药物,而载体本身显示着良好的安全性。
本研究仍存在一些问题亟待解决,譬如载药体系的体内抗肿瘤效果,载体的体内代谢命运等问题。本实验为MCN在抗肿瘤药物传递系统的研究提供一定的理论与实验依据,相信该载药体系在有效地增溶难溶性药物,提高抗肿瘤药物的生物利用度,发挥治疗效果中具有潜在的应用价值。
【参考文献】
[1]Yuan X, Xing W, Zhuo SP,etal. Adsorption of bulky molecules of nonylphenol ethoxylate on ordered mesoporous carbons[J]. J Colloid Interfac Sci, 2008, 322(2): 558-565.
[2]Peng H, Ma GF, Sun KJ,etal. Formation of carbon nanosheetsviasimultaneous activation and catalytic carbonization of macroporous anion-exchange resin for supercapacitors application[J]. ACS Appl Mater Interfac, 2014, 6(23):20795-20803.
[3]Li FH. Layer-by-layer loading iron onto mesoporous silica surfaces: synthesis, characterization and application for As(V) removal[J]. Microporous Mesoporous Mater, 2013, 171: 139 146.
[4]Vallet RM, Ramila A, Real RP. A new property of MCN-41: drug delivery system[J]. Chem Mater, 2001,13: 308-311.
[5]Chen B, Quan GL, Wang ZH,etal. Hollow mesoporous silicas as a drug solution delivery system for insoluble drugs[J]. Powder Technol, 2013, 240: 48 53.
[6]Shen S, Tang H, Zhang X,etal. Targeting mesoporous silica-encapsulated gold nanorods for chemo-photothermal therapy with near-infrared radiation[J]. Biomaterials, 2013, 34(12): 3150-3158.
[7]Zhao P, Jiang H, Jiang T,etal. Inclusion of celecoxib into fibrous ordered mesoporous carbon for enhanced oral bioavailability and reduced gastric irritancy[J]. Eur J Pharm Sci, 2012, 45(5): 639-647.
[8]Wang X, Liu P, Tian Y. Ordered mesoporous carbons for ibuprofen drug loading and release behavior[J]. Microporous Mesoporous Mater, 2011, 142(1): 334-340.
[9]Fang Y, Gu D, Zou Y,etal. A low-concentration hydrothermal synthesis of biocompatible ordered mesoporous carbon nanospheres with tunable and uniform size[J]. Angew Chem Int Ed Engl, 2010, 49(43): 7987-7991.
[10]Li Y, Zhong J, Yang X,etal. Simple synthesis of semi-graphitized ordered mesoporous carbons with tunable pore sizes[J]. New Carbon Mater, 2011, 26(2): 123-129.
[11]Wang C, Xu H, Liang C,etal. Iron oxide @ polypyrrole nanoparticles as a multifunctional drug carrier for remotely controlled cancer therapy with synergistic antitumor effect[J]. ACS Nano, 2013, 7(8): 6782-6795.
[12]Gu JL,Su SS,Li YS,etal.Hydrophilic mesoporous carbon nanoparticles as carriers for sustained release of hydrophobic anti-cancer drugs[J].Chem Commun,2011,47(7):2101-2103. X, Xing W, Zhuo SP,etal. Adsorption of bulky molecules of nonylphenol ethoxylate on ordered mesoporous carbons[J]. J Colloid Interfac Sci, 2008, 322(2): 558-565.
[2]Peng H, Ma GF, Sun KJ,etal. Formation of carbon nanosheetsviasimultaneous activation and catalytic carbonization of macroporous anion-exchange resin for supercapacitors application[J]. ACS Appl Mater Interfac, 2014, 6(23):20795-20803.
[3]Li FH. Layer-by-layer loading iron onto mesoporous silica surfaces: synthesis, characterization and application for As(V) removal[J]. Microporous Mesoporous Mater, 2013, 171: 139 146.
[4]Vallet RM, Ramila A, Real RP. A new property of MCN-41: drug delivery system[J]. Chem Mater, 2001,13: 308-311.
[5]Chen B, Quan GL, Wang ZH,etal. Hollow mesoporous silicas as a drug solution delivery system for insoluble drugs[J]. Powder Technol, 2013, 240: 48 53.
[6]Shen S, Tang H, Zhang X,etal. Targeting mesoporous silica-encapsulated gold nanorods for chemo-photothermal therapy with near-infrared radiation[J]. Biomaterials, 2013, 34(12): 3150-3158.
[7]Zhao P, Jiang H, Jiang T,etal. Inclusion of celecoxib into fibrous ordered mesoporous carbon for enhanced oral bioavailability and reduced gastric irritancy[J]. Eur J Pharm Sci, 2012, 45(5): 639-647.
[8]Wang X, Liu P, Tian Y. Ordered mesoporous carbons for ibuprofen drug loading and release behavior[J]. Microporous Mesoporous Mater, 2011, 142(1): 334-340.
[9]Fang Y, Gu D, Zou Y,etal. A low-concentration hydrothermal synthesis of biocompatible ordered mesoporous carbon nanospheres with tunable and uniform size[J]. Angew Chem Int Ed Engl, 2010, 49(43): 7987-7991.
[10]Li Y, Zhong J, Yang X,etal. Simple synthesis of semi-graphitized ordered mesoporous carbons with tunable pore sizes[J]. New Carbon Mater, 2011, 26(2): 123-129.
[11]Wang C, Xu H, Liang C,etal. Iron oxide @ polypyrrole nanoparticles as a multifunctional drug carrier for remotely controlled cancer therapy with synergistic antitumor effect[J]. ACS Nano, 2013, 7(8): 6782-6795.
[12]Gu JL,Su SS,Li YS,etal.Hydrophilic mesoporous carbon nanoparticles as carriers for sustained release of hydrophobic anti-cancer drugs[J].Chem Commun,2011,47(7):2101-2103.
[本文编辑]陈静

