硅酸锂陶瓷材料高温捕获CO2的研究进展
邱亚琴,汪文哲,陈潇湘,王少龙
(1. 华中科技大学光学与电子信息学院,湖北 武汉 430074;2. 华中科技大学煤燃烧国家重点实验室,湖北 武汉 430074)
硅酸锂陶瓷材料高温捕获CO2的研究进展
邱亚琴1,汪文哲2,陈潇湘2,王少龙2
(1. 华中科技大学光学与电子信息学院,湖北 武汉 430074;2. 华中科技大学煤燃烧国家重点实验室,湖北 武汉 430074)
CO2是造成全球气候变暖的主要因素,需要从排放源中直接捕获二氧化碳,然后进行储存,以有效地控制大气中的二氧化碳浓度。本文综述了硅酸锂陶瓷材料高温捕获烟气中二氧化碳的分离理论,硅酸锂陶瓷材料的制备方法,CO2高温捕获效率的影响因素,以及电厂CO2高温捕获工艺,并提出了硅酸锂陶瓷材料高温捕获CO2今后的发展方向和研究重点。
二氧化碳;硅酸锂陶瓷;高温分离;煤燃烧
0 引 言
化石能源长期大量利用过程中,排放了大量的CO2温室气体。在我国的能源消费结构中,煤炭占68.5%,居于主导地位。IPCC(Intergovernmental Panel on Climate Change)预测2100年,地球气温将升高约1.4-5.8 ℃,导致海平面上升等一系列问题,造成自然生态系统失衡,威胁人类的食物供应和居住环境,从而给全球带来潜在的重大影响。1904-2004年间,中国CO2排放量只占全球的8%。现在由于中国经济的快速发展,碳排放量已经位居全球首位,碳减排刻不容缓[1]。
CO2的减排措施主要包括:提高能源利用效率、利用可再生能源以及采用CO2捕集和隔离技术(CCS)。CO2捕集措施包括:燃前脱碳、燃中脱碳和燃后脱碳。将捕集的CO2埋存从根本上减少CO2的排放。CO2的排放主要来自于燃煤电厂,在高温烟气中直接脱除CO2可以减少系统的能量损失。本文关注一种非碳基硅酸锂陶瓷材料高温分离烟气中二氧化碳的研究,详细综述硅酸锂陶瓷材料高温分离烟气中二氧化碳目前的研究进展。
1 硅酸锂分离CO2理论
Li4SiO4是一种通过对二氧化硅和碳酸锂加热合成的白色陶瓷。Li4SiO4属单斜晶系,其晶胞参数分别为a=5.297A,b=6.101A,c=5.150A和β=90.251A[2]。Nakagawa等[3-6]研究发现,700 ℃下,Li4SiO4陶瓷材料可与CO2发生反应。硅酸锂对CO2的吸附反应如下:
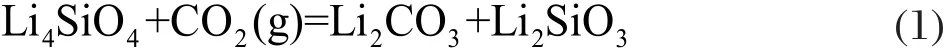
热力学计算表明,在700 ℃以下△G都是小于零的,说明Li4SiO4对CO2的吸收反应能自发进行。在800 ℃以上△G都是大于零,吸附反应将不再发生。因此,理论上吸附反应温度应不高于800 ℃,计算结果还表明吸附反应的焓变在0-700 ℃范围内△H<0,说明吸附反应为放热反应(表1)[1,7]。硅酸锂吸附和脱附CO2反应模型如图1所示[6]。
Seggiani等研究表明,580 ℃是Li4SiO4吸附CO2的最佳温度段(图2)[8]。Ortiz等进行了Li4SiO4吸附CO2的动力学研究。在80%CO2/空气条件下,从550 ℃到 650 ℃,随着温度的升高,Li4SiO4碳酸化效率明显增加。在温度为650 ℃不变的情况下,CO2浓度从50%, 65%到80% 变化,随着CO2浓度的增加,Li4SiO4碳酸化效率明显增加(图3、图4)[9]。
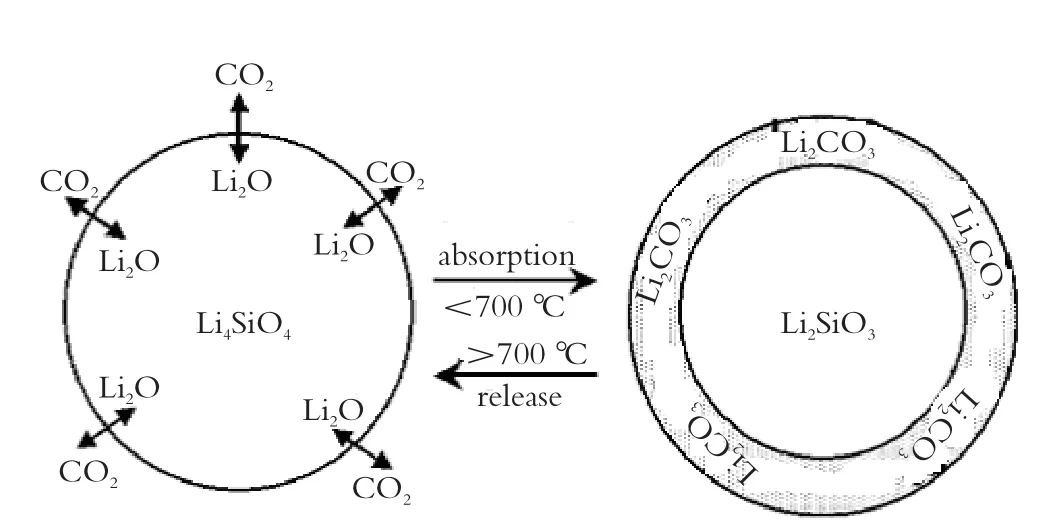
图1 硅酸锂吸附和脱附CO2反应模型[6]Fig.1 Reaction model of CO2absorption and emission by lithium silicate[6]
图2 不同温度下Li4SiO4对4% CO2吸附能力的比较Fig.2 CO2absorption on Li4SiO4in 4 vol.% CO2at different temperatures

图3 温度对Li4SiO4碳酸化效率的影响Fig.3 Effect of temperature on the kinetics of CO2absorption by Li4SiO4

表1 吸附反应的热力学计算结果Tab.1 Thermodynamic calculations of adsorption reaction
Li4SiO4有着对CO2高的吸附能力和吸收速率。原理是Li4SiO4陶瓷材料晶体结构中所含的氧化锂可以与CO2进行反应。在500 ℃左右的条件下,多孔硅酸锂陶瓷材料与含有CO2的气体发生化学反应,结果表明,CO2以碳酸锂的形态存在于多孔体的微孔中。700 ℃以上,发生逆反应,反应生成的Li2CO3又分解释放出CO2,这样可以将混合气体中的CO2分离出来。当CO2与Li4SiO4的质量比为36.66%时,理论上完全反应[1]。

图4 CO2浓度对Li4SiO4碳酸化效率的影响Fig.4 Effect of CO2concentration on the absorption kinetics of Li4SiO4
2 硅酸锂的制备
Li4SiO4陶瓷材料可以通过多种方法制备。主要有高温固相法、溶胶凝胶法等[10-16]。
高温固相法制备硅酸锂:准确称取n(SiO2) : n(Li2CO3)=1 : 2的反应原料,用无水乙醇作溶剂混合在球磨罐中球磨,在800 ℃下煅烧得硅酸锂。
溶胶凝胶法制备硅酸锂:将Li2CO3溶解在去离子水稀释的醋酸中,搅拌加入正硅酸乙酯(TEOS),烘干、800 ℃下煅烧得硅酸锂。
Bretado等提出由LiNO3和 SiO2通过一系列连续反应完成也可以制备Li4SiO4, Li4SiO4通过如下反应合成[12]。
三种方法对于制备纯Li4SiO4陶瓷材料吸附CO2效果相当。前两种为常规制备方法,Bretado等提出的是一种有潜力的制备方法,CO2吸附量达到理论吸收值的98.4%[1]。
3 硅酸锂分离CO2的影响因素
3.1 粉体粒径的影响
Kato等[6]采用粒度0.5 μm、纯度99.5%的Li2CO3和粒度4 μm的SiO2按摩尔比2 ∶1混合,马弗炉1000 ℃煅烧8 h制备出Li4SiO4陶瓷材料,利用热重分析仪研究Li4SiO4陶瓷材料的CO2吸收/脱附性能。700 ℃纯CO2气氛下进行CO2吸收试验,850 ℃纯N2气氛下进行CO2脱附试验,陶瓷材料吸附剂质量变化约为35%。研究还发现具有四大优势:CO2吸附速率快、吸附温度范围宽、吸附量大以及循环利用性能佳。
Nakagawa等[17]探讨了三种不同的方式即固相反应法、共沉淀法和sol-gel法(加微波)制备的Li4SiO4陶瓷材料CO2吸附性能。计算得出大颗粒活化能为l61.444±1.06 kJ/mol(化学吸附)和36.472 ±0.74 kJ/mol(扩散);小颗粒的活化能为20.92± 1.663 kJ/mol(化学吸附)和12.208±1.741 kJ/mol(扩散)。表明颗粒越小,CO2的反应活性越高[1]。
Okumura等[18]分析了Li4SiO4陶瓷材料粒径对CO2吸收的影响。通过实验测试,计算出Li4SiO4与CO2反应中的表观速率常数(apparent rate constant) k,在620-660 ℃温度范围内,k值随温度升高逐渐增加。另外,k值随着Li4SiO4粒径的减小而增加。
Essaki等[19]研究发现,反应温度对Li4SiO4颗粒对CO2的吸收性能影响很大;在10 vol% CO2气氛下,最快的吸收速度存在于550-600 ℃之间。
不同的研究者制备的Li4SiO4陶瓷材料粒径不同,材料的物理性质也有差别,实验条件不同,CO2浓度不同,所以得出的吸附量和最佳温度变化规律不完全相同。
3.2 掺杂改性的影响
为了提高CO2吸收性能,许多研究者进行金属元素的掺杂改性,制备出系列金属固溶体。如钠元素掺杂的Li4SiO4形成二元固溶体Li4-xNaxSiO4,比单一Li4SiO4具有更加优良的CO2吸收效果。Mejia-Trejo等[20]通过等温吸收试验获得了Na掺杂的Li4SiO4陶瓷材料CO2吸附动力学参数。钾元素掺杂比钠元素掺杂更有利于提高CO2的吸附速率,这是由于K+离子半径比Li+离子半径大,掺杂K元素导致陶瓷材料结构形成大量缺陷,这些缺陷有利于提高陶瓷材料的活性,同时降低反应物熔点,使陶瓷材料对CO2的吸附性能提高。因此掺杂适量的K元素可改善陶瓷材料活性,使CO2吸附速率和容量均有所提高[21,22]。同时掺杂钇和钾材料的吸附性能又会进一步提高,可能的原因是Y3+增加了氧的空位数量[23]。Seggiani等采用K2CO3、Na2CO3、Li2CO3对Li4SiO4进行掺杂改性研究其CO2吸附/脱附性能。结果表明580 ℃吸附温度下,添加30w.%K2CO3或Na2CO3的Li4SiO4吸附CO2能力最强,达到230 mgCO2/g, 但在吸附/脱附过程中,添加Na2CO3的Li4SiO4容易引起烧结降低吸附性能,而添加K2CO3的Li4SiO4在25次吸附/脱附循环后仍保持很高的CO2分离能力[1,24]。
Gauer等[25]进行了Al3+、Fe3+掺杂Li4SiO4的CO2吸附实验研究,Fe元素掺杂CO2吸收效果最佳。在这两种情况下,对比没有改性的Li4SiO4,Li+的活性和传导性增加。这是由于Al3+的置换形成空位引起的。国内王银杰、阳书文以及汪文哲等[26-29]也对改性Li4SiO4的陶瓷材料的CO2吸收性能进行过研究。采用不同硅源,如硅藻土[30]、稻壳灰[31]、燃煤飞灰[32]等合成Li4SiO4均有良好的CO2吸附性能。
Li4SiO4和CO2的反应发生于陶瓷材料晶粒的外表面,反应速率与Li+和O2-的扩散有关。这样,在Li4SiO4晶体中缺陷通过掺杂其它元素可以提高它的反应活性。对于掺杂元素的选择要考虑其热力学性质。一般来说,掺杂吉布斯自由能低的阳离子,能够减弱氧的结合力,促进O2-的迁移能力,进而增加Li4SiO4与CO2的反应活性[1]。
4 电厂捕获工艺
为了从电厂烟气中连续回收CO2,需要连续装载Li4SiO4的反应器才能保证CO2的吸附/脱附不间断的进行,图5为电厂CO2捕获系统示意图。在该系统中,CO2吸附温度为600 ℃,吸附剂再生温度为850 ℃。为了利用再生后吸附剂的有效热量,把400 ℃的废气引入反应器,和再生后的吸附剂一起反应来降低吸附剂的温度到合适的温度范围利于CO2吸收。CO2分离效率计算如图6所示,计算预测烟气温度在500 ℃至550 ℃分离效率最佳[5]。
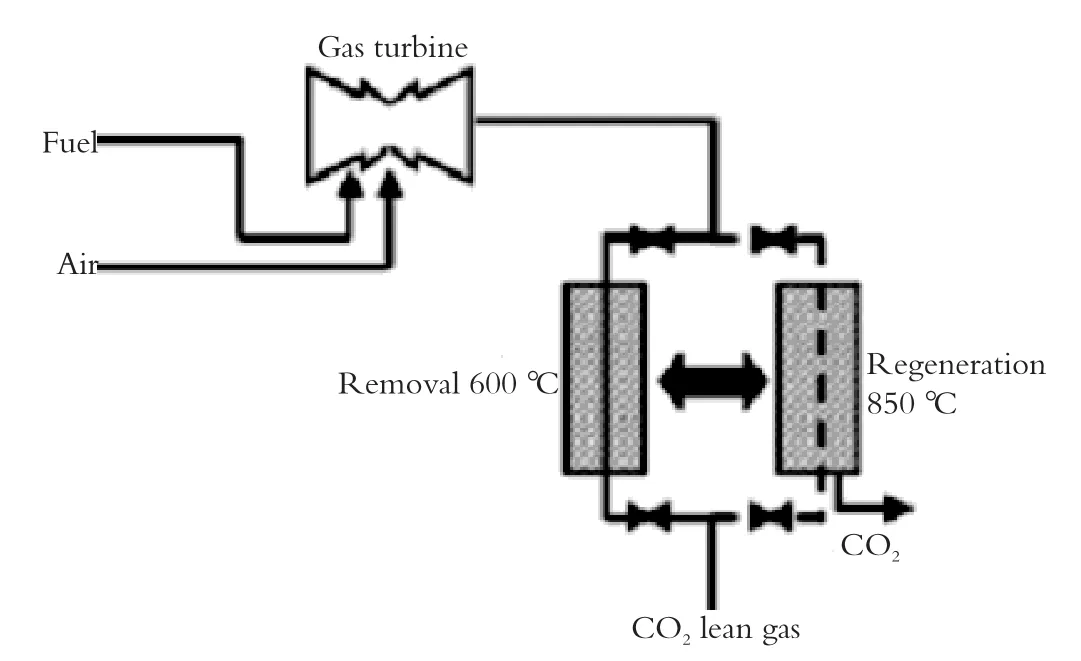
图5 电厂CO2捕获系统示意图Fig.5 Schematic drawing of the continuous capturing system
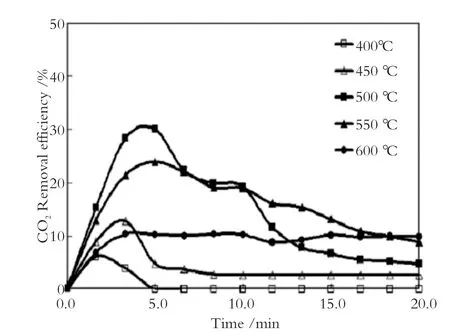
图6 填充床CO2分离效率计算图Fig.6 Estimation of CO2Removal efficiency for the packed bed
5 结束语
硅酸锂陶瓷材料高温分离二氧化碳,具有强大的吸收能力,快速的吸收速率,宽广的温度范围和浓度,以及良好的再生功能。掺杂改性硅酸锂可以进一步改善CO2的吸收量和再生性能,新的掺杂元素和掺杂方式需要验证;深入揭示烟气组分如H2O、SO2、NOx等对硅酸锂陶瓷材料分离CO2的影响,建立完善合理的硅酸锂陶瓷材料吸收CO2模型;探索吸附剂材料的成型技术为其工业利用奠定基础;对硅酸锂陶瓷材料高温下捕集CO2技术进行经济安全性评价。总之,硅酸锂陶瓷材料作为高温烟气CO2脱除的固体吸收剂具有良好的应用前景。
[1] 汪文哲. 氧化锂基吸收剂高温二氧化碳吸收的实验研究[D].武汉: 华中科技大学, 2011: 73.
[2] MCMURDIE H F, MORRIS M C, EVANS E H, et al. Methods of producing standard X-ray diffraction powder patterns [J].Powder Diffr., 1986, 1(1): 40-43.
[3] NAKAGAWA K, OHASHI T. A novel method of CO2Capture from high temperature gases [J]. Journal of the Electrochemical Society, 1998, 145: 1344.
[4] ESSAKI K, NAKAGAWA K, KATO M. Acceleration effect of ternary carbonate on CO2absorption rate in lithium zirconate powder [J]. Nippon Seramikkusu Kyokai Gakujutsu Ronbunshi, 2001, 109(10): 829-833.
[5] KATO M, NAKAGAWA K. New series of lithium containing complex oxides, lithium silicates, for application as a hightemperature CO2absorbent [J]. Nippon Seramikkusu Kyokai Gakujutsu Ronbunshi, 2001, 109(11): 911-914.
[6] KATO M, NAKAGAWA K, ESSAKI K, et al. Novel CO2absorbents using lithium-containing oxide [J]. International Journal of Applied Ceramic Technology, 2005, 2(6): 467-475.
[7] 吕国强, 王华, 马文会, 等. Li4SiO4吸收CO2的实验研究[J]. 热能工程, 2009, 24(24): 644-649.LV Guoqiang, et al. Journal of Engineering for Thermal Energy and Power, 2009, 24(24): 644-649.
[8] SEGGIANI M, PUCCINI M, VITOLO S. High-temperature and low concentration CO2sorption on Li4SiO4based sorbents: Study of the used silica and doping method effects [J]. International Journal of Greenhouse Gas Control, 2011, 5: 741-748.
[9] ORTIZ A L, BRETADO M A E, VELDERRAIN V G, et al.Experimental and modeling kinetic study of the CO2absorption by Li4SiO4[J]. International Journal of Hydrogen Energy, 2014, 39: 16656-16666.
[10] KHOMANE R B, SHARMA B K, SAHA S, et al. Reverse microemulsion mediated sol-gel synthesis of lithium silicate nanoparticles under ambient conditions: Scope for CO2sequestration [J]. Chemical Engineering Science, 2006, 61(10): 3415-3418.
[11] SUBHA P V, NAIR B N, HAREESH P, et al. Enhanced CO2absorption kinetics in lithium silicate platelets synthesized by a sol-gel approach [J]. Journal of Materials Chemistry A, 2014, 2: 12792-12798.
[12] BRETADO M E O, VELDERRAIN V G, GUTIE' RR D L, et al. A new synthesis route to Li4SiO as CO2catalytic/sorbent [J].Catalysis Today, 2005, 107-108: 863-867.
[13] 王明月, 白钰航, 房明浩, 等. LaMAl11O19(M = Mn、Co、Ni、Zn)陶瓷材料的制备及力学性能研究[J]. 人工晶体学报, 2014, 43(6): 1402-1407.WANG Mingyue, et al. Journal of Synthetic Crystals. 2014, 43(6): 1402-1407.
[14] 郭华强, 张鑫, 朱冠宇, 等. 微波固相法与常规高温固相法制备镁铝尖晶石粉体的对比研究[J]. 陶瓷学报, 2014, 35(5): 507-711.GUO Huaqiang, et al. Journal of Ceramics, 2014, 35(5): 507-711.
[15] 戴培赟, 王泌宝, 李晓丽. 多孔陶瓷制备技术研究进展[J]. 陶瓷学报, 2013, 34(1): 95-101.DAI Peiyun, et al. Journal of Ceramics, 2013, 34(1): 95-101.
[16] 田玉明, 刘爱平, 赵鹏飞. 烧结温度对低密度陶粒支撑剂组织和性能的影响[J]. 陶瓷学报, 2014, 35(5): 483-486.TIAN Yuming,et al. Journal of Ceramics, 2014, 35(5): 483-486.
[17] NAKAGAWA K, KATO M, YOSHIKAWA S, et al. A novel CO2absorbent using lithium containing oxides [J]. Ceramics Japan, 2002, 37(11): 876-879.
[18] OKUMURA T, MATSUKURA Y, GOTOU K, et al. Particle size dependence of CO2absorption rate of powdered Li4SiO4with different particle size [J]. Journal of the Ceramic Society of Japan, 2008, 116(12): 1283-1288.
[19] ESSAKI K, KATO M, UEMOTO H. Influence of temperature and CO2concentration on the CO2absorption properties of lithium silicate pellets [J]. Journal of Materials Science, 2005, 40(18): 5017-5019.
[20] MEJIA-TREJO V L, FREGOSO-ISRAEL E, PFEIFFER H.Textural structural and CO2chemisorption effects produced on the lithium orthosilicate by its doping with sodium (Li4-xNaxSiO4) [J]. Chem. Mater., 2008, 20(22): 7171-7176.
[21] 黄煜煜, 李振山, 蔡宁生,等. 高温 CO2吸附/吸收剂的研究进展[J]. 热能动力工程, 2005, 20(6): 557-561.HUANG Yuyu, et al. Journal of Engineering for Thermal Energy and Power, 2005, 20(6): 557-561.
[22] 陈思达, 沈洪雪, 王芸, 等. K掺杂对硅酸锂陶瓷材料吸收二氧化碳性能的影响[J]. 中国陶瓷, 2014, 50(1): 30-33.CHEN Sida, et al. Chinese Ceramic, 2014, 50(1): 30-33.
[23] ABANADES J C, ANTHONY E J, LU D Y, et al. Capture of CO2from combustion gases in a fluidized bed of CaO [J].AIChE Journal, 2004, 50(7): 1614-1622.
[24] SEGGIANI M, PUCCINI M, VITOLO S. Alkali promoted lithium orthosilicate for CO2capture at high temperature and low concentration [J]. International Journal of Greenhouse Gas Control, 2013, 17: 25-31.
[25] GAUER C, HESCHEL W. Doped lithium orthosilicate for absorption of carbon dioxide [J]. Journal of Materials Science, 2006, 41(8): 2405-2409.
[26] 王银杰, 其鲁, 代克化. Na掺杂对硅酸锂吸收CO2性能的影响[J]. 物理化学学报, 2006, 22(7): 860-863.WANG Yinjie, et al. Journal of Chemical Physics, 2006, 22(7): 860-863.
[27] 王银杰, 其鲁, 江卫军. K的掺杂对硅酸锂吸收CO2性能的影响[J]. 北京理工大学学报, 2006, 26(5): 458-460.WANG Yinjie, et al. Journal of Beijing Institute of Technology, 2006, 26(5): 458-460.
[28] 阳书文, 于洁, 吕国强, 等. 可循环利用的Li4SiO4吸收CO2的实验研究[J]. 中国稀土学报, 2008, 26(8): 657-660.YANG Shuwen, et al. China Journal of Rare Earths, 2008, 26(8): 657-660.
[29] 汪文哲, 熊贵, 张军营, 等. 高温下Ti掺杂对Li4SiO4吸收CO2性能的影响[J]. 动力工程学报, 2010, 30(8): 623-627.WANG Wenzhe, et al. Journal of Chinese Society of Power Engineering, 2010, 30(8): 623-627.
[30] SHAN S H, JIA Q M, JIANG L H, et al. Novel Li4SiO4-based sorbents from diatomite for high temperature CO2capture [J].Ceramics International, 2013, 39: 5437-5441.
[31] WANG K, ZHAO P F, GUO X, et al. Enhancement of reactivity in Li4SiO4-based sorbents from the nano-sized rice husk ash for high-temperature CO2capture [J]. Energy Conversion and Management, 2014, 814: 47-454.
[32] OLIVARES-MARI' N M, DRAGE T C, MAROTO-VALER M M. Novel lithium-based sorbents from fly ashes for CO2capture at high temperatures [J]. International Journal of Greenhouse Gas Control, 2010, 4: 623-629.
Review of Lithium Silicate Ceramic for High Temperature CO2Capture
QIU Yaqin1, WANG Wenzhe2, CHEN Xiaoxiang2, WANG Shaolong2
(1. School of Optical and Electronic Information, Huazhong University of Science and Technology, Wuhan 430074, Hubei, China; 2. State Key Laboratory of Coal Combustion, Huazhong University of Science and Technology, Wuhan 430074, Hubei, China)
The greenhouse effect which is mainly caused by carbon dioxide has become a global concern. CO2capture and storage (CCS) is an effective technology that enables the capture of CO2from fuel combustion or industrial processes and its storage underground, thereby preventing it from entering the atmosphere. Recent research process on the capture of CO2from high temperature flue gas by lithium silicate ceramic material is summarized, including the theory of CO2capture, the preparation of lithium silicate ceramic materials, the factors affecting CO2capture capacity, as well as the technological process of CO2capture from high temperature flue gas. Furthermore, challenges and future work for the development of this field are proposed.
carbon dioxide; lithium silicate ceramics; high temperature separation; coal combustion
TQ174.75
A
1000-2278(2015)05-0447-06
10.13957/j.cnki.tcxb.2015.05.001
2015-06-05。
2015-06-15。
国家自然科学基金项目(编号:51376074)。
邱亚琴(1964-),女,高级工程师。
Received date: 2015-06-05. Revised date: 2015-06-15.
Correspondent author:QIU Yaqin(1964-), female, Professor.
E-mail: qyqkx@sohu.com

