RISK信号通路在1-磷酸鞘氨醇后适应减轻心肌细胞缺氧/复氧损伤中的作用
王雨晴,吴艳娜,李 欣,尹永强,康 毅,娄建石,温 克
(天津医科大学基础医学院药理学教研室,天津 300070)
RISK信号通路在1-磷酸鞘氨醇后适应减轻心肌细胞缺氧/复氧损伤中的作用
王雨晴,吴艳娜,李欣,尹永强,康毅,娄建石,温克
(天津医科大学基础医学院药理学教研室,天津300070)
中国图书分类号:R322.11;R329.25;R542.2;R845.22;R977.3
摘要:目的研究再灌注损伤挽救激酶(reperfusion injury salvage kinase,RISK)信号通路在1-磷酸鞘氨醇(sphingosine-1-phosphate,S1P)后适应减轻H9c2心肌细胞缺氧/复氧损伤中的作用。方法将H9c2细胞随机分为7组,即(1)正常对照组(C);(2)缺氧/复氧组(H/R);(3)S1P组;(4)S1P+LY294002组(S1P+LY);(5)LY组;(6)S1P+PD98059组(S1P+PD);(7)PD组。采用MTT法测定各组细胞存活率;比色法测定丙二醛(MDA)含量、总超氧化物歧化酶(T-SOD)和锰超氧化物歧化酶(Mn-SOD)活力;采用激光共聚焦显微镜技术检测细胞内游离钙离子浓度变化;流式细胞仪检测心肌细胞凋亡率;Western blot法测定Akt和ERK1/2蛋白的磷酸化水平。结果与H/R组比较,S1P组可明显增加H9c2细胞缺氧/复氧损伤后细胞存活率及凋亡率,增加T-SOD及Mn-SOD活力,降低MDA含量,降低钙离子浓度,增加Akt和ERK1/2磷酸化水平,而PI3K/Akt信号通路阻断剂LY294002或ERK1/2阻断剂PD98059可阻断S1P对H9c2的上述作用。 结论S1P能够减轻H9c2细胞缺氧/复氧损伤, 加入PI3K/Akt抑制剂LY294002和ERK1/2抑制剂PD98059均使S1P 的保护作用被取消,表明S1P通过RISK信号通路发挥抗H9c2细胞缺氧/复氧损伤作用。
关键词:S1P;缺氧/复氧;H9c2细胞;PI3K/Akt;ERK1/2;RISK
再灌注损伤挽救激酶(reperfusion injury salvage kinase,RISK)信号通路是抗心肌缺血/再灌注损伤的主要机制,该信号通路主要包括促生存激酶磷脂酰肌醇-3激酶(phosphatidylinositol-3-kinase,PI3K)和细胞外信号调节蛋白激酶1/2(extracellular signal-regulated kinase 1/2,ERK1/2),两者均为丝氨酸/苏氨酸激酶。很多实验已表明PI3K和ERK1/2磷酸化参与缺血预适应及药物介导的抗心肌缺血/再灌注损伤过程[1-2]。前者激活后能够促进下游靶蛋白内皮一氧化氮合酶(endothelial NO synthase,eNOS)、p70S6K、GSK-3β的磷酸化,从而抑制mPTP的开放而发挥保护作用[3]; ERK1/2信号通路激活能够抑制蛋白酶caspase-3的激活,从而抑制心肌细胞凋亡。两条信号通路的激活均能够抑制促凋亡蛋白Bim、Bax、Bad的表达,从而使缺血心肌细胞免于坏死或凋亡[4]。1-磷酸鞘氨醇(sphingosine 1-phosphate,S1P)是细胞神经鞘磷脂代谢产物之一[5]。本实验室前期研究发现,S1P后适应抑制炎症反应、拮抗氧化应激、保护线粒体结构功能,减轻大鼠心肌缺血/再灌注损伤,亦可缓解心肌细胞缺氧/复氧损伤[6-7]。上述作用是否与RISK通路有关,需进一步的实验加以验证。本实验拟观察S1P后适应对RISK通路中关键成分Akt和ERK1/2磷酸化的影响,以及PI3K/Akt抑制剂LY294002、ERK1/2抑制剂PD98059对S1P后适应保护作用的影响,以明确S1P后适应保护作用与RISK通路的相关性。
1材料
H9c2 心肌细胞株(中国协和医科大学基础医学研究所细胞中心);S1P(批号:032M4103V)、PI3K/Akt抑制剂(LY294002,LY)(批号:092M4616V)、ERK1/2抑制剂(PD98059,PD)(批号:MFCD00671789)均购自美国Sigma公司;Fura-3/AM(江苏碧云天生物技术研究所,批号:20140113);Annexin V-FITC细胞凋亡检测试剂盒(北京嘉美生物公司,批号:4AD271211F);anti-p-Akt(ser473)(美国Santa Cruz Biotechnology公司,批号:20131210);anti-Akt(美国Cell Signaling Technology公司,批号:20120319);辣根过氧化物酶标记山羊抗兔抗体(批号:970380)、辣根过氧化物酶标记山羊抗小鼠抗体(批号:107724)均购自北京中衫金桥生物技术有限公司; Olympus CK2 型倒置显微镜(日本Olympus公司);Model 680 型酶标仪(美国BIO-RAD 公司);缺氧箱(美国Billups-rothenberg 公司);FACS Calibur型流式细胞仪(美国BD 公司);FV1000型激光共聚焦显微镜(日本Olympus公司)。
2方法
2.1细胞分组将培养的大鼠H9c2细胞随机分为7组,即(1)正常(C)组:细胞在5% CO2、37℃培养箱中培养;(2)缺氧/复氧(H/R)组:细胞缺氧16 h后换用无血清的DMEM复氧培养4 h;(3)S1P组:缺氧处理16 h后,复氧前加入终浓度为4 μmol·L-1的S1P;(4)S1P+LY294002(S1P+LY)组:在复氧前加入终浓度为10 μmol·L-1的LY,处理30 min后加入S1P;(5)LY294002(LY)组:复氧前加入终浓度为10 μmol·L-1的LY;(6)S1P+PD98059(S1P+PD)组:在复氧前加入终浓度为50 μmol·L-1的PD,处理30 min后加入S1P;(7)PD98059(PD)组:复氧前加入终浓度为50 μmol·L-1的PD。
2.2模型的建立将H9c2 心肌细胞用模拟缺氧液置换正常培养液,用95% N2+5% CO2的混合气于37℃培养箱缺氧培养16 h;再换用含药DMEM低糖培养基在95% O2+5% CO2的正常培养条件下培养4 h,建立H/R损伤模型。
2.3测定指标
2.3.1细胞存活率正常组正常培养,其他组细胞经缺氧16 h 以及复氧4 h处理后,利用MTT法测定490 nm波长下每孔光吸收度值(OD 值),并按下述公式计算各组细胞存活率:细胞存活率/%=(各实验组OD值-空白对照组OD值)/(正常对照组OD值-空白对照组OD值)×100 %。
2.3.2MDA 含量、SOD 活性的检测造模给药处理后收集上清液,按MDA、SOD 试剂盒说明操作,比色法测定各组细胞培养液MDA 含量及SOD 活性。
2.3.3心肌细胞内钙离子测定造模给药处理后弃培养液,用PBS 冲洗2遍。加入500 μL含5 μmol·L-1Fluo-3 AM的PBS,37℃避光下负载40 min。PBS洗涤细胞后,避光孵育20 min。激光共聚焦显微镜下测定各组的荧光强度(激发波长:488 nm,发射波长:525 nm),用Image Pro Plus软件处理分析、计算各组的荧光强度。
2.3.4流式细胞仪检测心肌细胞凋亡百分率经处理后消化法收集细胞,采用Annexin V/PI 双染法对凋亡细胞进行染色,流式细胞仪测定荧光强度,并以Expo32软件处理分析、计算凋亡率。
2.3.5心肌细胞Western blot 检测经处理后裂解细胞,BCA 法蛋白定量,将蛋白样本进行SDS-PAGE 凝胶电泳,电转膜法将胶中蛋白转移至硝酸纤维素膜,封闭液室温封闭1 h,分别加入p-Akt、t-Akt、p-ERK 1/2、t- ERK 1/2一抗,4℃孵育过夜,二抗室温孵育1 h,加入ECL发光液1 min 显色。经显影、定影后测定特异性条带光密度值,并计算磷酸化蛋白与总蛋白的比值。
3结果
3.1细胞存活率H/R组细胞存活率明显低于正常对照组(P<0.01)。经S1P后处理后,S1P组细胞存活率明显高于H/R组(P<0.01)。与S1P组相比,加入LY294002 或PD98059以后细胞存活率明显降低,且与H/R组相比差异无显著性,见Tab 1。
Tab 1Effect of S1P, LY and PD on the viability of H9c2 cells,
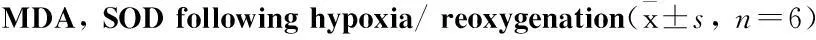

GroupCellviability/%MDA/nmol·L-1T-SOD/kU·L-1Mn-SOD/kU·L-1C100±0.000.85±0.09025.74±2.059.79±1.06H/R60.44±3.19**3.86±0.069**10.67±1.44**6.60±0.97**S1P73.13±1.21**##1.57±0.050**##19.46±1.31**##9.24±0.77**##S1P+LY63.41±2.74**▲▲2.94±0.072**▲▲13.60±1.46**▲▲5.01±0.61**▲▲LY53.64±2.69**3.21±0.062**13.49±1.74**4.98±0.69**S1P+PD62.64±4.54**▲▲3.04±0.097**▲▲13.54±2.53**▲▲5.11±0.64**▲▲PD54.40±1.06**3.29±0.081**12.55±1.52**5.05±0.78**
**P<0.01vscontrol group;##P<0.01vsH/R group;▲▲P<0.01vsS1P group
3.2细胞培养液中MDA含量和SOD含量与正常对照组相比,H/R组MDA含量明显升高(P<0.01),T-SOD、Mn-SOD活力明显降低(P<0.01);经S1P后处理后,S1P组的MDA含量明显降低(P<0.01),T-SOD、Mn-SOD活力明显提高(P<0.01);与S1P组相比,加入LY294002或PD98059以后,MDA含量明显增加(P<0.01),T-SOD、 Mn-SOD活力明显降低(P<0.01),且与H/R组相比差异无显著性,见Tab 1。
3.3细胞内游离钙离子的测定结果显示,经过H/R损伤后,细胞内钙离子的荧光强度明显增强,与正常对照组相比,差异有显著性(P<0.01);经过S1P处理后,细胞内钙离子的荧光强度明显降低,且与H/R组相比,差异有显著性(P<0.01);加入LY294002以后,细胞内钙离子的荧光强度明显增强,且与S1P组相比,差异有显著性(P<0.01)。加入PD98059以后,细胞内钙离子的荧光强度明显增强,且与S1P组相比,差异有显著性(P<0.01),见Tab 2及Fig 1。
Tab 2Effect of S1P, LY and PD on fluorescence intensity of

GroupFluorescenceintensityC0.54±0.033H/R2.77±0.110**S1P0.75±0.043**##S1P+LY1.27±0.038**▲▲LY1.55±0.036**S1P+PD1.27±0.032**▲▲PD1.88±0.023**
**P<0.01vscontrol group;##P<0.01vsH/R group;▲▲P<0.01vsS1P group
3.4细胞凋亡率测定结果表明,正常对照组细胞凋亡比较少,与正常对照组相比,H/R组细胞凋亡明显增加(P<0.01);经过S1P处理后的细胞凋亡率与H/R组相比明显下降(P<0.01);与S1P组相比,加入LY294002以后,细胞凋亡率明显升高(P<0.01),加入PD985059以后,细胞凋亡率明显升高(P<0.01),见Tab 3及Fig 2。
Tab 3Effect of S1P, LY and PD on the apoptotic rate


GroupApoptosisrate/%C8.53±0.38H/R28.83±1.23**S1P16.80±0.57**##S1P+LY23.46±0.91**▲▲LY28.09±0.65**S1P+PD27.60±0.83**▲▲PD38.00±0.78**
**P<0.01vscontrol group;##P<0.01vsH/R group;▲▲P<0.01vsS1P group

Fig 1 Effect of S1P, LY and PD on fluorescence intensity of intracellurar Ca2+ of H/R injury H9c2 cells by laser scanning confocal microscope
A: Control group; B: H/R group; C: S1P group; D: S1P+LY group; E: LY group; F: S1P+PD group; G: PD group

Fig 2 Effect of S1P, LY and PD on the apoptotic rate of H9c2 cells after H/R injury(n=3)
A: Control group; B: H/R group; C: S1P group; D: S1P+LY group; E: LY group; F: S1P+PD group; G: PD group
3.5p-Akt、t-Akt和p-ERK1/2、t- ERK1/2的蛋白表达变化Western blot结果显示,各组之间t-Akt蛋白、t-ERK1/2蛋白表达差异无显著性。与正常对照组相比,H/R处理能使p-Akt蛋白、p-ERK1/2蛋白表达明显增加(P<0.01);与H/R组相比,S1P组能明显增加p-Akt蛋白、p-ERK1/2蛋白表达(P<0.01);与S1P组相比,加入LY294002以后,p-Akt蛋白的表达明显降低(P<0.01),加入PD90589以后p-ERK1/2蛋白的表达明显降低(P<0.01),且与正常对照组相比均无明显变化。见Fig 3、4。

Fig 3 Effect of S1P and LY on the expression of
**P<0.01vscontrol group;##P<0.01vsH/R group;▲▲P<0.01vsS1P group
*P<0.05,**P<0.01vscontrol group;##P<0.01vsH/R group;▲▲P<0.01vsS1P group
4讨论
有研究表明,心肌缺血/再灌注损伤涉及多方面因素,如氧自由基生成增多、细胞内钙离子超载、线粒体损伤等[8]。当氧自由基的生成超过了机体内源性抗氧化系统的清除能力时,过多的氧自由基可引起脂质过氧化反应,并刺激线粒体细胞色素C的释放,后者可进一步激活caspase-9,诱导细胞凋亡。SOD是机体重要的内源性自由基清除剂,主要包括分布于线粒体的Mn-SOD以及分布于胞质的Cu/Zn-SOD,其活性的高低可间接反映机体消除ROS的能力[9]。MDA是脂质过氧化的产物,测试MDA的含量不仅可以反映心肌细胞膜结构的脂质过氧化程度,而且可间接反映氧自由基水平及氧化应激损伤的程度[10]。本实验发现,H/R组氧自由基增多,抗氧化能力减弱,细胞内钙离子增加,细胞凋亡率提高;而给予S1P能减轻细胞脂质过氧化损伤、提高细胞的抗氧化能力、减轻细胞内钙离子超载、抑制细胞凋亡。
RISK信号通路主要包括PI3K/Akt及ERK通路。PI3K/Akt通路广泛存在于细胞中,是参与细胞生长、增殖、分化调节的信号转导通路。ERK在正常心肌细胞中低表达,当受到I/R或者H/R的刺激时,ERK被激活并表达上调[11]。近年来研究显示,ERK信号通路在心肌I/R或者H/R中主要是发挥保护作用[12]。作为心肌保护重要的信号传导机制,很多研究已证实RISK信号通路在缺血预适应或后适应抗心肌缺血/再灌注损伤中的作用[12]。也有研究报道,药理性后适应(如七氟醚、阿片受体激动剂等)可通过激动PI3K-Akt或ERK1/2发挥心肌保护作用[13-14]。然而,离体心脏灌流实验研究报道,S1P受体激动剂FTY720k可激活Akt,促进LVDP恢复,但并没有缓解心肌损害,减少梗死面积[15]。本研究发现,S1P在保护缺氧/复氧损伤心肌细胞的同时,亦可提高p-Akt和p-ERK1/2水平,而应用LY294002阻断PI3K/Akt信号通路或者PD98059阻断ERK1/2信号通路,均可明显抑制S1P对心肌细胞的保护作用,表现为细胞存活率下降,MDA含量增加,细胞培养液中T-SOD和Mn-SOD的活性降低,细胞内钙离子的浓度增加,细胞凋亡率增加。
综上所述,S1P对缺氧/复氧诱导的H9c2细胞损伤的保护作用与激活RISK信号通路有关。关于S1P对其通路上下游蛋白的影响,本实验未进行验证,仍需进一步的研究。
参考文献:
[1]Cross T G, Scheel-Toellner D, Henriquez N V, et al. Serine/threonine protein kinases and apoptosis[J].ExpCellRes, 2000, 256(1): 34-41.
[2]Hausenloy D J, Yellon D M. New directions for protecting the heart against ischaemia reperfusion injury: targeting the reperfusion injury salvage kinase (RISK)-pathway [J].CardiovascRes, 2004, 61(3): 448-60.
[3]Cohen M V, Downey J M. Ischemic postconditioning: from receptor to end-effector [J].AntioxidRedoxSignal, 2011, 14(5): 821-31.
[4]Yatomi Y, Ohmori T, Rile G, et al. Sphingosine1-phosphate as a major bioactive lysophospholipid that is released from platelets and interacts with endothelial cells [J].Blood, 2000, 96(10): 3431-8.
[5]张丽志, 苏健, 温克. 1-磷酸鞘氨醇对过氧化氢所致微血管通透性增高的影响[J].中国现代应用药学, 2013, 30(1): 6-9.
[5]Zhang L Z, Su J, Wen K. Effect of sphingosine 1-phosphate on the increased microvessel permeability induced by H2O2[J].ChinJModApplPharm, 2013, 30(1):6-9.
[6]贺苗, 赵杰, 苏健, 等. 1-磷酸鞘氨醇后适应对大鼠心肌缺血/再灌注损伤的保护作用[J]. 中国药理学通报, 2013, 29(10): 1369-73.
[6]He M, Zhao J, Su J, et al. Protective effect of sphingosine 1-phosphate postconditioning on myocardial ischemia reperfusion injury in rats [J].ChinPhamacolBull, 2013, 29(10): 1369-73.
[7]郑新彬, 温克, 高卫真, 等. 1-磷酸鞘氨醇后适应对H9c2心肌细胞缺氧/复氧损伤的保护作用 [J]. 中国现代应用药学, 2014, 31(1):1-5.
[7]Zheng X B, Wen K, Gao W Z, et al. Protective effects of sphingosine-1-phosphate postconditioning on hypoxia/reoxygenation injury in rat H9c2 cardiomyocytes [J].ChinJModApplPharm, 2014, 31(1):1-5.
[8]Kaminski K A, Bonda T A, Korecki J, et al. Oxidative stress and neutrophil activation——the two keystones of ischemia/reperfusion injury [J].IntJCardiol, 2002, 86(1):41-59.
[9]Li Y, Huang T T, Carlson E J, et al. Dilated cardiomyopathy and neonatal lethality in mutant mice lacking manganese superoxide dismutase [J].NatGenet, 1995, 11(4): 376-81.
[10]Liu X, Guo Q L, Zhang Z, et al. Effect of emulsified isoflurane on apoptosis of anoxia-reoxygenation neonatal rat cardiomyocytes [J].AsianPacJTropMed, 2013, 6(12): 977-81.
[11]Li DY, Tao L, Liu H, et al. Role of ERKI/2 in the anti-apoptotic and cardioprotective effects of nitric oxide after myocardial ischemia and reperfusion [J].Apoptosis, 2006, 11(6): 923-30.
[12]Hausenloy D J, Yellon D M. Survival kinases in ischemic preconditioning and postconditioning [J].CardiovascRes, 2006, 70(2): 240-53.
[13]Fang N X, Yao Y T, Shi C X, et al. Attenuation of ischemia-reperfusion injury by sevoflurane postconditioning involves protein kinase B and glycogen synthase kinase 3 beta activation in isolated rat hearts [J].MolBiolRep, 2010, 37(8): 3763-9.
[14]Tong G, Sun Z, Wei X, et al. U50,488H postconditioning reduces apoptosis after myocardial ischemia and reperfusion [J].LifeSci, 2011, 88(1-2): 31-8.
[15]Hofmann U, Burkard N, Vogt C, et al. Protective effects of sphingosine-1-phosphate receptor agonist treatment after myocardial ischaemia-reperfusion [J].CardiovascRes, 2009, 83(2): 285-93.
网络出版时间:2015-1-9 13:37网络出版地址:http://www.cnki.net/kcms/doi/10.3969/j.issn.1001-1978.2015.02.008.html
Role of RISK signal pathway in reducing cardiomyocytes hypoxia/
reoxygenation injury induced by S1P postconditioning
WANG Yu-qing, WU Yan-na, LI Xin, YIN Yong-qiang, KANG Yi, LOU Jian-shi, WEN Ke
(DeptofPharmacology,SchoolofBasicMedicalSciences,TianjinMedicalUniversity,Tianjin300070,China)
Abstract:AimTo study the protective effects of sphingosine 1-phosphate (S1P) postconditioning on rat myocardial cells injured by hypoxia/reoxygenation in reperfusion injury salvage kinase (RISK) signal pathway. MethodsThe cultured rat H9c2 cells were randomly divided into seven groups: (1) control group; (2) hypoxia/reoxygenation (H/R) group; (3) S1P group; (4) S1P+LY294002 group(S1P+LY); (5) LY group; (6) S1P+PD98059 group(S1P+PD); (7) PD group. The viability of H9c2 cells was detected using MTT method. The content of MDA in the cultured medium and the activity of T-SOD and Mn-SOD were measured with colorimetry. The concentration of intracellular free calcium ion was detected by confocal microscopy. The rate of cell apoptosis was determined by flow cytometric analysis. Western blot was used to assess phosphorylation of Akt and ERK1/2 in H9c2 cells. ResultsCompared with the H/R group, S1P significantly increased vaibility of cells, lowered the rate of apoptosis, decreased the content of MDA in the culture medium, increased the activity of T-SOD and Mn-SOD, reduced concentration of intracellular calcium and increased the phosphorylation of Akt and ERK1/2. When added LY294002 or PD98059, the effects of S1P above were inhibited. ConclusionS1P protects H9c2 cells against hypoxia/reoxygenation injury. The protection of S1P was inhibited by LY294002, the inhibitor of PI3K/Akt and PD98059, the inhibitor of ERK1/2. S1P protects H9c2 cells against hypoxia/reoxygenation injury via RISK pathway.
Key words:S1P; hypoxia/reoxygenation; H9c2 cells; PI3K/Akt; ERK1/2; RISK
通讯作者温克(1974-),男,博士,副教授,硕士生导师,研究方向:心血管药理学,,E-mail:13820883653@163.com
作者简介:王雨晴(1991-),女,硕士生,研究方向:心血管药理学,E-mail: zlxxwyq@163.com;
基金项目:国家自然科学基金资助项目(No 81173058);国家自然科学基金青年基金资助项目(No 81102446);天津市自然科学基金资助项目(No 10JCZDJC20900)
收稿日期:2014-10-08,修回日期:2014-10-31
文献标志码:A
文章编号:1001-1978(2015)02-0181-05
doi:10.3969/j.issn.1001-1978.2015.02.008

