菲律宾蛤仔RP2基因的克隆及组织表达分析
裴爱君,杨艳津,秦艳杰,赵祥吉,闫喜武,李霞,王福景
(大连海洋大学 辽宁省贝类良种繁育工程技术研究中心,辽宁 大连 116023)
菲律宾蛤仔RP2基因的克隆及组织表达分析
裴爱君,杨艳津,秦艳杰,赵祥吉,闫喜武,李霞,王福景
(大连海洋大学 辽宁省贝类良种繁育工程技术研究中心,辽宁 大连 116023)
摘要:采用反转录PCR(RT-PCR)与cDNA末端快速克隆(RACE)法首次从壳长为28 mm的菲律宾蛤仔Ruditapes philippinarum外套膜中克隆出RP2基因(GenBank登录号:KF826881)。结果表明:RP2基因cDNA序列长度为1158 bp,包括62 bp的5′端非编码区,41 bp的3′端非编码区,开放阅读框1053 bp,编码350个氨基酸;推导的氨基酸序列具有TBCC(57aa~175aa)和CARP(65aa~102aa)保守结构域,并为非跨膜糖蛋白;经Blast同源性比较表明,菲律宾蛤仔RP2氨基酸序列与太平洋牡蛎Crassostrea gigas的相似性较高(56%),与高等哺乳动物、鸟类、鱼类、两栖类和节肢动物各模式动物之间的相似性为43%~53%,与非洲眼线虫Loa loa的相似性较低(33%);利用实时定量PCR技术检测RP2基因在菲律宾蛤仔不同组织中的表达,结果显示,RP2基因在菲律宾蛤仔雄性性腺中表达量最高,在鳃、水管和外套膜组织中次之,在斧足和闭壳肌中表达量极少,在雌性性腺中无表达。研究表明,RP2基因在菲律宾蛤仔各组织中的表达较为广泛,但不同组织的表达量存在明显差异,本研究结果可为无脊椎动物RP2基因的结构及其功能研究提供基础数据。
关键词:菲律宾蛤仔;视网膜色素变性基因2;分子克隆; 组织表达分析
视网膜色素变性(retinitis pigmentosa, RP)是一组具有显著临床及遗传异质性的遗传性眼病。在各遗传类型中,X染色体连锁遗传(X-linked retinitis pigmentosa, XLRP)临床表现最为严重,且发病年龄早,人一般在10岁前即发病,40岁前即可完全失明[1]。目前,XLRP已经定位7个基因位点,5个位于X染色体的短臂Xp(RP2、RP3、RP6、RP15、RP23),2个位于X染色体的长臂Xq(RP24、RP34)。人Homosapiens的RP2基因(GenBank登录号:NM_006915.2)于1998年被克隆,定位于Xp11.3,包含 5 个外显子, 编码含350 个氨基酸残基的多肽链[2]。视网膜色素变性2(retinitis pigmentosa 2, RP2),也称为TBCCD2,是一个含350个氨基酸的蛋白,定位于细胞胞质侧,属于TBCC家族。RP2蛋白具有促进微管蛋白GTP酶活性的功能,作为ADP核糖化类因子3(ARL3)的鸟苷酸解离抑制因子,可阻止GTP结合形式的ARL3解离。编码RP2基因的缺陷,会引起视网膜色素变性, 以感光细胞退化为发病特点,导致夜间视力失明,最终使外周和中枢视觉丧失[3-4]。通过连锁分析发现,大约20%的XLRP是由于RP2基因突变所致[5]。目前,对人RP2基因突变引发疾病的相关报道较多,在低等动物中,葛广韬等[6]研究了人RP2基因在果蝇Muscadomestica胚胎细胞中的表达,此项研究证明了人RP2基因在果蝇细胞中表达的可能性。斑马鱼DaniorerioRP2基因也已经被成功地克隆[7],并且研究表明,斑马鱼可以作为研究人类视网膜疾病的模式生物[8]。此外,在NCBI数据库中已有对太平洋牡蛎Crassostreagigas、紫球海胆Strongylocentrotuspurpuratus、玻璃海鞘Cionaintestinalis等多种海洋无脊椎动物RP2基因序列和预测蛋白的相关研究,但低等动物RP2基因的功能目前尚不清楚。
菲律宾蛤仔俗称蛤仔、花蛤、蚬子,在贝类分类学上隶属于软体动物门Mollusca、瓣鳃纲Lamellibranchia、异齿亚纲Heterodonate、帘蛤目Veneroida、帘蛤科Veneridae,广泛分布于中国沿海滩涂。菲律宾蛤仔是一种小型双壳贝类,喜埋栖于内湾风浪较小、水流畅通并有淡水注入的中低潮区的泥沙滩涂中。本研究中,采用RT-PCR和SMARTRACE法,从菲律宾蛤仔外套膜中首次克隆得到了RP2基因的cDNA序列,并采用Real-time PCR技术分析了RP2基因在菲律宾蛤仔不同组织中的表达情况,旨在丰富低等动物RP2基因的研究内容,并为该基因的功能研究提供基础数据。
1材料与方法
1.1材料
试验用菲律宾蛤仔购自大连市黑石礁水产市场,2龄,壳长为28 mm左右,壳宽为20 mm左右。于2012年3月购回后在实验室内暂养。
试验用TRIZOL、PrimeScriptTMRT-PCR Kit试剂盒、SMARTTMRACE(Clontech)试剂盒、琼脂糖凝胶DNA回收试剂盒、pMD©19-T Vector、感受态细胞大肠杆菌EscherichiacoliDH5α、Sybr green I(20×)和DEPC水均购自宝生物工程(大连)有限公司(TaKaRa)。试验用引物及DNA测序由上海生工生物工程有限公司完成。
1.2方法
1.2.1总RNA的提取和cDNA合成取健康个体进行解剖,获取外套膜后立即放入液氮中研磨,采用TRIZOL一步法进行Total RNA抽提,用10 g/L琼脂糖凝胶电泳检测总RNA的完整性,经纯化后将RNA于-80 ℃下保存。cDNA合成采用PrimeScriptTMRT-PCR Kit试剂盒,并按其说明书进行操作。
1.2.2RACE扩增基于辽宁省贝类良种繁育工程技术研究中心早期构建的菲律宾蛤仔转录组cDNA测序结果,所得ESTs经NCBI比对分析,发现一个EST 与RP2基因同源性较高。以此片段为目的片段,设计RACE扩增引物(表1),采用SMARTTMRACE试剂盒进行基因克隆。具体操作按照说明书方法进行,其中试剂盒中已有的引物UPM/NUP见表1。RACE扩增体系(共25 μL): 10×PCR Buffer 2.5 μL, MgCl2(25 mmol/L)2.0 μL,dNTP Mixture(各2.5 mmol/L)2.0 μL,Clontech中的引物UPM/NUP(10 μmol/L) 2.5 μL,RP2-3′/RP2-3′EN或RP2-5′/RP2-5′EN引物1.0 μL,rTaq酶(5 U/μL)0.25 μL,cDNA模板2.0 μL,ddH2O 12.75 μL。PCR反应程序:94 ℃下预变性5 min;94 ℃下变性30 s,51 ℃(3′RACE)/55 ℃(5′RACE)下退火30 s,72 ℃下延伸2 min,共进行35个循环;最后在72 ℃下再延伸10 min。
取5 μL PCR产物用10 g/L琼脂糖凝胶进行电泳检测,采用琼脂糖凝胶DNA回收试剂盒回收产物。将PCR产物纯化后连接到pMD19-T载体中,于16 ℃下连接过夜,然后转化至感受态细胞 DH5α中,涂布于含有IPTG、Amp、X-Gal的平板上,于培养箱中(37 ℃)过夜后挑取白菌,加入到含有Amp的1 mL液体培养液中进行扩大培养。将菌液进行PCR检测,引物为RV-M、M13-47(表1)。取检测合格的菌液送到上海生工生物工程有限公司进行测序。

表1 试验用引物序列
1.2.3序列分析与进化树的构建将菲律宾蛤仔RP2基因cDNA序列用DNAstar软件确定正确的开放阅读框,并翻译成氨基酸序列;利用Blast程序与NCBI数据库中的序列进行比对;利用ProParam在线工具进行氨基酸理化性质的分析;利用ProtScale在线工具分析氨基酸的亲水疏水性;利用SOPMA在线工具对蛋白的二级结构进行预测;利用在线工具TMHMM Server 2.0和Signal P 4.1 Server分别对蛋白的跨膜区域和信号肽进行预测;利用在线工具Predict Protein对蛋白的功能位点进行预测;利用NCBI中的CD Search功能预测蛋白的保守结构域;利用ClustalX 2.1软件和Mega 5.1软件采用邻位相连法(Neighbor-joining, NJ)在Bootstrap置信值为1000的条件下构建系统进化树。
1.2.4菲律宾蛤仔RP2基因组织特异性的表达分析随机选取实验室暂养的菲律宾蛤仔7只,分别取闭壳肌、斧足、水管、外套膜、鳃、雄性性腺和雌性性腺组织,按照“1.2.1”节中的方法进行RNA提取及cDNA合成。根据先期获得的菲律宾蛤仔RP2基因cDNA序列,设计Real-time PCR 引物RP2-F和RP2-R,选取β-actin为内参基因(表1)。
使用FTC2000(Canada)实时荧光定量PCR仪进行扩增,每个样品重复扩增检测3次。PCR扩增体系(共50 μL):PCR buffer(2×)25 μL,RP2基因上、下引物(25 pmol/μL)各1 μL,Sybr green I(20×)0.5 μL,模板(cDNA)2 μL,DEPC水20.5 μL。荧光定量PCR反应条件:94 ℃下预变性4 min;94 ℃下变性20 s,60 ℃下退火30 s,72 ℃下延伸30 s,共进行35次循环;最后在72 ℃下检测信号。将Real-time PCR检测结果导出,绘制标准曲线,采用2-ΔΔCt法分析目的基因的相对表达量,各组织间的表达量差异采用SPSS 17.0软件进行显著性分析和多重比较,显著性水平设为0.05。
2结果与分析
2.1菲律宾蛤仔RP2基因的序列分析
将测得的序列片段用DNAstar软件进行拼接,最终得到菲律宾蛤仔RP2基因cDNA序列(图1)。该cDNA序列长1158 bp,包括62 bp的5′端非编码区,43 bp的3′端非编码区,开放阅读框1053 bp,编码350个氨基酸。起始密码子为ATG,终止密码子为TGA。
蛤仔RP2蛋白分子式为C1761H2716N454O542S25,原子总数为5498,相对分子质量为39 711.1,理论等电点为4.76,在编码的350个氨基酸中,含有48个带负电荷的氨基酸残基(天冬氨酸+谷氨酸),33个带正电荷的氨基酸残基(精氨酸+赖氨酸)。总平均亲水性(GRAVY)为-0.236,脂肪指数为77.63,不稳定指数为40.01,因此,推算该蛋白为不稳定的亲水性蛋白。预测结果显示,菲律宾蛤仔RP2蛋白没有信号肽,属于非跨膜蛋白。该蛋白的二级结构中有α螺旋89个(占25.43%),延伸链87个(占24.86%),β折叠11个(占3.14%),无规卷曲163个(占46.57%),其二级结构主要由无规卷曲组成。
通过在线预测工具Predict Protein分析蛋白位点发现:该序列含有1个N-糖基化位点;1个cAMP和cGMP依赖性蛋白激酶磷酸化位点;1个蛋白激酶C磷酸化位点;10个酪蛋白激酶Ⅱ磷酸化位点;1个酪氨酸激酶磷酸化位点;3个N-豆蔻酰化位点。利用CD Search功能预测菲律宾蛤仔RP2蛋白的保守结构域发现,具有CARP(65aa~102aa)和TBCC(57aa~175aa)保守结构域。

注:方框字母为起始密码子(ATG)和终止密码子(TGA);阴影处为TBCC结构域;直线处为CARP结构域Note:The start codon(ATG) and stop codon(TGA) are boxed;the TBCC domain is shaded; the CARP domain is lined图1 菲律宾蛤仔RP2基因 cDNA序列及推导的氨基酸序列Fig.1 cDNA and predicted amino acid sequences of RP2 gene in Manila clam Ruditapes philippinarum
2.2RP2氨基酸序列比对及系统进化分析
将推导的菲律宾蛤仔RP2氨基酸序列使用在线NCBI工具进行Blast同源性比较(表2),结果表明,菲律宾蛤仔RP2氨基酸序列与太平洋牡蛎的相似性为56%,与红鳍东方鲀Takifugurubripes的相似性为53%,与褐家鼠Rattusnorvegicus的相似性为52%,与高等哺乳动物、鸟类、鱼类、两栖类和节肢动物各模式动物之间的相似性为49%~53%,但与紫球海胆Strongylocentrotuspurpuratus的相似性较低,为43%,与非洲眼线虫Loaloa的相似性仅为33%。
表2RP2氨基酸序列的同源性比对
Tab.2Comparative identity of amino acid sequence of RP2

物种(GenBank登录号)species(GenBankaccessionNo.)相似性/%identity太平洋牡蛎Crassostreagigas(EKC30628)56人Homosapiens(NP_008846)51倭黑猩猩Panpaniscus(XP_003809725)51非洲象Loxodontaafricana(XP_003418016)51野猪Susscrofa(XP_003360330)51犬Canislupusfamiliaris(XP_548972.251)51佛罗里达海牛Trichechusmanatuslatirostris (XP_004376963)51褐家鼠Rattusnorvegicus(NP_001102482)52鸡Gallusgallus(NP_001008680)49非洲爪蟾Xenopus(Silurana)tropicalis(XP_002937023)51红鳍东方鲀Takifugurubripes(XP_003973879)53青斑河豚Tetraodonnigroviridis(CAG01390)52斑马鱼Daniorerio(ADR82635)49紫球海胆Strongylocentrotuspurpuratus(XP_797121)43玻璃海鞘Cionaintestinalis(XP_002121234)50非洲眼线虫Loaloa(EFO16689.2)33
菲律宾蛤仔RP2氨基酸序列通过GenBank数据库比较,经Clustal W多重序列比对分析,结果显示,菲律宾蛤仔RP2与太平洋牡蛎、褐家鼠、红鳍东方鲀等RP2在CARP和TBCC结构域的氨基酸序列呈现较高的保守性。脊椎动物RP2氨基酸序列N末端具有非常保守的双酰基化位点(M-G-C-X-F-S-K),而在菲律宾蛤仔、太平洋牡蛎、紫球海胆、玻璃海鞘和眼线虫等无脊椎动物中,这些位点保守性较低。
应用Mega 5.1 软件在Bootstrap置信值为1000的条件下构建系统进化树,该进化树直观地显示了菲律宾蛤仔RP2氨基酸序列与其他各物种之间的相互关系(图2)。从图2可见:菲律宾蛤仔与太平洋牡蛎先聚为一支;无脊椎动物中的紫球海胆、玻璃海鞘和非洲眼线虫分别单独聚为一支;硬骨鱼类聚为一支,并分别逐级与爬行类、鸟类和哺乳动物聚在一起。
2.3RP2基因的组织表达分析
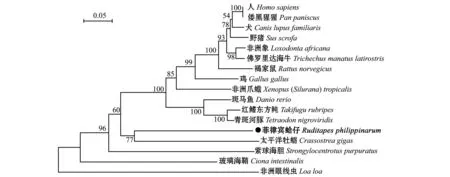
图2 根据不同物种RP2氨基酸序列构建的系统进化树Fig.2 Phylogenetic tree constructed for amino acid sequences of RP2 in different species
荧光实时定量PCR结果表明,RP2基因在菲律宾蛤仔闭壳肌、斧足、水管、外套膜、鳃、雄性性腺中均有表达,但在雌性性腺中无表达(图3)。经单因素方差分析表明,各组织中的表达量依次为雄性性腺>鳃>水管≈外套膜>斧足≈闭壳肌>雌性性腺。可见,RP2基因在菲律宾蛤仔雄性性腺中表达量最高,与其他组织存在显著性差异(P<0.05),腮中的表达量与水管、外套膜也表现出显著性差异(P<0.05),但水管和外套膜之间的表达量相差不大(P>0.05),闭壳肌和斧足表达量很少,而雌性性腺中无表达。
3讨论
自RP2基因被首次克隆以来,迄今为止,已有猕猴Macacamulatta[9]、牛Bostaurus[10]、小家鼠Musmusculus[11]、褐家鼠[12]、鸡[13]、非洲爪蟾[14]等RP2基因被克隆。本研究中获得的菲律宾蛤仔RP2基因cDNA序列为1158 bp,编码350个氨基酸。通过序列比对发现,菲律宾蛤仔RP2氨基酸序列与其他物种RP2氨基酸序列有着较高的同源性(50%左右)。这些生物的RP2蛋白分子具有保守的CARP结构域,并且N末端均存在与微管特异性分子伴侣辅助因子C(TBCC)同源序列。

注:标有不同小写字母者表示组间有显著性差异(P<0.05)Note:The means with different letters are significant differences at the 0.05 probability level图3 菲律宾蛤仔各组织中RP2基因的mRNA相对表达量Fig.3 Relative quantity of RP2 expressions in the different tissues of Manila clam Ruditapes philippinarum
TBCC通过与其他微管折叠辅助因子及GTP结合蛋白Arl2相互作用,参与微管蛋白生物的合成[15-16]。RP2蛋白能够像辅助因子C一样,与辅助因子D结合后促进微管蛋白GTP酶的活性,参与微管蛋白生物的合成。然而在脊椎动物中,RP2蛋白氨基酸序列C末端出现的类似核苷二磷酸激酶(NDks)保守结构域,在低等动物如紫球海胆、玻璃海鞘和非洲眼线虫RP2蛋白氨基酸序列中却没有出现,预测的菲律宾蛤仔RP2氨基酸序列也没有出现该保守区。人类NDk1被证实具有3′至5′外切酶活性,研究也表明,人RP2可能具有DNA损伤响应因子和3′至5′外切酶活性[17]。因此推测,低等动物RP2可能不具有这样的功能。人的RP2蛋白氨基酸序列N末端的蛋氨酸M-甘氨酸G-半胱氨酸C-X-苯丙氨酸F-丝氨酸S-赖氨酸K-精氨酸序列具有双酰基化位点,这对于蛋白膜定位是非常重要的,研究发现,该序列的第5位苯丙氨酸、第6位丝氨酸和第8位精氨酸突变会影响RP2蛋白,使其不能在质膜上正确定位,从而引起X染色体连锁遗传[18-19]。本试验中得到的PR2氨基酸序列中,第5位和第6位氨基酸均为亮氨酸L,而第8位为丝氨酸。因此,菲律宾蛤仔RP2氨基酸残基的特异性可能使RP2基因在蛤仔中发挥着不同于脊椎动物的作用,该基因在无脊椎动物中的功能研究亟待开展。
菲律宾蛤仔不同组织中RP2基因的表达情况显示,RP2基因在雄性性腺中表达量最高,比其他组织高出2个数量级。RP2基因在鳃、水管、外套膜中有相对较高的表达,在闭壳肌、斧足中表达量极低,在雌性性腺中无表达。有研究表明,雌性小鼠受到睾酮诱导后,肾脏中的RP2基因升高了10~12倍,这主要是由于转录及转录后水平升高造成的[20]。尽管RP2基因的表达受到雄性激素的诱导,但目前尚不清楚具体的原因。本研究中发现,蛤仔雄性性腺中RP2基因表达量最高,而雌性性腺中无表达,推测该基因可能受到雄性性腺发育过程中一些信号的诱导,但由于低等脊椎动物没有类似于哺乳动物的雄性激素,其诱导原因有待进一步探讨。贝类外套膜上具有外套眼的结构,有研究表明,与脊椎动物比较起来,贝类的外套眼结构较低等,只是接受光的刺激,传导光冲动的线路[21]。但该基因在外套膜中的表达量并不是最高,反而极显著低于雄性性腺,也显著低于鳃组织。有研究表明,斑马鱼的RP2基因在早期发育阶段就开始表达且可以延续至成体,基因敲除后发现,斑马鱼躯干弯曲,眼睛较小,且视网膜上出现了细胞死亡的现象。也有报道指出,RP2基因在高尔基体与纤毛间囊泡的运输和融合过程中起重要作用[22-23],因此,作者推测,RP2基因在蛤仔各组织中分布广泛,可能参与囊泡运输、微管形成等多项生物学活动。至于RP2基因在外套眼及其他组织器官发生发育过程中的功能还有待进一步探讨。
参考文献:
[1]Bird A C.X-linked retinitis pigmentosa[J].British Journal of Ophthalmology,1975,59(4):177-199.
[2]Schwahn U,Lenzner S,Dong J,et al.Positional cloning of the gene for X-linked retinitis pigmentosa 2[J].Nature Genetics,1998,19(4):327-332
[3]Schwahn U,Paland N,Techritz S,et al.Mutations in the X-linkedRP2 gene cause intracellular misrouting and loss of the protein[J].Human Molecular Genetics,2001,10(11):1177-1183.
[4]Patil S B,Hurd T W,Ghosh A K,et al.Functional analysis of retinitis pigmentosa 2 (RP2) protein reveals variable pathogenic potential of disease-associated missense variants[J].PloS One,2011,6(6):e21379.
[5]Hardcastle A J,Thiselton D L,Van Maldergem L,et al.Mutations in the RP2 gene cause disease in 10% of families with familial X-linked retinitis pigmentosa assessed in this study[J].American Journal of Human Genetics,1999,64(4):1210-1215.
[6]葛广韬,邓可京,王谨,等.人RP2基因在果蝇胚胎细胞中的表达[J].复旦学报:自然科学版,2001,40(5):497-499.
[7]Shu X,Zeng Z,Gautier P,et al.Knockdown of the zebrafish ortholog of the retinitis pigmentosa 2 (RP2) gene results in retinal degeneration[J].Investigative Ophthalmology & Visual Science,2011,52(6):2960-2966.
[8]Raghupathy R K,McCulloch D L,Akhtar S,et al.Zebrafish model for the genetic basis of X-linked retinitis pigmentosa[J].Zebrafish,2013,10(1):62-69.
[9] Yan G,Zhang G,Fang X,et al.Genome sequencing and comparison of two nonhuman primate animal models,the cynomolgus and Chinese rhesus macaques[J].Nature Biotechnology,2011,29(11):1019-1023.
[10]Smith T P L,Grosse W M,Freking B A,et al.Sequence evaluation of four pooled-tissue normalized bovine cDNA libraries and construction of a gene index for cattle[J].Genome Research,2001,11(4):626-630.
[11]Skarnes W C,Rosen B,West A P,et al.A conditional knockout resource for the genome-wide study of mouse gene function[J].Nature,2011,474:337-342.
[12]Sharon D,Bruns G A P,McGee T L,et al.X-linked retinitis pigmentosa:mutation spectrum of the RPGR and RP2 genes and correlation with visual function[J].Investigative Ophthalmology & Visual Science,2000,41(9):2712-2721.
[13]Caldwell R B,Kierzek A M,Arakawa H,et al.Full-length cDNAs from chicken bursal lymphocytes to facilitate gene function analysis[J].Genome Biology,2004,6(1):R6.
[14]Klein S L,Strausberg R L,Wagner L,et al.Genetic and genomic tools for Xenopus research:the NIH Xenopus initiative[J].Developmental Dynamics,2002,225(4):384-391.
[15]Kortazar D,Fanarraga M L,Carranza G,et al.Role of cofactors B (TBCB) and E (TBCE) in tubulin heterodimer dissociation[J].Experimental Cell Research,2007,313(3):425-436.
[16]Kirik V,Mathur J,Grini P E,et al.Functional analysis of the tubulin-folding cofactor C inArabidopsisthaliana[J].Current Biology,2002,12(17):1519-1523.
[17]Yoon J H,Qiu J,Cai S,et al.The retinitis pigmentosa-mutated RP2 protein exhibits exonuclease activity and translocates to the nucleus in response to DNA damage[J].Experimental Cell Research,2006,312(8):1323-1334.
[18]Chapple J P,Hardcastle A J,Grayson C,et al.Delineation of the plasma membrane targeting domain of the X-linked retinitis pigmentosa protein RP2[J].Investigative Ophthalmology & Visual Science,2002,43(6):2015-2020.
[19]Chapple J P,Hardcastle A J,Grayson C,et al.Mutations in the N-terminus of the X-linked retinitis pigmentosa protein RP2 interfere with the normal targeting of the protein to the plasma membrane[J].Human Molecular Genetics,2000,9(13):1919-1926.
[20]Rheaume C,Barbour K W,Tseng-Crank J,et al.Molecular genetics of androgen-inducible RP2 gene transcription in the mouse kidney[J].Molecular and Cellular Biology,1989,9(2):477-483.
[21]安育新,袁付,刘卫东,等.海湾扇贝外套眼结构的初步观察[J].水产科学,1999,18(2):24-25.
[22]Holopainen J M,Cheng C L,Molday L L,et al.Interaction and localisation of the retinitis pigmentosa protein RP2 and NSF in retinal photoreceptor cells[J].Biochemistry,2010,49:7439-7447.
[23]Evans R J,Schwarz N,Nagel-Wolfrum U,et al.The retinitis pigmentosa protein RP2 links pericentriolar vesicle transport between the Golgi and the primary cilium[J].Human Molecular Genetics,2010,19:1358-1367.
Cloning and expression ofRP2 gene in tissues of
Manila clamRuditapesphilippinarum
PEI Ai-jun, YANG Yan-jin, QIN Yan-jie, ZHAO Xiang-ji, YAN Xi-wu, LI Xia, WANG Fu-jing
(Engineering Research Center of Shellfish Culture and Breeding in Liaoning Province, Dalian Ocean University, Dalian 116023, China)
Abstract:In this study, Retinitis Pigmentosa 2 (RP2) gene was cloned from mantles of Manila clam Ruditapes philippinarum with shell length of 28 mm using reverse transcription PCR (PT-PCR) and rapid amplification of cDNA ends (RACE) method. The results showed that the RP2 gene cDNA (GenBank accession No. KF826881) had length of 1158 bp, including a 62 bp 5′-untranslated region, a 41 bp 3′-untranslated region and a 1053 bp open reading frame, encoding a 350 amino acid protein. There were tubulin-specific chaperone protein cofactor (TBCC, 57aa-175 aa) homology domain and CARP(65aa-102 aa)conserved motif in the deduced amino acid sequence. Alignment of the RP2 protein sequence with orthologs from those of known species in NCBI showed that the RP2 protein sequence shared 56% of amino acid identity with sea urchin, 43%-53% with mammals, birds, fish, amphibians and Arthropoda. There was relatively low identity between Manila clam and nematode Loa loa (33%). Real-time PCR analysis of the expression profiling of RP2 gene in different tissues in the clam revealed that the maximal expression was observed in testis, followed in gill, siphon and mantle, the minimal in foot and adductor, and no expression in ovary, indicating that RP2 gene was expressed ubiquitously, without significant differences in different tissues. The findings provide basic information for understanding of the gene structure and function of RP2 gene in invertebrate and buried clams.
Key words:Ruditapes philippinarum; RP2 gene; molecular clone; tissue expression analysis
通信作者:秦艳杰(1977—), 女, 博士, 副教授。E-mail: qinyanjie@dlou.edu.cn
作者简介:裴爱君(1989—), 女, 硕士 研究生。E-mail:peiaijun@yeah.net
基金项目:国家现代农业产业技术体系建设专项(CARS-48)
收稿日期:2014-06-09
中图分类号:S917.4
文献标志码:A
文章编号:2095-1388(2015)02-0132-06
DOI:10.3969/J.ISSN.2095-1388.2015.02.004

