紫蛇尾皂苷的初步纯化和生物学活性研究
邵知扬,李智博,董淑梅,赵前程,祁艳霞,李伟
(大连海洋大学 食品科学与工程学院,辽宁省水产品加工及综合利用重点实验室,辽宁 大连 116023)
紫蛇尾皂苷的初步纯化和生物学活性研究
邵知扬,李智博,董淑梅,赵前程,祁艳霞,李伟
(大连海洋大学 食品科学与工程学院,辽宁省水产品加工及综合利用重点实验室,辽宁 大连 116023)
摘要:对紫蛇尾Ophiopholis mirabilis皂苷粗提物进行初步纯化,并对所得产物的抑菌活性、抑制α-葡萄糖苷酶活性和细胞毒活性进行了研究。采用AB-8大孔吸附树脂初步纯化紫蛇尾皂苷粗提物,采用香草醛—高氯酸法测定总皂苷含量,采用滤纸片法测定抑菌活性,采用比色法和MTT法分别测定α-葡萄糖苷酶和MCF-7人乳腺癌细胞的抑制率。结果表明:纯化后的紫蛇尾皂苷纯度增加至48.57%;皂苷粗提物及纯化物的抑菌活性表现一致,均对枯草芽孢杆菌Bacillus subtilis具有明显的抑制作用,且纯化物的抑菌效果略强;皂苷粗提物对α-葡萄糖苷酶的抑制效果明显,大孔树脂95%乙醇洗脱所得纯化物的抑制率达到94.62%;皂苷粗提物及纯化物对MCF-7人乳腺癌细胞均表现出了很强的细胞毒活性,其中大孔树脂60%、75%、95%乙醇洗脱所得纯化物的浓度为300 μg/mL时,细胞抑制率均高达97%以上。研究表明,紫蛇尾皂苷粗提物及纯化物均表现出了很强的选择性抑菌活性、α-葡萄糖苷酶抑制活性和对MCF-7人乳腺癌细胞的细胞毒活性,且纯化物的活性增强。
关键词:紫蛇尾皂苷;抑菌;抑制α-葡萄糖苷酶;细胞毒活性
皂苷(saponins)又名皂素或皂草苷,是苷元为三萜或螺旋甾烷类化合物的一类糖苷,主要分布于陆地维管植物中,也少量存在于海星和海参等海洋生物中[1]。皂苷作为次级代谢产物之一,具有多种生物学活性。其中,海洋棘皮动物皂苷的活性表现在溶血、细胞毒性、抗肿瘤、抗氧化、免疫调节等多个方面[2-5]。
紫蛇尾Ophiopholismirabilis隶属于棘皮动物门Echinodermata 、蛇尾纲Ophiuroidea、颚蛇尾压目Gnathophiurina、辐蛇尾科Ophiactidae、紫蛇尾属Ophiopholis,在黄海中部和北部、大连、旅顺、海洋岛、长岛、烟台和青岛外海海域大量分布[6-7]。目前,有关紫蛇尾活性物质的研究主要集中于多糖、胶原蛋白、皂苷的提取制备方面[8-10],而关于紫蛇尾皂苷活性研究的报道较少。本研究中,以大连海域的紫蛇尾为原料,提取紫蛇尾皂苷并进行初步纯化,研究粗提物及纯化物的抑菌作用及对α-糖苷酶的抑制作用和对MCF-7人乳腺癌细胞的细胞毒活性,以期在充分利用蛇尾资源及海洋药物先导化合物研究方面提供准确的科学依据,为深入研究海洋棘皮动物活性成分奠定基础。
1材料与方法
1.1材料
试验用紫蛇尾产于黄海海域,采自大连獐子岛附近海域。样品采集后洗净泥沙,自然风干,阴凉处自然晾干,用高速万能粉碎机粉碎后,过80目筛备用。
主要试剂主要有:齐墩果酸标准品,购自大连博迈科技发展有限公司;AB-8型大孔树脂,购自天津恒兴化学试剂制造有限公司;α-葡萄糖苷酶、PNPG(4-硝基苯-α-D-吡喃葡萄糖苷),均购自美国Sigma公司;RPMI-1640培养基、胎牛血清,由美国Thermo有限公司提供;四甲基偶氮唑盐(MTT),由美国AMRESCO有限公司提供;正丁醇、乙醇、高氯酸、甲醇、石油醚、乙酸乙酯等试剂均为分析纯。
供试菌种为大肠杆菌Escherichiacoli、枯草芽孢杆菌Bacillussubtilis、产气杆菌Aerobacteraerogenes、金黄色葡萄球菌Staphylococcusaureus、变形杆菌Proteusbacillusvulgaris,由大连海洋大学食品科学与工程学院微生物实验室提供并鉴定。主要仪器与设备:721型分光光度计、JY92-IIDN型超声波细胞粉碎机、RE-52AA旋转蒸发器、LDZX-45SC型蒸汽压力灭菌器、酶标仪、TS100倒置显微镜。
1.2方法
1.2.1紫蛇尾皂苷的初步纯化及含量测定取一定量的紫蛇尾粉经超声细胞粉碎提取后(超声条件:溶剂65%乙醇、时间20 min、功率400 W、料液比1 g∶20 mL),70 ℃水浴回流2 h,取出后滤掉残渣,浓缩滤液经石油醚萃取脱脂(3次)后,再经水饱和正丁醇萃取至上层无色,合并正丁醇部分,减压浓缩得到浓缩液,即为紫蛇尾皂苷粗提物。
将80 g皂苷粗提物溶于蒸馏水中,上样于AB-8型大孔吸附树脂柱(规格为100 cm×8 cm)。上样后先用水洗,除去极性大的杂质,随后再依次分别用4倍柱体积的蒸馏水、4倍柱体积的20%乙醇、4倍柱体积的40%乙醇、4倍柱体积的50%乙醇、5倍柱体积的60%乙醇、5倍柱体积的75%乙醇、6倍柱体积的95%乙醇进行梯度洗脱,分别收集洗脱液并旋转蒸干,得皂苷纯化物。
采用香草醛-高氯酸法测定总皂苷含量[11]。
1.2.2紫蛇尾皂苷生物学活性的测定采用滤纸片法测定紫蛇尾皂苷粗提物及纯化物的抑菌活性[12],采用比色法测定抑制α-葡萄糖苷酶的活性[13],采用MTT法测定MCF-7人乳腺癌细胞的细胞毒活性,具体参照文献[14]中的方法。
1.3数据处理
试验数据均用平均值±标准差(mean±S.D.) 表示,采用SPSS 17.0软件进行方差分析,采用t检验进行组间差异比较,显著性水平设为0.05。
2结果与讨论
2.1紫蛇尾皂苷的分离提纯及皂苷含量的测定
紫蛇尾皂苷经大孔树脂初步纯化后,各洗脱所得纯化物皂苷纯度如表1所示,随乙醇浓度的升高,洗脱效率不断提高。其中, 95%乙醇对皂苷的洗脱作用最强,洗下来的皂苷量较多,且纯度最高,可达到48.57%,说明95%的乙醇与蛇尾皂苷的极性最为接近。
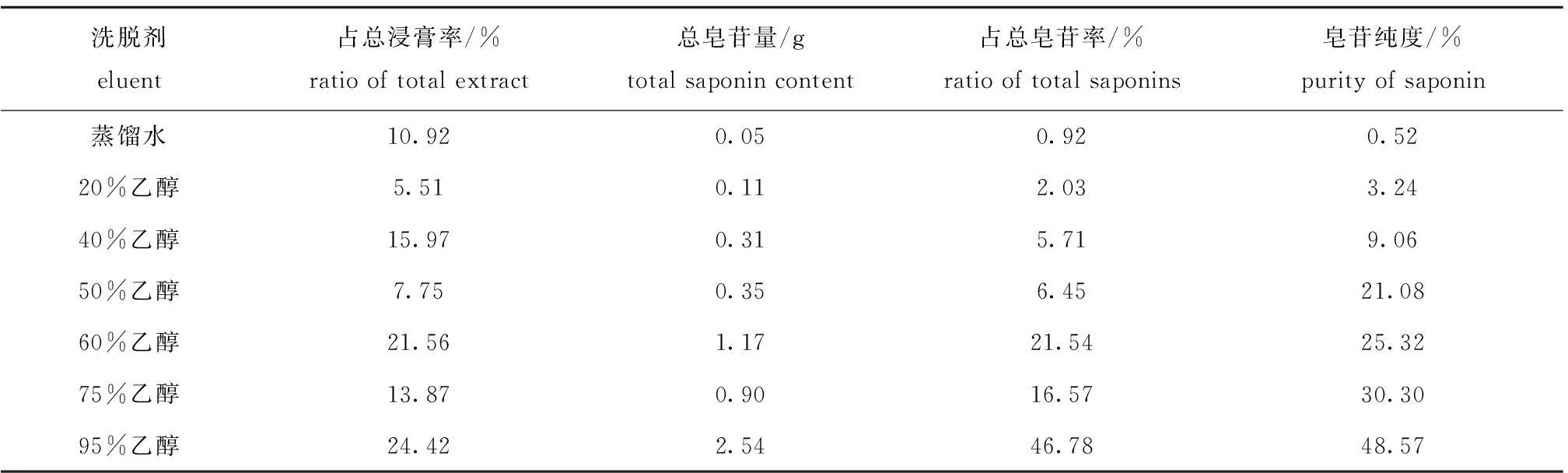
表1 不同浓度乙醇洗脱效率的比较
2.2紫蛇尾皂苷的抑菌活性
由表2可知,紫蛇尾皂苷粗提物对5种指示菌的抑制作用随着皂苷粗提物浓度的增加而增大,浓度为45 mg/mL的皂苷粗提物对产气杆菌有较强的抑制作用,对金黄色葡萄球菌的抑制作用较弱,说明紫蛇尾皂苷粗提物对不同供试菌种的抑制作用具有选择性。统计结果显示,各个浓度的皂苷粗提物的抑菌作用与对照组均无显著性差异,说明皂苷粗提物整体抑菌活性较弱。
表3为皂苷纯化物在浓度为45 mg/mL时的抑菌结果。从表3可见,大孔树脂40%乙醇洗脱所得纯化物几乎没有抑菌活性,50%、60%乙醇洗脱所得纯化物对5种指示菌都有很强的抑制活性,以50%乙醇洗脱所得纯化物的抑制活性最强。统计结果显示,50%乙醇洗脱和60%乙醇洗脱所得纯化物的抑菌圈直径与阳性对照组均有极显著或显著性差异(P<0.01或P<0.05)。50%乙醇洗脱所得纯化物对指示菌的抑菌圈直径最高可达18.00 mm,远远高于皂苷粗提物的抑菌效果。此外,各个纯化物对枯草芽孢杆菌的抑制作用普遍较好,这与皂苷粗提物的抑菌结果相吻合。李笑梅等[15]研究发现,菜豆皂苷也表现出选择性的抑菌活性,即对枯草芽孢杆菌、白色葡萄球菌、大肠杆菌都有不同程度的抑制作用,但对黑曲霉菌没有抑制作用。

表2 紫蛇尾皂苷粗提物的抑菌作用(n=3)
注:—代表无抑菌圈,*表示与阳性对照组有显著性差异(P<0.05);**表示与阳性对照组有极显著性差异(P<0.01),下同
Note:—indicates no inhibition circle; *means significant difference compared with the control (P<0.05);**means very significant difference compared with the control(P<0.01),et sequentia
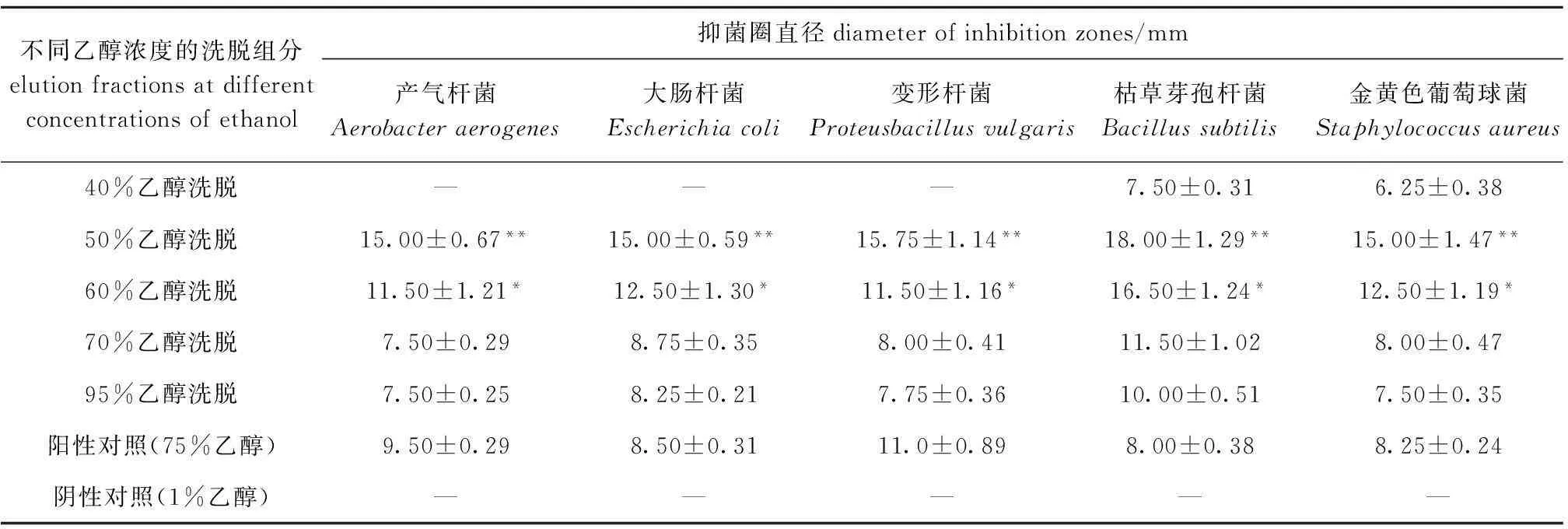
表3 紫蛇尾皂苷纯化物(浓度为45 mg/mL)的抑菌作用(n=3)
2.3紫蛇尾皂苷对α-葡萄糖苷酶活性的抑制作用
从图1可见,随着紫蛇尾皂苷粗提物浓度的增加,其对α-葡萄糖苷酶活性的抑制作用逐渐增强。当紫蛇尾皂苷粗提物浓度达到7 mg/mL时,酶抑制率为97.3%。
如表4所示,大孔树脂95%乙醇洗脱所得纯化物对酶的抑制作用较强,且浓度为2 mg/mL纯化物的酶抑制率较同等浓度粗提物的抑制结果(89%)差异显著(P<0.05),说明经过纯化的皂苷提取物活性明显增强。
2.4紫蛇尾皂苷对MCF-7人乳腺癌细胞增殖的抑制作用
从图2-A可以看出:当皂苷粗提物浓度小于200 μg/mL时,紫蛇尾皂苷粗提物对MCF-7人乳
腺癌细胞的细胞毒活性随样品液浓度的增大而迅速升高;当皂苷粗提物浓度为200 μg/mL时,细胞抑制率达到最大值,为97%。经计算,其50%致死浓度(IC50)为 120 μg/mL。

图1 紫蛇尾皂苷粗提物对-葡萄糖苷酶活性的抑制作用Fig.1 Inhibiting effect of crude saponin extract on -glucosidase activity
表4紫蛇尾皂苷纯化物(浓度为2 mg/mL)对-葡萄糖苷酶活性的抑制作用
Tab.4Inhibition effect of purified saponin extract from the brittle star(at concentration of 2 mg/mL) on-glucosidase activity

不同乙醇浓度的洗脱组分elutionfractionsatdifferentconcentrationsofethanol抑制率/%inhibitingrate40%乙醇洗脱73.60±4.1650%乙醇洗脱82.40±4.6160%乙醇洗脱89.65±5.3075%乙醇洗脱90.41±3.1595%乙醇洗脱94.62±3.75


图2 紫蛇尾皂苷粗提物(A)和纯化物(B)对MCF-7细胞增殖的抑制作用Fig.2 Inhibition effect of crude saponin (A)and purified saponin(B) extract from the brittle star on multiplication of MCF-7 human breast cancer cells
图2-B为不同浓度乙醇洗脱所得纯化物分别在低浓度100 μg/mL和高浓度300 μg/mL时对MCF-7细胞的细胞毒活性作用。从图2-B可以看出,高浓度的样品均表现出更好的抑制作用。随着乙醇浓度的增加,其细胞毒活性作用也明显增加。其中,60%、75%、95%乙醇洗脱所得纯化物在浓度为300 μg/mL时,抑制率均高达97%以上,这可能与纯化物中所含皂苷含量相对较高有关。樊廷俊等[16]的研究表明,水溶性海参皂苷大孔树脂柱的70%乙醇洗脱所得纯化物对HeLa细胞、A-549肺癌细胞、SGC-7901胃癌细胞和Bel-7402肝癌细胞均具有显著的抑制活性,且纯化后活性明显增强,这与本研究结果相似。
3结论
紫蛇尾皂苷粗提物及纯化物对枯草芽孢杆菌、变形杆菌、大肠杆菌、产气杆菌均有不同程度的抑制作用,而对金黄色葡萄球菌抑制作用较弱,说明其抑制作用具有选择性。其中枯草芽孢杆菌对紫蛇尾皂苷样品最为敏感。大孔树脂50%和60%乙醇洗脱所得纯化物对枯草芽孢杆菌、变形杆菌、大肠杆菌、产气杆菌和金黄色葡萄球菌5种指示菌都有很强的抑制作用,皂苷纯化物的抑菌活性明显增强。紫蛇尾皂苷粗提物及纯化物对α-葡萄糖苷酶活性和MCF-7细胞的增殖均表现出了很强的抑制作用,且纯化物的抑制作用增强。
通过对紫蛇尾皂苷粗提物及纯化物进行生物活性检测,可知其具体的生物学活性表现,这些都为充分利用蛇尾资源及海洋药物的研究奠定了基础。
参考文献:
[1]夏延斌,甑增立.食品化学[M].北京:中国轻工业出版社,2001:317-323.
[2]汤雯, 屠幼英,张维.茶树花皂苷提取分离、化学结构及生物活性研究进展[J].茶叶,2011,37(3):137-142.
[3]Li J,Zu Y G,Fu Y J,et al.Optimization of microwave-assisted extraction of triterpene saponins from defatted residue of yellow horn (XanthocerassorbifoliaBunge) kernel and evaluation of its antioxidant activity[J].Innovative Food Science and Emerging Technologies,2010(11):637-643.
[4]Lacaille-Dubois M A,Wagner H.Bioactive saponins from plants an update[J].Studies in Natural Products Chemistry,2000,21:633-687.
[5]Lacaille-Dubois M A.Bioactive saponins with cancer related and immunomodulatory activity:recent developments[J].Studies in Natural Products Chemistry,2005,32:209-246.
[6]廖玉麟.中国动物志 无脊椎动物 棘皮动物门 蛇尾纲[M].北京:科学出版社,2004:240-242.
[7]徐勤增,李瑞香,王宗灵,等.南黄海夏季大型底栖动物分布现状[J].海洋科学进展,2009,27:393-399.
[8]张慧.紫蛇尾(Ophiopholismirabilis)多糖的提取、纯化及生物活性研究[D].烟台:烟台大学,2012.
[9]姜斌,汪秋宽,何云海,等.蛋白提取工艺的研究[J].大连海洋大学学报,2013,28(5):488-502.
[10]郭承华,倪新江,贺君.金氏真蛇尾皂苷的制备及特性研究[J].动物学报,2001,47:131-133.
[11]李健,张令文,刘宁,等.苦瓜总皂苷提取工艺的研究[J].食品工业科技,2005,26(10):117-119.
[12]Hunfeld K P,Weigand J,Wichelhaus T A. In vitro activity of mezlocillin meropenem aztreonam,vancomycin,teicoplanin,ribostamycin and fusidic acid againstBorreliaburgdorferi[J].Antimicrobial Agents,2001,17:203-208.
[13]胡建恩,马驰宇,王刚,等.牡蛎蛋白水解产物中α-葡萄糖苷酶活性抑制组分的分离与纯化[J].大连水产学院学报,2009,24(5):449-450.
[14]李智博.胡桃楸活性成分分离解析及抗肿瘤作用的研究[D].大连:大连理工大学,2008.
[15]李笑梅,王松.菜豆皂苷抗氧化及抑菌活性研究[J].食品科学,2011,32(17):81-84.
[16]樊廷俊,袁文鹏,丛日山,等.仿刺参水溶性海参皂苷的分离纯化及其抑瘤活性研究[J].药学学报,2009,44(1):25-31.
Purification and biological activity of saponins
in brittle starOphiopholismirabilis
SHAO Zhi-yang, LI Zhi-bo, DONG Shu-mei, ZHAO Qian-cheng, QI Yan-xia, LI Wei
(Key Laboratory of Fishery Product Processing and Utilization of Liaoning Province, College of Food Science and Engineering, Dalian Ocean University, Dalian 116023,China)
Abstract:Saponins in brittle star Ophiopholis mirabilis were preliminarily purified by AB-8 macroporous resin and total content of saponins were determined by vanillin-perchloric acid method. Antibacterial activity and inhibitory effect on alpha glucosidase activity, and cytotoxic activity were tested by filter paper method, colorimetric method and MTT method. The results showed that the purity of the saponins was increased to 48.57% after purification by AB-8 macro porous resin. The antibacterial manifestations of crude extracts and purified saponins showed the same antibacterial activity, especially strong inhibition on Bacillus subtilis. However, the purified saponins had higher antibacterial effects, significant inhibitory effect on alpha glucosidase activity, with inhibition rate of 94.62% in 95% ethanol elution fractions. Moreover, both crude extracts and purified saponins showed significant cytotoxic activity of MCF-7 human breast cancer cells. The inhibition rate of over 97% were observed in 60%, 75%, and 95% ethanol elution fractions at 300 μg/mL. Both of crude extracts and purified saponins showed strong alternative inhibition on Bacillus subtilis, strong inhibitory effect on alpha glucosidase activity and cytotoxic activity of MCF-7 human breast cancer cells.
Key words:Ophiopholis mirabilis saponin; antibacterial activity; inhibition of alpha glucosidase; cytotoxic activity
通信作者:李智博(1979—), 女, 副教授。E-mail:lzb@dlou.edu.cn
作者简介:邵知扬(1990—), 女, 硕士研究生。E-mail:932259199@qq.com
基金项目:国家海洋公益性行业科研专项(201205022-7)
收稿日期:2014-06-24
中图分类号:TS218.2
文献标志码:A
文章编号:2095-1388(2015)02-0221-05
DOI:10.3969/J.ISSN.2095-1388.2015.02.021

