两个封闭群NIH小鼠群体的遗传监测结果的比较分析
魏 杰,王 洪,李芳芳,岳秉飞
(中国食品药品检定研究院,北京 100050)
两个封闭群NIH小鼠群体的遗传监测结果的比较分析
魏 杰,王洪,李芳芳,岳秉飞
(中国食品药品检定研究院,北京100050)
【摘要】目的对近3年北京地区的两个NIH封闭群小鼠群体的遗传质量进行监测分析。 方法 利用生化标记基因检测法,2011年测定A、B两单位NIH小鼠在碱性磷酸酶-1等14个遗传生化标记位点上的多态性。2014年利用相同方法原则对B单位的NIH小鼠群体进行抽样检测,比较了该小鼠群体3年来的遗传构成变化。结果2011年,A、B两单位NIH小鼠群体均呈多态性的生化标记位点有6个(Ce2、Car2、Gpi1、Es10、Gpd1、Pgm1),且B单位在Es3位点也呈多态性;两群NIH小鼠在Car2位点有差异(P < 0.05),在Es3、Gpd1、Pgm1三个位点有显著差异(P < 0.01);两群体的群间分化系数为0.0406,遗传一致性指数为0.9619,遗传距离为0.0388。与2011年相比,B单位封闭群NIH小鼠在2014年出现了2个纯合位点(Ce2和Gpd1),同时Es10和Gpd1两位点差异极显著(P < 0.01),Pgm1位点差异显著(P < 0.05);不同代次NIH小鼠群间分化系数为0.1103,遗传一致性指数为0.8847,遗传距离为0.1266。结论群体隔离、选种育种、种群数量和繁育代次等对NIH小鼠遗传构成差异影响显著。留种和繁育生产时应加强封闭群NIH小鼠的遗传监测,为其遗传质量的稳定性提供保障。
【关键词】NIH;封闭群;生化标记基因;遗传监测
NIH小鼠为美国国立卫生研究所培育的封闭群小鼠,1980年引入我国[1]。其生长繁殖性能良好,饲养管理方便,对环境的适应性和对疾病的抵抗力强,广泛应用于药理学、毒理学、肿瘤学、基因工程等领域研究,同时也是《中国药典》2010年版第三部规定毒种免疫原性检查以及乙肝、百白破、流感嗜血杆菌疫苗效力测定的推荐用实验动物[2-3]。加强对NIH封闭群小鼠的遗传监测,明确其遗传背景概貌和维持群体遗传质量的稳定性,以为其科学应用提供有力保障。
本研究即利用GB14923-2010推荐的生化标记基因检测法,选取碱性磷酸酶-1等14个遗传生化标记位点,于2011年从北京A、B两家单位生产的NIH小鼠进行了抽样和比较测定;同时于2014年对B单位NIH小鼠进行了连续监测,得到了北京地区近3年来NIH封闭群小鼠的遗传质量监测信息,为其生产应用提供了科学依据。
1材料和方法
1.1材料
1.1.1动物:NIH小鼠,雌雄各半,30只,8周。2011年,在A、B两家单分别取样。2014年仅在B单位取样。两家单位的生产许可证号分别为【SCXK(京)20052010-0008】和【SCXK(京)2009-0017】。本单位实验动物使用许可证号【SYXK(京)2011-0008】。
1.1.2主要试剂及仪器:小鼠生化标记检测试剂盒(中国食品药品检定研究院研制);乙酸纤维素薄膜(浙江台州路桥四甲生化塑料厂);BIO-RAD Model 3000Xi电泳仪。
1.2方法
检测方法参照国家标准GB/T14927.1-2008[4]。
1.3结果分析
按照GB14923-2010和GB14927.1-2008判定各群体在各位点的等位基因型,利用Popgen32软件计算不同群体的位点信息及群体卡方值,比较群体的多态性差异。
2结果
2.1两个NIH小鼠群体的生化标记测定基因型频率
两个单位NIH小鼠的生化标记测定基因型频率(表1)显示,2011年A单位NIH小鼠有6个多态性生化标记位点,多态位点比率为42.86%;B单位NIH小鼠有7个多态性生化标记位点,多态位点比率为50.00%。A、B两单位共有的多态性位点为Ce2、Car2、Gpi1、Es10、Gpd1和Pgm1,且B单位另有Es3位点出现了多态性。经Popgen32软件计算,两群体在Car2位点有差异(P< 0.05),在Es3、Gpd1、Pgm1三个位点有显著差异(P< 0.01)。
B单位2011年NIH小鼠有7个多态性生化标记位点,多态位点比率为50.00%;2014年时该小鼠群体有Ce2和Gpd1两个位点发生了纯合,仅有5个多态性生化标记位点,多态位点比率为35.71%。经Popgen32软件计算,B单位不同代次群体在Es10和Gpd1两位点差异显著(P< 0.01),在Pgm1位点有统计学差异(P< 0.05)。
2.2群体遗传参数分析
A、B两单位NIH小鼠群体通过Popgen32软件计算分析得出,群间分化系数(Fst)为0.0406,遗传一致性指数(Genetic Identity)为0.9619,遗传距离(Genetic Distance)为0.0388。
B单位2011年和2014年NIH小鼠群体的群间分化系数(Fst)为0.1103,遗传一致性指数(Genetic Identity)为0.8847,遗传距离(Genetic Distance)为0.1266。两组群体遗传参数比较数据详见表2。
3讨论
NIH封闭群小鼠是国际通用的实验动物,在科学研究和药品生物制品检定中有着广泛的应用[2]。但是封闭群实验动物的遗传性状容易受到环境、饲育方式等因素的影响而发生变化[5],现有的封闭群繁育制度是否能保证其群体的遗传稳定性尚缺少相应的评估,曾有研究报道了不同来源的NIH小鼠对乙肝疫苗免疫应答的差异[6],则对于封闭群NIH小鼠的遗传监测和标准化将更深刻地影响到其的通用性和结果的可重复性。
3.1遗传分化系数
遗传分化系数Fst是测定群体间遗传分化的主要参数[7],Fst<0.05时,表示群体间有轻度遗传分化;0.05≤Fst<0.15表示群体间有中度遗传分化;0.15≤Fst<0.25表示群体间有中重度遗传分化;
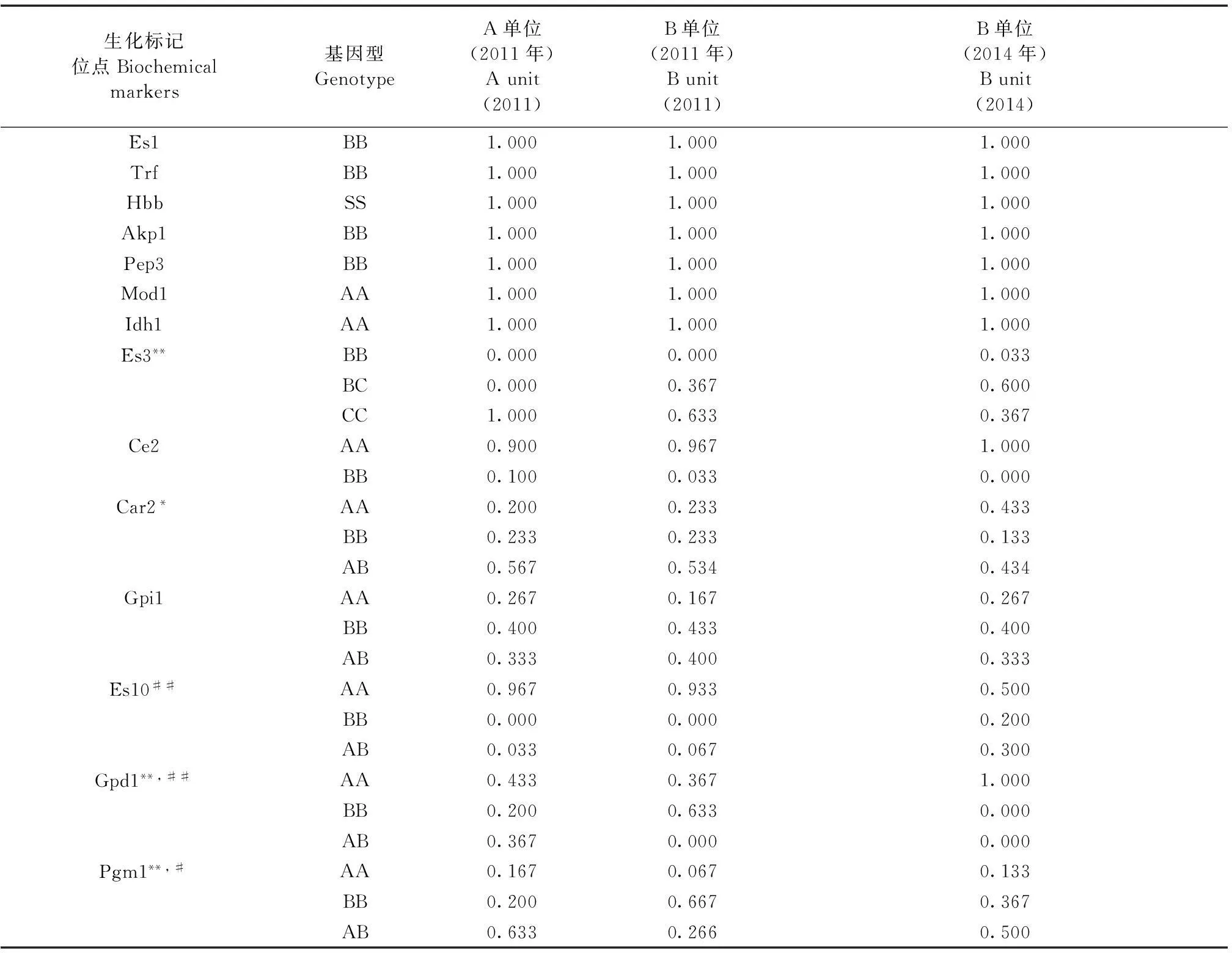
表1 不同单位不同年代NIH小鼠生化标记位点基因型频率表(n=30)
注:*表示2011年A、B两单位群体P< 0.05;**表示2011年A、B两单位群体P< 0.01;#表示B单位2011年和2014年群体P< 0.05;##表示B单位2011年和2014年群体P< 0.01。
Note:*showsP< 0.05 when 2011 between A and B groups NIH mice, while**show thatP<0.01; # showsP< 0.05 in B group NIH mice of 2011 and 2014 colonies, while ## show thatP< 0.01.
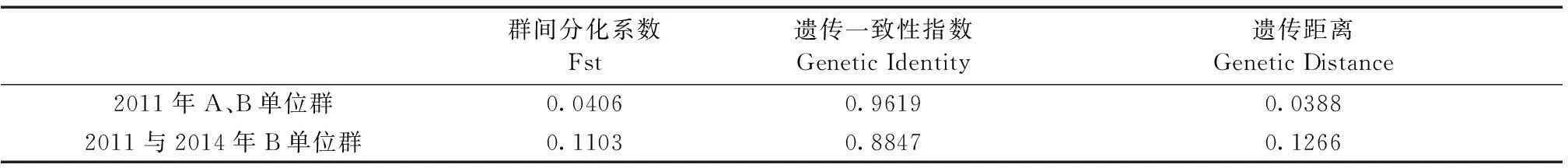
表2 不同单位及同单位不同年代NIH小鼠群体遗传参数
Fst≥0.25表示群体间有重度遗传分化,群体差异显著。
本研究中,2011年A、B两单位NIH群体的Fst<0.05,群体间仅有轻度遗传分化。B单位2014年群体和2011年群体的群间遗传分化系数0.1103,已经处于中度遗传分化状态。不同单位及同单位不同代次的NIH封闭群小鼠的遗传构成尚存在差异和变化。
3.2遗传一致性指数与遗传距离
遗传一致性指数与遗传距离是反映群体遗传相似性的两个指标,两者呈负对数关系,其中,遗传距离为显性函数,且当遗传距离大于0.2时,认为两个群体为同属不同种;在0.03~0.2之间时为同属同种[8]。
本研究中,2011年A、B两单位NIH群体以及B单位2011年和2014年群体的遗传距离虽然都在0.03~0.2之间,但群体隔离因素和饲育方式对群体的遗传构成均产生重要影响,且传代的遗传距离略大于不同单位的遗传距离,表明在封闭群的保持和繁育过程中,饲育方式对群体的遗传性状的影响力更大。
3.3选育及种群大小对于遗传构成的影响
A、B两单位均曾经过q基因的选育建立NIH-q群[9]。经过选择后,对于疫苗检定的免疫应答反应效果得以提升。B单位剖腹净化等技术提升了其种群的微生物等级[10]。特殊性状的培育一方面改变了其应用特性,但另一方面也限制了种群的基因丰度,再加上保种群数量过少等,可能造成遗传的奠基者效应[11]。
3.4遗传生化标记检测法与封闭群遗传监测
遗传生化标记是通过同工酶、蛋白质的差异来反映基因的变化,方法成熟、位点明确、简便快速经济、结果易判读,同时也是指导封闭群选种的“二次优选法”中必须测定的生物学特性之一[12]。本研究的生化标记测定也直观的反映了不同单位和不同代次封闭群NIH小鼠的遗传构成差异。在2011年不同单位间相差1个多态性位点,存在4个有差异的多态性位点。至2014年,同单位不同代次的群体间存在3个有差异的多态性位点且有2个位点已经发生纯合。这与计算的遗传参数反映的群体遗传构成一致。当然,目前可选择的遗传生化标记位点比较有限,与微卫星标记等方法相比,也存在着多态性不够丰富的不足,需要筛选更多染色体上多态性丰富的生化标记位点和通过不同评价体系综合分析封闭群的遗传质量,保证封闭群小鼠的遗传质量稳定性,实现对封闭群的遗传质量监测,为其应用提供可靠的保障支撑。
参考文献:
[1]孙抗林. NIH小鼠繁殖性能的观察[J]. 上海实验动物科学,1985,5(3):165-166.
[2]张静旭,刘淑霞,马丹,等. NIH小鼠生长繁殖性能的观察[J]. 中国实验动物学杂志,2002,12(5):292-293.
[3 ]章贤忠. N IH系小鼠与昆明系小鼠生长繁殖特性及免疫反应比较[J]. 上海实验动物科学,1990,10(3):167-169.
[4]GB/T 14927.1-2008. 实验动物 近交系小鼠、大鼠生化标记检测法[S].
[5]杨红字. 封闭群实验小鼠的生产管理要点[J]. 贵州畜牧兽医,2009,33(5):27.
[6]马丽颖,钟曦,贺争鸣,等. 两个NIH小鼠种群对不同种类的乙肝疫苗免疫应答效应的比较[J]. 中国比较医学杂志,2009,19(4):52-55.
[7]Balloux F, Lugon-Moulin N. The estimation of population differentiation with microsatellite markers[J]. Mol Ecol, 2002,11:155-165.
[8]Theorpe J P. The molecular dock hypothesis: biochemical evaluation, genetic differentiation and systemayias[J]. Am Res Ecol Syst, 1982,13:139-168.
[9]邢瑞昌,宋珍珠,刘双环,等. 用于乙肝疫苗效力检定的NIH-q小鼠种群的建立[J]. 中国比较医学杂志,1991,1:8-12.
[10]张业斌,王春玲,吴慧英,等. 清洁级NIH系小鼠种群的建立与应用[J]. 上海实验动物科学,1992,12(1)28-30.
[11 ]周炜. 封闭群实验动物的遗传学质量控制[J]. 上海实验动物科学,1997,17(1):46-49.
[12 ]Hedrich HJ. Genetic monitoring[M]. Newyork: Academic Press. 1981, Vol. 1:159-176.
〔修回日期〕2015-04-21
王洪(1977-),女,学士,副研究员。研究方向:动物遗传学。E-mail: littstar@163.com。两者为共同第一作者。
研究报告
Comparative analysis on genetic monitoring of 2 closed colonies NIH mouse
WEI Jie,Wang Hong,LI Fang-fang,YUE Bing-fei
(National Institutes for Food and Drug Control,Beijing 100050, China)
【Abstract】ObjectiveTo analyse and monitor the genetic quality of closed colony NIH mice in Beijing district for the last 3 years. Methods We use biochemical genetic markers(including alkaline phosphatase-1 and the like 14 biochemical markers), selecting A and B colonies from different facilities for genetic monitoring in 2011 to study the polymorphism. And in 2014, 30 NIH mice just from B colony were monitored using the same testing and sampling methods. ResultsIn 2011,NIH mice form both A and B facilities existed 6 polymorphic biochemical markers(Ce2,Car2,Gpi1,Es10,Gpd1,Pgm1); and NIH mice of B company also existed polymorphism in Es3 loucs. Between the 2 NIH mice colonies, there were significant difference in Es3、Gpd1、Pgm1 loci (P < 0.01), and difference in Car2 locus(P < 0.05). FST of the 2 colonies was 0.0406, the genetic identity was 0.9619, and the genetic distance was 0.0388. In B company, NIH mice of 2014 appeared 2 homozygous loci(Ce2 and Gpd1) when compared with NIH mice of 2011. Between the 2 NIH mice colonies, there were significant difference in Es10 and Gpd1 loci (P < 0.01), and difference in Pgm1 locus(P < 0.05). Fst of the 2 colonies was 0.1103, the genetic identity was 0.8847, and the Genetic distance was 0.1266. ConclusionsPopulation isolation, breeding and selection, populationpopulation quantityquantity and generation significantly affected the genetic architecture of NIH mice. So when breeding and reserving seeds, we should strengthen the genetic monitoring of outbred NIH mice, in order to offer reliable genetic quality protection.
【Key words】NIH;Closed colony;Biochemical markers;Genetic monitoring
doi:10.3969.j.issn.1671.7856. 2015.005.008
【中图分类号】R332
【文献标识码】A
【文章编号】1671-7856(2015) 05-0033-04
[通讯作者]岳秉飞(1960-),男,研究员,博士。研究方向:动物遗传学。E-mail: y6784@126.com。
[作者简介]魏杰(1982-),女,硕士,助理研究员。研究方向:免疫遗传检测。E-mail: jane3040320@163.com;
[基金项目]国家科技支撑计划(2013BAK11B03)。

