不同生物来源的凝血酶原试剂测定结果差异的分析
白会仓,王彦平,李立和
(天津市医科大学宝坻临床学院检验科,天津宝坻 301800)
不同生物来源的凝血酶原试剂测定结果差异的分析
白会仓,王彦平,李立和
(天津市医科大学宝坻临床学院检验科,天津宝坻 301800)
摘要:目的探讨不同生物来源的凝血酶原试剂对凝血酶原时间(PT)测定的影响。方法分别选用上海太阳生物和上海长岛生物提供的兔脑提取物和重组组织因子来源的凝血酶原试剂在Sysmex CA7000全自动血凝仪上测定非华法林治疗组(A组)38例和华法林治疗组(B组)43例PT,比较不同来源的凝血酶原试剂测定结果在两组间的差异,并进行统计学分析。结果A组:R1、R2、R3、R4试剂结果组间比较无统计学意义(F=3.42,P>0.05,n=38); B组:R1、R2、R3、R4试剂结果组间比较有统计学意义(F=57.68,P<0.05,n=43),而R1,R3试剂结果组间比较差异无统计学意义(t=2.21,P>0.05),R2,R4试剂结果组间比较差异无统计学意义(t=2.09,P>0.05)。结论两种不同来源的PT试剂在测定非华法林治疗患者PT结果无明显差异;测定华法林治疗患者PT结果有明显差异;重组组织因子的凝血活酶试剂灵敏度更高,用于华法林治疗患者监测PT应建立新的治疗标准值,以免造成误诊误治。
关键词:凝血活酶;凝血酶原时间;重组组织因子;兔脑粉提取物
凝血酶原时间(PT)测定是外源性凝血系统的检测项目之一,常用做血栓形成前的诊断和口服抗凝剂治疗的监测指标。目前,PT试剂临床实验室常采用兔脑提取物和基于重组组织因子来源的两种试剂,PT测定试剂及方法的标准化对提高检测及治疗水平具有重要临床意义。
1资料与方法
1.1一般资料A组为非华法林治疗组,来自本院门诊及住院患者38例,其中男20例,平均42.5岁,女18例,平均41.5岁;B组为华法林治疗组43例,其中男25例,平均40.5岁,女18例,平均39.5岁。
1.2仪器与试剂仪器为Sysmex CA7000全自动血凝仪。兔脑粉、重组组织因子来源的PT试剂由上海太阳生物技术有限公司和上海长岛生物技术有限公司提供,上海太阳兔脑粉试剂R1、上海太阳基因重组试剂R2、上海长岛兔脑粉试剂R3、上海长岛基因重组试剂R4批号分别为20140306、20131026、20131210和20140328。
1.3方法分别用试剂R1、R2、R3、R4在Sysmex CA7000全自动血凝仪上测定A组和B组PT,比较A组和B组PT测定结果在组间和组内的差异。
1.4统计学处理应用NOSA2.3统计学软件统计,4种试剂测定同一组PT结果组间差异比较用F检验,两组间差异比较用配对t检验。P<0.05表示差异有统计学意义。
2结果
试剂R1、R2、R3、R4在Sysmex CA7000血凝仪上测定A组PT组间比较见表1。 采用方差分析,4种试剂测定结果比较差异无统计学意义(F=3.42,P>0.05)。
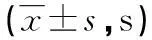
表1 4种试剂测定A组PT结果比较
试剂R1、R2、R3、R4在Sysmex CA7000血凝仪上测定B组PT组间比较见表2。在B组中,4种试剂测定结果比较差异有统计学意义(F=57.68,P<0.05),且试剂R1与R3比较差异无统计学意义(t=2.21,P>0.05),试剂R2与R4比较差异无统计学意义(t=2.09,P>0.05),试剂R1与R2比较差异有统计学意义(t=32.56,P<0.05),试剂R3与R4比较差异有统计学意义(t=34.21,P<0.05)。
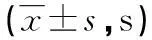
表2 4种试剂测定B组PT结果比较
上海太阳凝血酶原试剂R1与R3测定A组和B组结果对比见图1。从图1中可以看出当PT大于16.6 s时,两种方法存在明显差异。同一血浆采用兔脑粉来源试剂凝血酶原国际标准化比率(INR)为2.0~3.0时,PT为22.90~36.70 s,使用重组组织因子的PT试剂时,INR值在2.30~3.96时,PT为26.10~44.40 s。
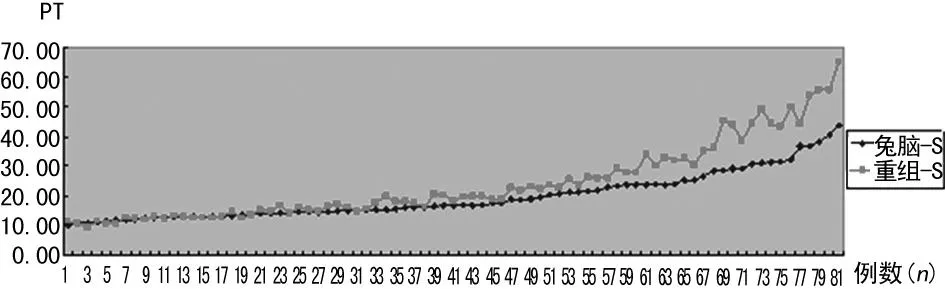
图1 上海太阳公司兔脑粉和基因重组来源的
3讨论
凝血酶原试剂来源于人或动物的组织提取物,基于组织提取的凝血活酶试剂,其组织因子长期以来主要来源于兔脑、牛脑、人脑及人的胎盘等组织[1],其中人脑和人的胎盘制备的凝血活酶试剂的敏感性最高[1]。凝血活酶试剂中除了最主要的凝血活酶成分外还需要磷脂,磷脂的作用非常重要,组织因子必须有磷脂存在时,才能表现活性。在磷脂存在下,可溶性组织因子有明显的促凝血活性[2],可以替代兔脑粉用于PT实验。凝血活酶试剂中提到的磷脂是一种混合物,一般包括磷脂酰胆碱、磷脂丝氨酸、磷脂酰乙醇胺、磷脂酰甘油、磷脂酸和磷脂酰肌醇。其中磷脂酰丝氨酸是最有效的带负电荷的磷脂[3]。
从表1、2结果分析,两种不同来源的PT试剂在测定非华法林治疗治疗患者PT结果无明显差异(F=3.42,P>0.05,n=38);测定华法林治疗治疗患者PT结果差异有统计学意义(F=57.68,P<0.05,n=43);同一组织来源的试剂(R1与R3,或R2与R4)在两组中测定结果比较差异无统计学意义(P>0.05),这是因为凝血酶原试剂主要有凝血活酶,磷脂混合物,钙离子3部分组成,试剂中最重要的成分是凝血活酶,即凝血因子Ⅲ,通常称为组织因子,两种PT试剂磷脂成分和比例存在较大差异,磷脂对于组织因子活性影响较大[2],重组组织因子的凝血活酶试剂敏感性更高。
采用基因重组凝血活酶试剂结构稳定,蛋白均一,工艺易于控制,组成恒定,稳定性较好,易于质量控制,有利于提高实验的敏感度、精密度和准确度[3]。随着分子生物技术的发展,人们越来越多的利用基因工程技术来生产人或兔的组织因子,如重组组织因子包括组织因子的胞外区、跨膜区,可溶性组织因子即组织因子的胞外区。美国专利US7049087(2008)采用嵌合蛋白结合磷脂酰丝氨酸,并对可溶性组织因子活性进行研究,以便替代兔脑粉用于PT实验。近年来,已经使用高度纯化的人重组组织因子和可溶性组织因子来制备凝血活酶试剂,试剂成分明确,有利于全国乃至全世界的实验室和医院检测结果的对比。近期的专利US200802620858(2008)对凝血活酶试剂中磷脂的组成、各组成成分之间的比例和磷脂总体在试剂中比例进行研究,得出了最佳的组合范围。重组组织因子来源PT试剂消除了不同来源试剂ISI值尚存在的差异因素[4-5],向PT试验的标准化又迈进了一步,重组组织因子进而与磷脂结合构建重组的PT试剂,彻底克服了基于组织提取PT试剂的缺点,为PT实验标准化提供重要保障。
从图1中可以看出,当PT时间大于16.6 s时,两种方法存在明显差异。采用兔脑粉来源试剂凝血酶原标准比值2.0~3.0,PT为22.90~36.70 s。如需使用重组组织因子的凝血活酶试剂进行华法林药物监测时,PT应控制在26.10~44.40 s,INR应在2.30~3.96。临床常以PT及 INR作为其抗凝监测指标。抗凝过度与不足都能引起严重的并发症[6]。心脏瓣膜置换后患者INR应控制在2.5~3.5,房颤、深静脉血栓预防、肺栓塞及其预防患者INR应控制在2.0~3.0[7-9]。华法林是20世纪40年代美国Wisconsin大学合成的香豆素类口服抗凝血药,主要用于血栓栓塞疾病[10]。有研究表明口服华法林能抑制抗凝患者血浆中蛋白C、蛋白S的活性[11-12]。
综上所述,采用兔脑粉来源凝血酶原试剂更接近人体组织,而采用重组组织因子的凝血活酶试剂高度敏感,如需使用重组组织因子的凝血活酶试剂进行华法林药物监测时,应建立新的治疗标准值,以免造成误诊误治。
参考文献
[1]邓小燕,潘昆贻.INR在口服抗凝剂患者中的临床应用[J].中国热带医学,2005,5(4):834-835.
[2]张茉莉,谢守军,薛承启.影响活化部分凝血活酶时间测定的因素[J].河北医学,2006,12(11):1196-1197.
[3]孙金霞,郭振中,孙雷,等.基于重组组织因子凝血活酶试剂的研究进展[J].第二军医大学学报,2012,33(2):220-223.
[4]辛敬平,张红胜,鲁莉.凝血酶原时间-国际标准化比值的建立[J].国际检验医学杂志,2013,34(21):2897-2898.
[5]赵院利,范宁,张现敏.试剂因素对凝血试验结构影响探讨[J].陕西医学杂志,2011,40(4):487-489.
[6]郑策,梅丹.影响华法林抗凝血作用的有关因素[J].药物不良反应杂志,2007,9(4):256-261.
[7]陈艺红.华法林的临床应用与监测[J].中国实用内科杂志,2007,27(9):657-660.
[8]康俊萍.华法林临床应用要点[J].中国医刊,2014,49(1):11-14.
[9]张秀杰.华法林临床应用中的相互作用及其安全性分析[J].航空航天医学杂志,2014,25(2):217-218.
[10]胡大一,郭艺芳.心房颤动抗凝治疗中国专家共识[J].心脑血管病防治,2012,6(20):173-177.
[11]郑比龙,刘俊.华法林抗凝血作用及影响因素分析[J].安徽医药,2013,17(11):1975-1977.
[12]窦心灵,樊玉兰,陈涛,等.口服华法令患者血浆蛋白C和蛋白S活性监测的临床意义[J].国际检验医学杂志,2009,30(10):992-993.

·论著·
Analysis on detection results differences of different biological sources of prothrombin reagents
BaiHuicang,WangYanping,LiLihe
(DepartmentofClinicalLaboratory,BaodiClinicalInstitute,TianjinMedicalUniversity,Tianjin301800,China)
Abstract:ObjectiveTo explore the influence of different biological sources of thromboplastin reagent on prothrombin time(PT) detection.MethodsThe thromboplastin reagents sourced from the rabbit brain extract provided by the Shanghai Taiyang Biological Technology Co.,Ltd.and Shanghai Changdao Biological Technology Co.,Ltd.and recombination tissue factor were selected and used for detecting PT in the non-Warfarin treatment group(group A,38 cases) and the Warfarin group(group B,43 cases) by the Sysmex CA7000 blood coagulation analyzer.The detection results from different sources of prothrombin reagents were compared between the two groups and performed the statistical analysis.ResultsIn the group A,the detection results had no statistical differences among the reagent R1,R2,R3 and R4 (F=3.42,P>0.05,n=38);in the group B,the detection results had statistical differences among the reagent R1,R2,R3 and R4 (F=57.68,P<0.05,n=43),while the detection results had no statistical differences between reagent R1 and R3(t=2.21,P>0.05) and between reagent R2 and R4(t=2.09,P>0.05).ConclusionThe detection results of PT by different sources of PT reagent in the non-Warfarin treatment patients demonstrate no significant difference,but the detection results in the Warfarin treatment patients have highly significant difference;the recombination tissue factor thromboplastin reagent has higher sensitivity,which used for monitoring PT in the warfarin treated patients should establish a new therapeutic standard value for avoiding to cause the misdiagnosis and mistreatment.
Key words:thrombokinase;prothrombin time;recombinant tissue factor;Rabbit brain powder extract
通讯作者
作者简介:王彦,女,初级检验技师,主要从事临床输血与血液采集研究。△,E-mail:deqingw@vip.sina.com。
收稿日期:(2015-07-13)
文献标识码:
DOI:10.3969/j.issn.1673-4130.2015.24.022A
文章编号:1673-4130(2015)24-3561-02

