环介导等温扩增技术结合横向流动试纸条检测猪链球菌2型的应用研究
张 莉,王利丽,魏财文,杨春蕾,路 超,池晶晶,鄢明华
环介导等温扩增技术结合横向流动试纸条检测猪链球菌2型的应用研究
张 莉1,王利丽1,魏财文2,杨春蕾1,路 超1,池晶晶1,鄢明华1
目的 建立一种猪链球菌2型的快速检测方法。方法以猪链球菌2型cps2J基因序列为检测靶标设计6条环介导等温扩增(LAMP)特异性引物,其中2条促环引物分别标记异硫氰酸荧光素(FITC)和地高辛(Dig),用横向流动试纸条(LFD)检测扩增产物,建立猪链球菌2型LAMP-LFD检测方法。结果所建立的检测方法能够特异性的检测出猪链球菌2型,与试验对照菌株不存在交叉反应,其最低检测限为76 cfu/mL,在对100份样品的检测中,LAMP-LFD方法检测出14份阳性样品,培养法检测出12份阳性样品,LAMP-LFD方法检测阳性率略高于病原培养法,两者间的P>0.05无统计学差异。结论所建立LAMP-LFD检测方法具有特异性好、敏感性高、操作简单、快速等特点,适合于动物食品中猪链球菌2型的检测。
猪链球菌2型;cps2J基因;环介导等温扩增;横向流动试纸条
Supported by the National High Technology Research and Development Program of China (No. 2012AA101605), the Agriculture Science and Technology Achievements Transformation and Extension Program of Tianjin (No. 201301030), and the Foun-dation of President of Tianjin Academy of Agricultural Sciences (No. 16003) Corresponding author: Yan Ming-hua, Email: yanmh81971@126.com
猪链球菌病(swinestreptococcosis)是由C、D、F及L群链球菌引起的猪的多种疾病的总称,急性型常表现为出血性败血症和脑炎,慢性型以关节炎、内膜炎、淋巴结化脓及组织化脓等为特征。猪链球菌(S.suis,Ss)是引起猪链球菌病的重要病原之一。根据菌体荚膜多糖的多样性,猪链球菌分为1~34型和1/2型,共35个血清型,其中猪链球菌2型(S.suisserotype2,Ss2)致病力最强。猪链球菌2型不仅可引起猪发病,对人也具有致病性,人感染后会出现发烧、脑炎、败血症等症状,严重者可发生中毒性休克导致多器官衰竭甚至死亡,是一种重要的人兽共患病原菌。自20世纪50年代以来,英国、美国等许多国家先后报道了人感染猪链球菌病例。国内四川省、湖南省、浙江省等地均发生了人感染猪链球菌病疫情[1-3]。猪肉是人类重要的食品,其安全性越来越引起人们的关注。猪链球菌2型作为重要的动物源性人兽共患病原给人们的健康和生活造成了重大威胁。因此,建立准确而快速的猪链球菌2型检测方法是当前猪链球菌病防控的关键,也是食品检疫急需的手段。
环介导等温扩增技术(loop-mediated isothermal amplification, LAMP)是一种能在恒温条件下快速、准确、特异地扩增目的DNA的技术。将横向流动试纸条(lateral flow dipstick,LFD)与LAMP技术相结合,操作者只需将试纸条浸入含有LAMP扩增产物的缓冲液即可直观的得到检测结果,不需要特殊设备及使用EB等有毒试剂。本研究应用上述原理,根据猪链球菌的cps2J基因设计一套LAMP引物,建立猪链球菌2型的特异性LAMP检测方法,并结合LFD对扩增产物进行检测。
1 材料与方法
1.1 菌株 大肠杆菌 (O157∶H7,CVCC 83726)、无乳链球菌(CVCC 1887)、停乳链球菌(CVCC 588)、金黄色葡萄球菌(CAU0789)、甲型副伤寒沙门氏菌(CVCC 2187)、表皮葡萄球菌(CAU0244)、痢疾志贺氏菌(CVCC 1881)、猪链球菌2型(CVCC 3307)、猪链球菌1型(S428)、猪链球菌7型(8074)、猪链球菌9型(DAN22083)购自国家兽医微生物菌种保藏管理中心;蜡样芽苞杆菌、铜绿假单孢菌均由本实验室分离保存。
1.2 主要试剂 Bst DNA聚合酶、MgSO4、甜菜碱购自New England Biolabs公司;DNA提取试剂盒购自天根生物技术公司;横向流动试纸条购自Milenia Biotec GmbH 公司。
1.3 引物设计与合成 根据GenBank数据库中猪链球菌cps2J基因(GenBank:GQ352502.1)上的一段保守核苷酸序列,采用Primer explore V在线软件设计特异性LAMP引物,由大连宝生物工程有限公司合成(表1)。
表1 引物序列
Tab.1 Primer sequences
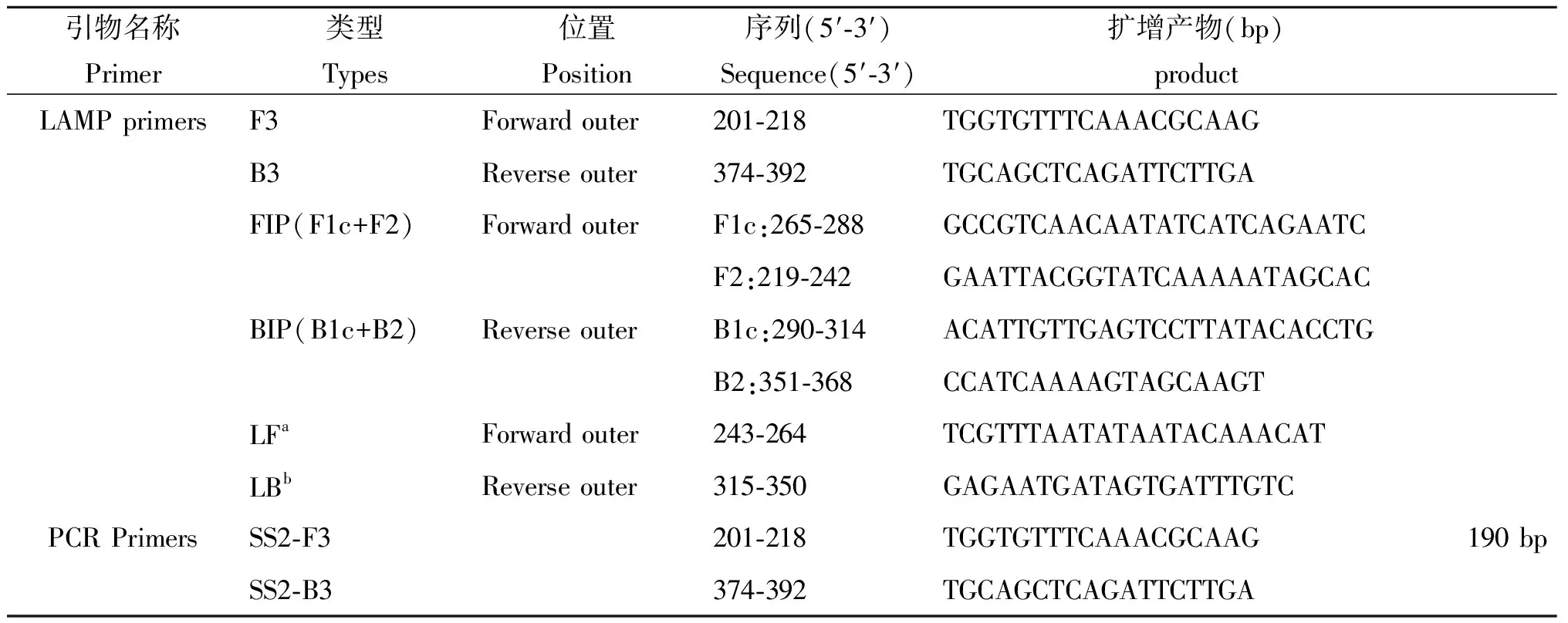
引物名称Primer类型Types位置Position序列(5′⁃3′)Sequence(5′⁃3′)扩增产物(bp)productLAMPprimersF3Forwardouter201⁃218TGGTGTTTCAAACGCAAGB3Reverseouter374⁃392TGCAGCTCAGATTCTTGAFIP(F1c+F2)ForwardouterF1c:265⁃288GCCGTCAACAATATCATCAGAATCF2:219⁃242GAATTACGGTATCAAAAATAGCACBIP(B1c+B2)ReverseouterB1c:290⁃314ACATTGTTGAGTCCTTATACACCTGB2:351⁃368CCATCAAAAGTAGCAAGTLFaForwardouter243⁃264TCGTTTAATATAATACAAACATLBbReverseouter315⁃350GAGAATGATAGTGATTTGTCPCRPrimersSS2⁃F3201⁃218TGGTGTTTCAAACGCAAG190bpSS2⁃B3374⁃392TGCAGCTCAGATTCTTGA
a :5′标记FITC b:5′标记Dig
1.4 DNA模板的制备 采用天根生物技术公司DNA试剂盒提取参考菌株和待检样品的DNA用于检测。
1.5 LAMP-LFD方法的建立
1.5.1 LAMP反应条件摸索 猪链球菌LAMP的反应体系为25 μL:2.5 μL 10×等温反应缓冲液、1.0 μL Bst DNA聚合酶(8 U/μL)、4 μL dNTPs(2.5 mmol/L)、0.5 μL FIP(40 μmol/L)、0.5 μL BIP(40 μmol/L)、0.5 μL F3(5 μmol/L)、0.5 μL B3(5 μmol/L)、0.5 μL LF(5 μmol/L)、0.5 μL LB(5 μmol/L)、1.0 μL模板DNA、4.0 μL甜菜碱(5 mol/L)和9.5 μL超纯水。
将温度按55 ℃、60 ℃、63 ℃、65 ℃依次递增,确定最佳退火温度。在最佳温度条件下,固定其他条件不变,反应时间按15、30、45、60 min优化,确定最佳反应时间。
1.5.2 LAMP-LFD反应条件摸索
1.5.2.1 按照1.5.1的试验结果进行LAMP扩增,其中LF和LB引物分别标记有FITC和Dig。反应结束后,使用横向流动试纸条读取LAMP检测结果。
1.5.2.2 取LAMP扩增产物10 μL加入到100 μL缓冲液中,混合均匀,将试纸条插入稀释后的LAMP液体中3 min。
1.5.2.3 取出试纸条水平放置,5 min内读取结果。判定标准:同时出现质控线和检测线为阳性,只出现质控线为阴性,只出现检测线为无效。
1.6 特异性试验 用已优化的LAMP体系扩增大肠杆菌、无乳链球菌、停乳链球菌、金黄色葡萄球菌、甲型副伤寒沙门氏菌、表皮葡萄球菌、痢疾志贺氏菌、猪链球菌2型、猪链球菌1型、猪链球菌7型、猪链球菌9型、蜡样芽苞杆菌、铜绿假单孢菌的DNA样品,用琼脂糖凝胶电泳法和LFD分别检测扩增产物,检测LAMP方法的特异性。
1.7 敏感性试验 将猪链球菌2型新鲜制备的菌液用平板计数法计算含菌量,并进行10倍系列稀释至10-5,对上述稀释菌液分别提取模板DNA,并进行LAMP和PCR扩增,用琼脂糖凝胶电泳法和LFD分别检测扩增产物,确定LAMP和PCR方法的敏感性。
1.8 重复性和稳定性试验 采用同一批次和不同批次提取的猪链球菌DNA作为模板分别进行5次LAMP扩增,用琼脂糖凝胶电泳法和LFD法检测扩增产物,确定所建立LAMP方法的重复性和稳定性。
1.9 应用试验
1.9.1 试验模拟样品的检测 取10 g未检出猪链球菌2型的新鲜猪肉,加入100 mL生理盐水制作为匀浆。将匀浆分为50份,随机选择15份加入104cfu/mL的猪链球菌菌液,模拟细菌感染,混合均匀后用细菌分离培养法和LAMP-LFD方法分别进行检测。
1.9.2 市售样品的检验 从市场和屠宰场随机采集50份猪肉样本,加入生理盐水匀浆后,用细菌分离培养法和LAMP-LFD方法分别进行检测。
1.9.3 数据统计分析 应用SPSS17.0对检测数据进行分析,采用配对四格表进行χ2检验。当P<0.05是,说明两种方法有差别。以培养法为金标准,计算LAMP-LFD检测样品的灵敏度等指标。
2 结 果
2.1 猪链球菌2型LAMP-LFD方法的建立
2.1.1 LAMP反应条件摸索
2.1.1.1 反应温度筛选结果 采用1.5中所述的25 μL反应体系,分别在55 ℃、60 ℃、63 ℃、65 ℃ 4个恒温温度下扩增1 h,琼脂糖凝胶电泳观察,55 ℃无扩增产物,60 ℃有弥散扩增条带,63 ℃、65 ℃为多种大小条带的组合LAMP特征性图形,为阳性结果,而63 ℃的条带最为清晰,因此选择63 ℃为最适反应温度。结果见图1。
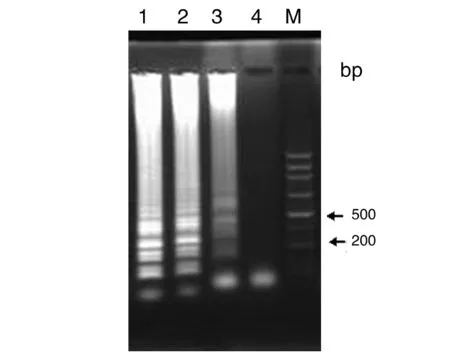
M:100bp DNA ladder Marker1:65 ℃;2:63 ℃;3:60 ℃;4:55 ℃图1 LAMP反应温度的优化Fig.1 Effect of reaction temperature on the LAMP produce
2.1.1.2 反应时间筛选结果 在63 ℃恒温下选择15、30、45和60 min 4个时间点分别进行LAMP扩增,琼脂糖凝胶电泳检测结果显示扩增45 min时已经能够看到梯状电泳条带,但是量较少,而60 min时扩增带的非常清晰,说明60 min为反应的最佳扩增时间。结果见图2。
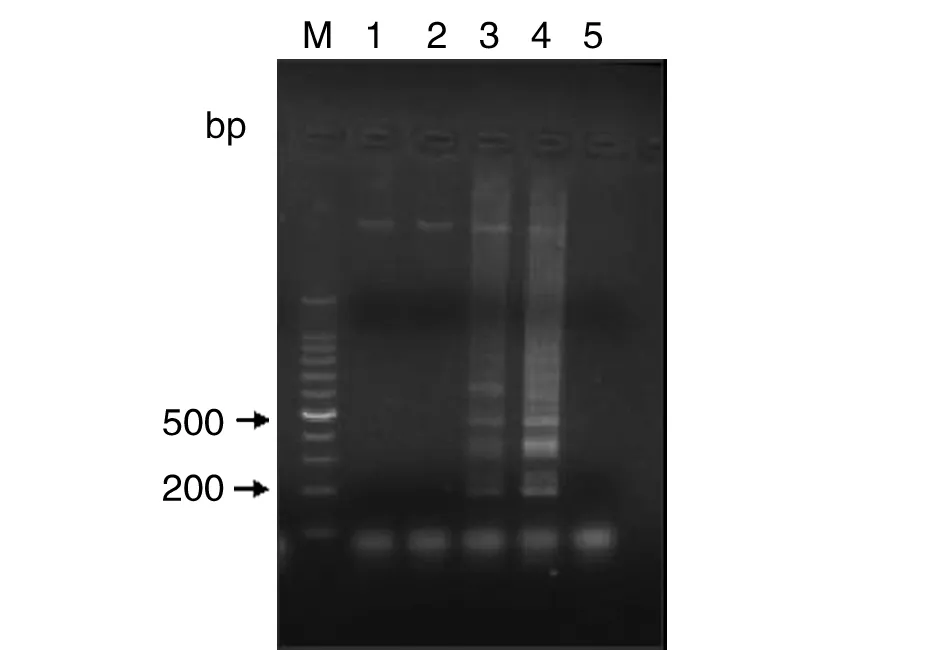
M:100bp DNA ladder Marker1:15 min;2:30 min;3:45 min;4:60 min;5:negative control图2 LAMP反应时间的优化Fig.2 Effect of reaction time on the LAMP produce
2.1.1.3 LAMP-LFD反应条件摸索 取阴性和阳性LAMP扩增产物,使用横向流动试纸条读取LAMP结果,可见阳性产物的试纸条的阳性检测线和质控线均出现红色带,阴性产物的试纸条只在质控线出现红色带。结果见图3。
2.2 特异性试验 试验结果表明所建立的猪链球菌LAMP-LFD检测方法能够特异地检测猪链球菌2型,检测大肠杆菌、蜡样芽苞杆菌、铜绿假单孢菌、无乳链球菌、停乳链球菌、金黄色葡萄球菌、甲型副伤寒沙门氏菌、表皮葡萄球菌、痢疾志贺氏菌、猪链球菌1型、猪链球菌7型和猪链球菌9型均为阴性。从图4可见采用琼脂糖凝胶电泳和试纸条方法的检测结果完全一致。
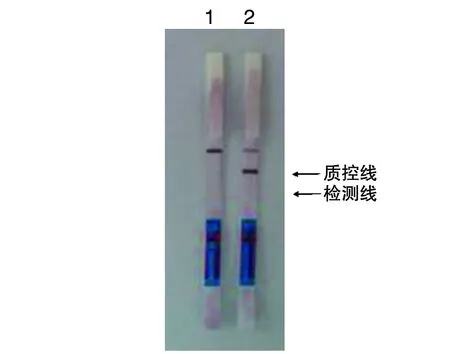
1:positive sample;2:negative sample图3 LAMP-LFD检测结果Fig.3 Result of LAMP-LFD
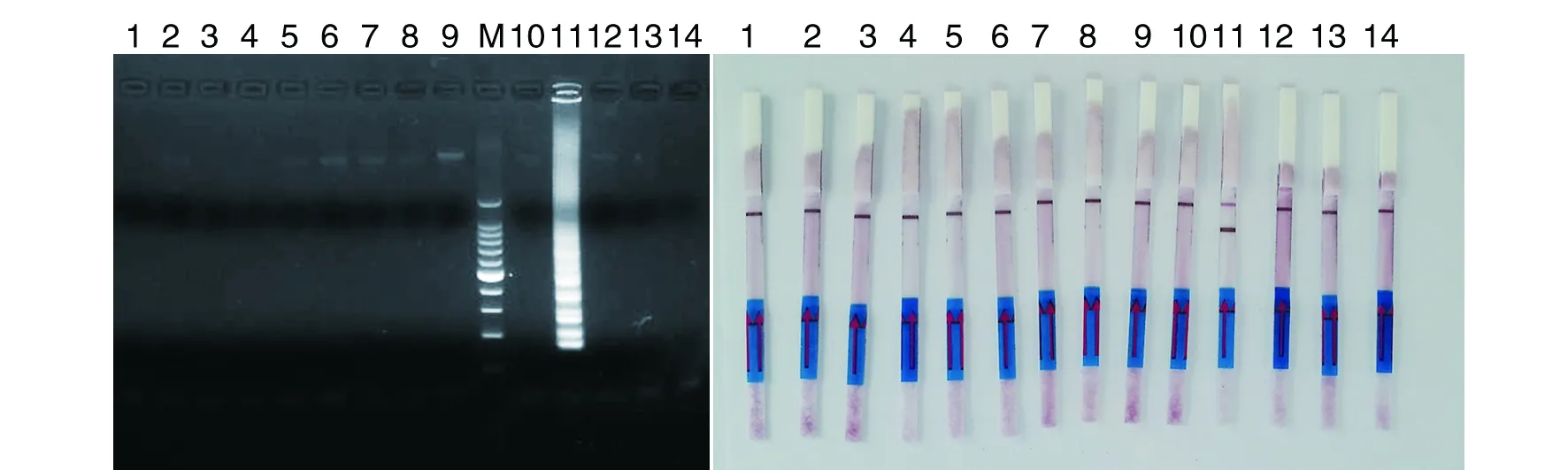
1:空白;2:大肠杆菌 (O157:H7,CVCC 83726);3:蜡样芽苞杆菌;4:铜绿假单孢菌;5:停乳链球菌(CVCC 18847);6:停乳链球菌(CVCC 588);7:金黄色葡萄球菌(CAU0789);8:甲型副伤寒沙门氏菌(CVCC 2187);9:表皮葡萄球菌(CAU0244);10:痢疾志贺氏菌(CVCC 1881);11:猪链球菌2型(CVCC 3307);12:猪链球菌1型(S428);13:猪链球菌7型(8074);14:猪链球菌9型(DAN22083);M:100bp DNA ladder Marker1:negative control;2:Escherichia coli (O157:H7,CVCC 83726);3:Bacillus cereus;4:Pseudomonas aeruginosa(Schroter)Migula;5:Streptococcus agalactiae(CVCC 1887);6:Streptococcus dysgalactiae(CVCC588);7:Staphylococcus aureus(CAU0789);8:Salmonella aratyphi-A(CVCC 2187);9:Staphylococcus epidermidis(CAU0244);10:Shigella dysenteriae(CVCC 1881);11:Streptococcus suis serotype 2(CVCC 3307);12:Streptococcus suis serotype 1(S428);13:Streptococcus suis serotype 7(8074);14:Streptococcus suis serotype 9(DAN22083);M:100 bp DNA ladder Marker图4 LAMP特异性试验结果Fig.4 Result of LAMP specificity test
2.3 敏感性试验 从图5可看出PCR的最低检测限为760 cfu/mL,LAMP电泳法和LAMP-LFD的最低检测限为76 cfu/mL,比PCR的敏感性高10倍。
2.4 重复性和稳定性试验 取同一次和不同时间提取的链球菌DNA各5份,将其作为模板进行5次LAMP扩增,反应后结果完全一致,说明所建立的方法具有良好的重复性和稳定性。
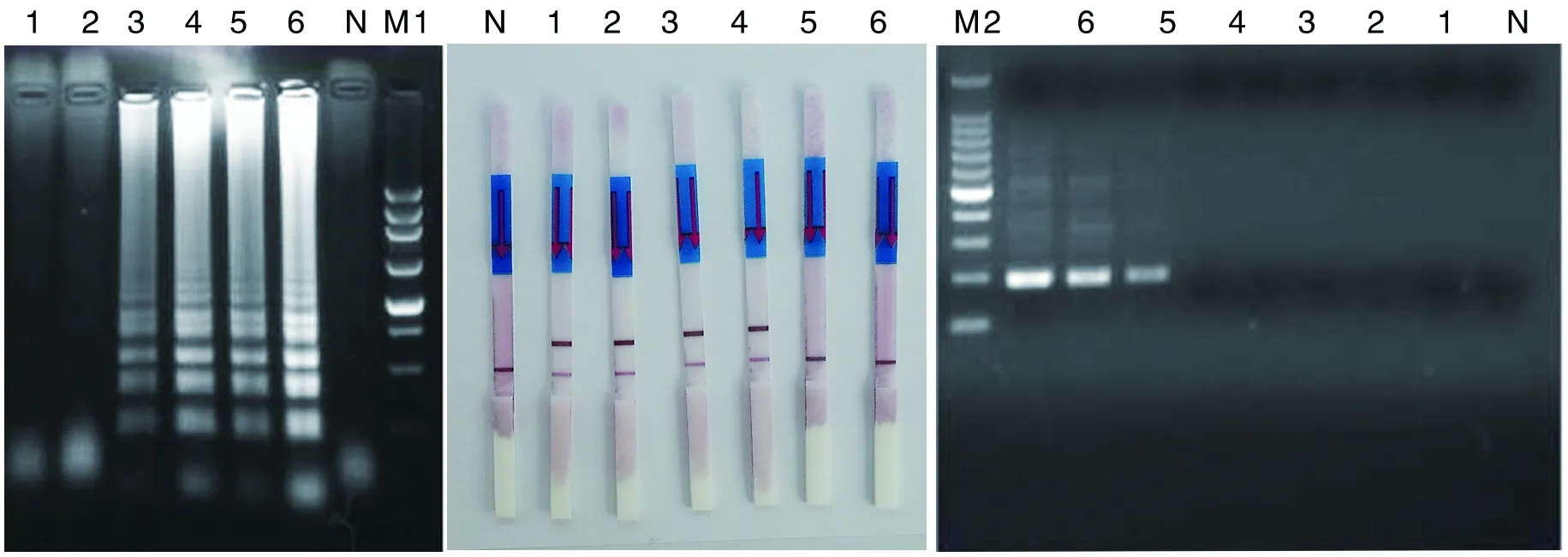
M1:250 bp DNA ladder Marker M2:100 bp DNA ladder Marker 1:0.76 cfu/mL;2:7.6 cfu/mL;3:76 cfu/mL;4:7.6×102 cfu/mL;5:7.6×103 cfu/mL;6:7.6×104 cfu/mL;N:negative control图5 LAMP(A)、LAMP-LFD(B)、PCR(C)检测方法的敏感性试验Fig.5 Sensitivity of LAMP (A), LAMP-LFD (B) and PCR (C)
2.5 应用试验
2.5.1 试验模拟样品的检测 分别应用细菌分离培养方法和建立的方法对50份试验模拟样品进行检测,结果细菌分离培养法检测到阳性样品12份,LAMP-LFD方法检测到样品14份。
2.5.2 市售样品的检测 使用细菌分离培养法和LAMP-LFD两种方法对市场和屠宰场随机采集的50份猪肉样品进行检测,结果2种方法均未检出猪链球菌2型。
2.5.3 数据统计分析 用SPSS17.0软件对上述结果进行分析,结果表明细菌分离培养法和LAMP-LFD方法之间差异无统计学差异(表2),LAMP-LFD方法的灵敏度为91.67%,特异度为96.60%。
表2 两种方法检测结果比较[3]Tab.2 Comparison of results for two methods
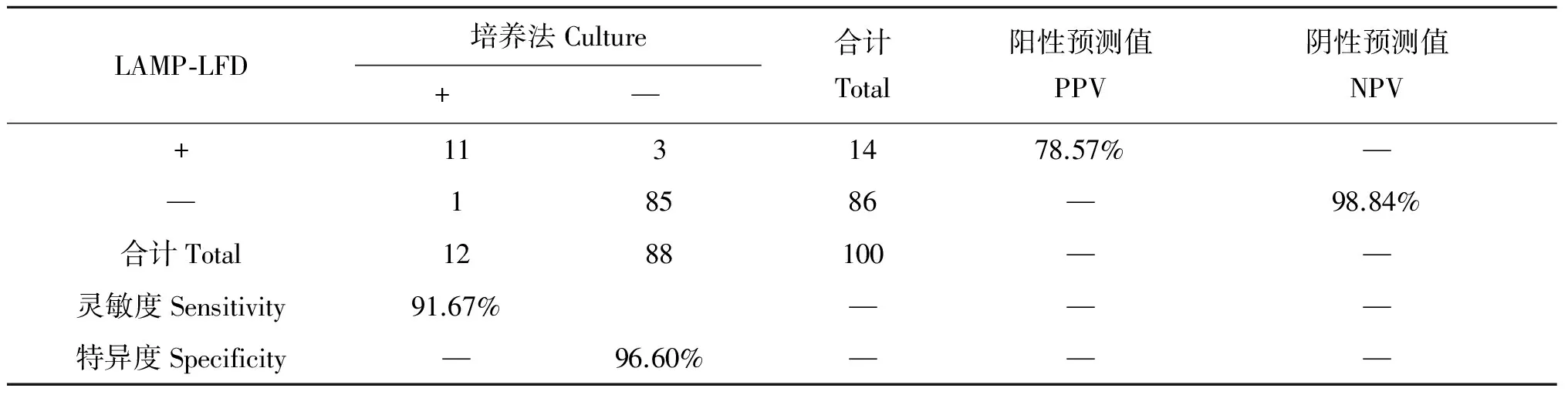
LAMP⁃LFD培养法Culture+—合计Total阳性预测值PPV阴性预测值NPV+1131478.57%——18586—98.84%合计Total1288100——灵敏度Sensitivity91.67%———特异度Specificity—96.60%———
Note:χ2=0.683,P=0.625>0.05,两种方法无统计学差异。
3 讨 论
猪链球菌2型引起的感染在养猪业中被认为是一个全球性问题。1951年,Jansen和Van Dorssen在世界范围内首次报道人感染猪链球菌病例。1998年我国首次报道人感染猪链球菌病例。2012年浙江省瑞安地区从血液和脑脊液中分离到了猪链球菌2型,后经MLST和毒力基因鉴定为高致病株[4]。鉴于猪链球菌2型对养殖业和人类健康安全造成的重大威胁,建立快速、敏感和特异的检测方法,对该病的诊断及研究具重要意义。
国内外已报道的猪链球菌诊断方法有很多种,其中细菌分离培养方法最为经典,是确诊疾病的重要手段,但该方法费时费力,而且样品尤其是食品中致病菌的含量很低,分布也不均匀,采用分离细菌的方法容易漏检。分子生物学方法的发展显著提高了检测的敏感性。谈忠鸣等[5]建立的猪链球菌2型快速PCR可检测到103稀释的DNA,朱静等[6]建立的荧光定量PCR的最低检测限达32 cfu/mL。张九州等[7]等根据GenBank登录的SS2特异的荚膜多糖(cps2H)基因序列作为检测靶标,建立了一种检测SS2的LAMP方法,其最低检测量为0.186 fg/μL模板DNA,且与其他常见的细菌无交叉反应。Jinhai Zhang等[8]也报道了一种检测SS2cps2J基因的LAMP方法,研究人员分别采用SYBR Green、凝胶电泳、比浊、钙黄绿素测定和羟基萘酚蓝检测等方法对扩增产物进行检测,结果表明SYBR Green、凝胶电泳和钙黄绿素检测方法的灵敏度较高,最低检测限为7.16拷贝/反应,与荧光定量PCR方法灵敏度相当。本研究建立了一种能检测猪链球菌2型血清型的LAMP-LFD方法,该方法采用LFD试纸条对LAMP扩增产物进行检测,最低能够检测到76 cfu/mL的细菌,其敏感性与朱静等报道的荧光定量PCR方法处于同一数量级。迄今,已经报道的LAMP扩增产物检测方法较多。应用最为广泛的是琼脂糖凝胶电泳和SYBR Green、钙黄绿素测定等方法。琼脂糖凝胶电泳是常用的方法之一,其不足之处是易产生气溶胶的污染,导致假阳性。与SYBR Green、钙黄绿素测定等其它可视化LAMP产物检测方法相比,LFD方法在LAMP引物的设计中,2条促环引物分别标记了异硫氰酸荧光素(Fluorescein isothiocyanate,FITC)和地高辛(Digixon,Dig),当LAMP扩增后,阳性扩增产物具有FITC和Dig的双重标记。依据免疫学反应原理,扩增产物通过FITC与试纸条上胶体金标记的抗异硫氰酸荧光素的抗体特异性结合,形成三元复合物,经过层析作用,由Dig与试纸条检测线上的检测线上的生物素相结合,呈现出红褐色。由于抗原-抗体的免疫学筛选左右,LFD方法具有更良好的特异性[9-11]。
猪链球菌血清型众多,荚膜多糖(cps)为公认的猪链球菌毒力因子,它能保护细菌在非免疫动物体内不被吞噬[12]。猪链球菌2型的荚膜多糖共有cps2Z、2J等14个开放阅读框,其中cps2J基因除与1/2型有较高同源性外,与其他血清型序列同源性都很低,是目前国内外利用分子生物学技术鉴别猪链球菌2型种型的靶基因[8,13]。本研究所建立的LAMP方法选择猪链球菌cps2J基因作为靶基因,设计了一组型特异性引物,试验结果显示,该方法与大肠杆菌、铜绿假单孢菌、无乳链球菌、停乳链球菌、金黄色葡萄球菌、甲型副伤寒沙门氏菌、表皮葡萄球菌、痢疾志贺氏菌以及猪链球菌1、7、9型等12种食源性病原细菌均无交叉反应,具有较高的特异性。
为了验证本研究建立方法在动物性食品中应用的可能性,研究人员将培养的SS2加入匀浆后的猪肉样品中,应用建立的方法进行食品中病原菌模拟检测,结果表明该方法可直接用于样品中猪链球菌2型的检测,其最低能够检测到76 cfu/mL的细菌。综上,本方法具有快速、特异、敏感等特点,不需特殊仪器设备和专业的实验条件,操作更为简便,非常适用于临床和基层使用,对猪链球菌2型突发公共卫生事件应急处置的早期筛检中具有重要意义。
[1] Yu HJ, Jing HQ, Chen ZH, et al. HumanStreptococcussuisoutbreak, Sichuan, China[J]. Emerg Infect Dis, 2006, 12(6): 914-920. DOI:10.3201/eid1206.051194
[2] Chen WN, Fu RH, Liu FQ, et al. Epidemiological, control and prevention of the first human case infected withStreptococcussuisin Hunan province[J]. Prac Prev Med, 2007, 14(3): 708-710. DOI: 1006-3110(2007)03-0708-03 (in Chinese)
陈伟南,付仁和,刘富强,等.湖南省首例人链球菌感染病例的流行病学调查及预防控制[J].实用预防医学,2007,14(3):708-710.
[3] Li H, Sun F, Wen L, et al. Multiplex PCR for detection ofPlasmodiumfalciparumandPlasmodiumvivax[J]. Chin J Zoonoses, 2014, 30(3): 288-291. DOI: 10.3969/cjz.j.issn.1002-2694.2014.03.014 (in Chinese)
李欢,孙菲,文岚,等.多重PCR快速检测恶性疟和间日疟的研究[J].中国人兽共患病学报,2014,30(3):288-291.
[4] Wu DK, Liu GY, Xiong TJ, et al. Epidemiology investigation of one human case infected withStreptococcussuis[J]. Prac Prev Med, 2009, 16(1): 135-136. DOI: 1006-3110(2009)03-0135-02 (in Chinese)
吴登科,刘桂云,熊桃菊,等.一起人猪链球菌感染病例流行病学调查[J].实用预防医学,2009,16(1):135-136.
[5] Tan ZM, Bao CJ, Pan HX, et al. Establishment of fast PCR assay 5 species genes forStreptococcussuisserotype 2 and its application to detect strains isolated from Jiangsu[J]. Jiangsu J Prev Med, 2012, 6(23): 9-11. DOI: 1006-9070(2012)06-0009-03 (in Chinese)
谈忠鸣,鲍昌俊,潘红星,等.快速PCR检测猪链球菌2型方法的研究及应用[J].江苏预防医学,2012,6(23):9-11.
[6] Zhu J, Zhang JH, Hu D, et al. Establishment of multiplex real-time PCR to detect highly virulentStreptococcussuisserotype 2[J]. J Path Bio, 2012, 5(7): 325-328. DOI: 1673-5234(2012)05-0325-04 (in Chinese)
朱静,张锦海,胡丹,等.高致病性猪链球菌2型多重实时荧光定量PCR检测方法的建立[J].中国病原生物学杂志,2012,5(7):325-328.
[7] Zhang JZ, Li H, Yang X, et al. Development of the loop-mediated isothermal amplification for rapid detection ofStreptococcussuisserotype 2[J]. Chin Vet Sci, 2012, 42(4): 384-389. DOI: 1673-4696(2012)04-0384-06 (in Chinese)
张九州,李欢,杨霞,等.猪链球菌血清2型环介导等温扩增快速检测方法的建立[J].中国兽医科学,2012,42(4):384-389.
[8] Zhang JH, Zhu J, Ren H, et al. Rapid visual detection of highly pathogenicStreptococcussuisserotype 2 isolates by use of loop-mediated isothermal[J]. J Clin Microbiol, 2013, 10(51): 3250-3256. DOI: 10.1128/JCM.01183-13
[9] Kaewphinit T, Arunrut N, Kiatpathomchai W, et al. Detection ofMycobacteriumtuberculosisby using loop-mediated isothermal amplification combined with a lateral flow dipstick in clinical samples[J]. BioMed Res Int, 2013, 2013(1): 1-6. DOI: 101155/BMEiCon.2013-926230
[10] Luciano AR, Florencia M, Geogina O, et al. Rapid and sensitive detection ofCandidatusliberibacterasiaticusby loop mediated isothermal amplification combined with a lateral flow dipstick[J]. BMC Mic, 2014, 14(86): 1471-1480. DOI:10.1186/1471-2180-14-86
[11] Sun YL, Yen CH, Tu CF. Visual detection of canine parvovirus based on loop-mediated isothermal amplification combined with enzyme-linked immunosorbent assay and with lateral flow dipstick[J]. J Vet Med Sci, 2014, 76(4): 509-516. DOI:10.1292/jvms.13-0448
[12] Zhu QY, Zhang Q, Li KC, et al. Analysis on the virulence genes and molecular typing ofStreptococcussuistype 2 strains isolated from patients[J]. China Prev Med, 2016, 17(3): 202-206. DOI: 10.16506/j.1009-6639.2016.03.011 (in Chinese)
朱钱迎,张青,李克诚,等.人感染猪链球菌Ⅱ型菌株的毒力基因及分子分型特征分析[J].中国预防医学杂志,2016,17(3):202-206.
[13] Wang K, Fan W, Cai L, et al. Genetic analysis of the capsular polysaccharide synthesis locus in 15Streptococcussuisserotypes[J]. FEMS Micro Lett, 2011, 324(2): 117-124. DOI: 10.1128/AEM.03742-12
Rapid detection ofStreptococcussuisserotype 2 with loop mediated isothermal amplification combined with a lateral flow dipstick
ZHANG Li1, WANG Li-li1, WEI Cai-wen2, YANG Chun-lei1,LU Chao1, CHI Jing-jing1, YAN Ming-hua1
(1.TianjinVeterinaryResearchInsititution,Tianjin300384,China;2.ChinaInstituteofVeterinaryDrugControl,Beijing100081,China)
The aim of this study is to establish a rapid detection method forStreptococcussuisserotype 2. Six specific primers of transcription loop method were designed based on the conservative regions ofcps2Jgene ofS.suisserotype 2, two loop primers were respectively labeled by fluorescein isothiocyanate (FITC) and digoxin(Dig). After amplification, the products of LAMP were detected by lateral flow devices (LFD), then the LAMP-LFD was established. The assay was highly specific for theS.suisserotype 2. No cross-reaction was observed with any of the other pathogenic bacteria. The sensitivity of the assay was 76 cfu/mL. For the 100 suspected samples, 14 positive samples were identified by the LAMP-LFD method, while 12 positive samples were identified by culture method. The LAMP-LFD method had higher sensitivity than that of the culture method, butPvalue>0.05, that was not in significant level. The LAMP-LFD method established in this study was a simple and rapid operation with good sensitivity and specificity. It can be used as reliable method for animal produce detection ofS.suisserotype 2.
Streptococcussuisserotype 2;cps2Jgene; loop mediated isothermal; amplification; lateral flow dipstick
10.3969/j.issn.1002-2694.2016.012.007
国家高技术研究发展计划资助项目(No.2012AA101605),天津市农业科技成果转化与推广项目(No.201301030),天津市农业科学院基金项目(No.16003)联合资助
鄢明华,Email:yanmh81971@126.com
1.天津市畜牧兽医研究所,天津 300384; 2.中国兽医药品监察所,北京 100081
R379
A
1002-2694(2016)12-1077-06
2016-06-15;
2016-10-02

