蛇床子素增强TNF-α对骨肉瘤细胞凋亡诱导活性及机制研究
王锦军
蛇床子素增强TNF-α对骨肉瘤细胞凋亡诱导活性及机制研究
王锦军
目的观察蛇床子素增强肿瘤坏死因子对骨肉瘤细胞的凋亡能力及其机制。方法将骨肉瘤细胞系HOS分为对照组、TNF-α组及蛇床子素联合TNF-α组和蛇床子素+TNF-α+CYLD siRNA组;MTT法检测HOS细胞的细胞活力,Annexin V/PI染色检测HOS细胞的凋亡,免疫共沉淀联合Western blot法检测HOS细胞RIP1蛋白的泛素化,Western blot法检测HOS细胞caspase-8的活化和CYLD去泛素化酶的相对表达量。结果与对照组比较,TNF-α组、蛇床子素+TNF-α组对HOS细胞活力的抑制率增加 [(12.5±0.9)%、(58.6±3.8)%比0,P<0.05],TNF-α组、蛇床子素+ TNF-α组对HOS细胞凋亡诱导率提高(8.3±0.5)%、(39.9±2.5)%比(1.9±0.3)%,P<0.05],而蛇床子素+TNF-α+CYLD siRNA组的HOS细胞活力抑制率、HOS细胞凋亡诱导率均低于蛇床子素+TNF-α组[(22.1±1.2)%比(58.6±3.8)%,P<0.05;(13.5±0.9)%比(39.9±2.5)%,P<0.05]。与对照组、TNF-α组比较,蛇床子素+TNF-α组RIP1泛素蛋白相对表达量降低(0.28±0.02比1.00±0.07、0.81±0.06,P<0.05),蛇床子素+TNF-α组活化的caspase-8蛋白的相对表达量明显提高(0.46±0.04比0.01±0.01、0.08±0.02,P<0.05),蛇床子素+TNF-α组CYLD蛋白的相对表达量也明显增加(0.81±0.05比0.28± 0.02、0.30±0.02,P<0.05)。与蛇床子素+TNF-α组比较,蛇床子素+TNF-α+CYLD siRNA组RIP1泛素蛋白相对表达量增加(0.77±0.05比0.28±0.02,P<0.05),显示CYLD siRNA能显著抑制蛇床子素对TNF-α的协同作用。结论蛇床子素通过上调去泛素化酶CYLD的表达水平,促进TNF-α依赖的RIP1蛋白的去泛素化,进而诱导骨肉瘤细胞caspase-8的活化和凋亡的发生。
骨肉瘤;蛇床子素;TNF-α;RIP1;去泛素化;caspase-8;细胞凋亡
骨肉瘤是最常见的原发性恶性骨肿瘤,好发于儿童和青少年时期,很容易发生局部浸润和早期全身性转移,严重危害少年儿童人群的健康[1]。肿瘤坏死因子(TNF-α)是一种由活化的巨噬细胞分泌的多功能细胞因子,能介导细胞凋亡和炎症反应。TNF-α能诱导肿瘤细胞发生凋亡,然而为了获得令人满意的肿瘤治疗效果,临床中往往需要较大的TNF-α使用剂量,而病人往往不能耐受高剂量TNF-α造成的副作用[2]。因此,寻找TNF-α的增敏药物以降低它的使用剂量并避免其毒性反应具有十分重要的意义。本文研究蛇床子素是否能增强肿瘤坏死因子对骨肉瘤细胞的凋亡能力并研究其机制。
1 材料与方法
1.1 材料 噻唑蓝(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT)、蛇床子素(osthole)、肿瘤坏死因子(TNF-α),Annexin V/PI凋亡检测试剂盒购于美国Sigma-Aldrich。细胞蛋白提取液、RIP1(受体相互作用蛋白激酶1)抗体、RIP1泛素蛋白抗体、活化型caspase-8(cleaved caspase-8)抗体、CYLD(头帕肿瘤综合征蛋白)抗体和β-actin抗体购于美国Cell Signaling。蛋白G免疫共沉淀琼脂糖珠购于美国Santa Cruz。CYLD siRNA购于广州锐博生物科技有限公司。Lipofectamine 2000购于美国Invitrogen。ECL(增强型化学发光底物)试剂盒购于美国Pierce。
1.2 细胞培养 人骨肉瘤细胞系HOS购于美国ATCC(美国模式菌种收集中心)。将细胞置于含10%胎牛血清的DMEM培养基,37°C恒温培养箱中培养并通入5%CO2。
1.3 细胞活力检测 将HOS细胞按5×103/孔接种在96孔板上,分为对照组,TNF-α组,蛇床子素+ TNF-α组和蛇床子素+TNF-α+CYLD siRNA组。对照组为HOS细胞不加药物培养48h,蛇床子素组为在HOS细胞中加入100mol/L的蛇床子素培养48h,TNF-α组为在HOS细胞中加入10ng/mL的TNF-α培养48h,蛇床子素联合TNF-α组为在HOS细胞中加入100mol/L的蛇床子素和10ng/mL的TNF-α培养48h,蛇床子素+TNF-α+CYLD siRNA组为先将50pmol/mL的 CYLD siRNA用 Lipofectamine 2000转染入HOS细胞培养24h,之后更换培养基再加入100mol/L的蛇床子素和10ng/mL的TNF-α继续培养48h。药物处理完毕后在培养体系中加入20μL 5g/L MTT再培养4h,弃去上清,往孔中加入150μL
1.4 细胞凋亡实验 将HOS细胞按1×106/孔接种在6孔板上,分为对照组,TNF-α组,蛇床子素+ TNF-α组和蛇床子素+TNF-α+CYLD siRNA组。药物处理同上。药物处理完毕后将细胞用生理盐水洗涤2次,按照凋亡试剂盒说明书步骤将PI(碘化丙啶)和Annexin-V加入细胞中孵育20min,采用流式细胞术检测肿瘤细胞的凋亡,凋亡率用Annexin-V阳性、PI阴性细胞数占总细胞数的百分比表示。
1.5 免疫共沉淀 将HOS细胞接种在细胞培养瓶中,待细胞铺满培养瓶后进行实验,分组及药物处理同上。药物处理完毕后对HOS细胞进行计数,取2× 106的各组细胞用免疫沉淀缓冲液进行裂解,缓冲液的成分如下:50mmol/L Tris-HCl(pH 7.4),1%NP-40细胞裂解液,150mmol/L NaCl,1mmol/L EDTA,1%混合蛋白酶抑制剂(Sigma-Aldrich)。HOS细胞在裂解液下处理15min后,将其在12 000g下离心10min,收取上清液并在其中加入RIP1抗体孵育过夜,之后加入蛋白G琼脂糖珠孵育2h。孵育完成后将其在1200g速度下离心5min,将琼脂糖珠离心至管底,之后将上清小心吸去,琼脂糖珠用免疫沉淀缓冲液洗涤2次后加入Western blot上样缓冲液,沸水浴煮5min后备用,用于检测与RIP1结合的泛素蛋白。
1.6 Western blot实验 将HOS细胞接种在细胞培养瓶中,待细胞铺满培养瓶后进行实验。实验分为对照组、蛇床子素组、TNF-α组、蛇床子素+TNF-α组和蛇床子素+TNF-α+CYLD siRNA组,药物处理同上。药物处理完毕后将细胞用生理盐水洗涤2遍并提取总蛋白质。将蛋白提取液或免疫共沉淀处理样品用12.5%SDS-PAGE进行电泳分离。分离完毕后通过电转方法将蛋白质从分离胶上转到PVDF膜上,用RIP1泛素蛋白抗体,cleaved caspase-8抗体,CYLD抗体或β-actin抗体孵育过夜,之后再用带辣根过氧化物酶的二抗孵育2h,蛋白条带用ECL试剂盒显色发光。蛋白灰度值分析用Image J软件处理。cleaved caspase-8和CYLD、相对表达水平用蛋白灰度值与β-actin灰度值比值表示。与RIP1结合的泛素蛋白的相对表达水平用以下公式计算:泛素蛋白相对表达水平=灰度值治疗组/灰度值对照组。对双边t检验,P<0.05认为差异有统计学意义。
2 结 果
2.1 蛇床子素通过CYLD途径显著提高TNF-α对HOS的凋亡诱导效应 将HOS细胞用蛇床子素和TNF-α处理后用MTT法检测它们的细胞活力并用Annexin V/PI染色法检测细胞的凋亡。结果发现蛇床子素能显著提高TNF-α对HOS细胞的杀伤活性和凋亡诱导活性,然而转染CYLD siRNA后蛇床子素对TNF-α的协同效应受到明显抑制,见表1。
2.2 蛇床子素通过上调去泛素化酶CYLD的表达促进TNF-α依赖的RIP1去泛素化 为了明确蛇床子素对TNF-α发挥协同效应的分子机制,作者进行了后续实验。通过免疫共沉淀及Western blot实验我们发现蛇床子素能显著促进TNF-α依赖的RIP1去泛素化,进而显著活化HOS细胞内的caspase-8诱导细胞发生凋亡。通过进一步实验作者发现蛇床子素促进RIP1蛋白去泛素化的机制可能和上调CYLD蛋白的表达量有关,将CYLD进行基因沉默后,蛇床子素丧失了对RIP1蛋白去泛素化的促进作用,同时caspase-8的活化受到了明显抑制,结果见表2。
表1 蛇床子素显著提高TNF-α对HOS细胞的抗肿瘤活性(±s)
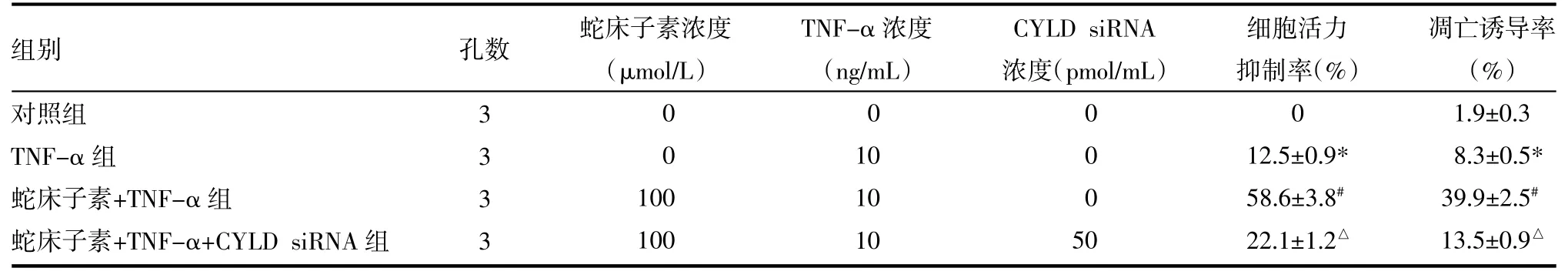
表1 蛇床子素显著提高TNF-α对HOS细胞的抗肿瘤活性(±s)
注:与对照组比较,*P<0.05;与TNF-α组比较,#P<0.05;与蛇床子素+TNF-α比较,△P<0.05。TNF-α:肿瘤坏死因子-α;CYLD siRNA:头帕肿瘤综合征蛋白小干扰RNA
?
表2 蛇床子素促进TNF-α依赖的RIP1蛋白去泛素化(±s)
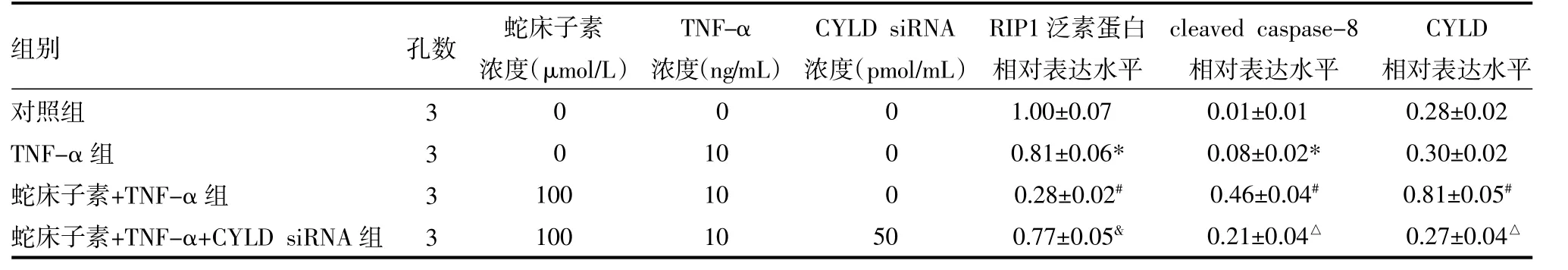
表2 蛇床子素促进TNF-α依赖的RIP1蛋白去泛素化(±s)
注:与对照组比较,*P<0.05;与TNF-α组比较,#P<0.05;与蛇床子素+TNF-α组比较,△P<0.05。TNF-α:肿瘤坏死因子-α;RIP1:受体相互作用蛋白激酶1;cleaved caspase-8:活化的半胱天冬酶8;CYLD:头帕肿瘤综合征蛋白;CYLD siRNA:头帕肿瘤综合征蛋白小干扰RNA
?
3 讨论
蛇床子素是从中药蛇床子中提取的活性物质,具有多种药理活性。近年研究发现,蛇床子素除了具有抗湿疹,抗皮肤瘙痒,抗炎症,抗肝炎等临床作用外,还具有显著的抗肿瘤活性[3-5]。TNF-α能诱导肿瘤细胞发生凋亡,因此TNF-α是一种有很好前景的抗肿瘤药物[6]。然而大剂量TNF-α所诱发的副作用大大限制了TNF-α的临床应用,因此研究如何提高肿瘤细胞对TNF-α的敏感性以降低其使用剂量是目前研究工作的重点。本研究显示蛇床子素能显著提高TNF-α对骨肉瘤细胞的杀伤活性和凋亡诱导能力,因此蛇床子素是一种有良好前景的TNF-α辅助治疗药物。
在TNF-α诱导的凋亡通路中,RIP1蛋白的去泛素化是其中的关键步骤。当TNF-α与其受体结合后,细胞中的RIP1蛋白会发生去泛素化,继而形成RIP1依赖的死亡受体复合物,该复合物能进一步活化caspase-8最终导致凋亡的发生。在本研究中,笔者首次发现蛇床子素能显著促进TNF-α依赖的骨肉瘤细胞RIP1蛋白的去泛素化。当肿瘤细胞中的RIP1蛋白发生去泛素化后,肿瘤细胞中的caspase-8发生显著活化,且凋亡程度显著增加,实验结果与文献报道一致[7],表明蛇床子素能通过RIP1途径发挥对TNF-α的协同作用。
本研究发现蛇床子素在HOS细胞中的直接靶点是CYLD蛋白,它能显著增加骨肉瘤细胞CYLD的表达水平。当在骨肉瘤细胞中转染CYLD siRNA抑制CYLD的表达后,蛇床子素对TNF-α的协同抗肿瘤作用丧失,证明CYLD的过表达是蛇床子素发挥对TNF-α协同作用的分子机制。去泛素化酶CYLD是一种肿瘤抑制因子,当TNF-α与相应受体结合后,凋亡通路被激活,CYLD被募集到RIP1蛋白周围并特异性去除RIP1蛋白上的泛素蛋白,从而激活RIP1蛋白依赖的死亡受体复合物和凋亡信号通路,因此CYLD的表达水平在一定程度上决定了肿瘤细胞对TNF-α的敏感性。这些文献报道[8-9]与本实验结果一致,表明蛇床子素增强TNF-α对骨肉瘤细胞凋亡诱导活性的机制可能是通过CYLD/RIP1/caspase-8途径。
综上所述,本研究证明蛇床子素能显著提高骨肉瘤细胞对TNF-α的敏感性。其机制是蛇床子素可能通过上调去泛素化酶CYLD的表达水平促进TNF-α依赖的RIP1蛋白的去泛素化进而诱导骨肉瘤细胞caspase-8的活化和凋亡的发生。这些研究为如何提高TNF-α的抗肿瘤活性,减少它的治疗副作用提供了新的思路和理论依据。
[1]Rad MP,Fattahi Masoum SH,Rad MS,et al.Primary Osteosarcoma of the Sternum:A case Report and Review of the Literature[J].Arch Bone Jt Surg,2014,2(4):272-275.
[2]Billiet T,Rutgeerts P,Vermeire S,et al.Targeting TNF-α for the treatment of inflammatory bowel disease[J].Expert Opin Biol Ther,2014,14(1):75-101.
[3]Wen YC,Lee WJ,Chien MH,et al.By inhibiting snail signaling and miR-23a-3p,osthole suppresses the EMT-mediated metastatic ability in prostate cancer[J].Oncotarget, 2015,6(25):21120-21136.
[4]Lin YC,Lin JC,Way TD,et al.Osthole inhibits insulin-like growth factor-1-induced epithelial to mesenchymal transition via the inhibition of PI3K/Akt signaling pathway in human brain cancer cells[J].J Agric Food Chem,2014,62(22):5061-5071.
[5]Gao Z,Wen Q,Zou S.Osthole augments therapeutic efficiency of neural stem cells-based therapy in experimental autoimmune encephalomyelitis[J].J Pharmacol Sci,2014,124 (1):54-65.
[6]Xie L,Jiang F,Zhang XK,et al.Honokiol sensitizes breast cancer cells to TNF-α induction of apoptosis by inhibiting Nur77 expression[J].Br J Pharmacol,2016,173(2):344-356.
[7]Mahul-Mellier AL,Pazarentzos E,Lin B et al.Deubiquitinating protease USP2a targets RIP1 and TRAF2 to mediate cell death by TNF[J].Cell Death Differ,2012,19(5):891-899.
[8]Vanlangenakker N,Vanden Berghe T,Zobel K et al.cIAP1 and TAK1 protect cells from TNF-induced necrosis by preventing RIP1/RIP3-dependent reactive oxygen species production[J].Cell Death Differ,2011,18(4):656-665.
[9]Ding Z,Liu Y,Shen A,et al.Spy1 induces de-ubiquitinating of RIP1 arrest and confers glioblastoma's resistance to tumor necrosis factor(TNF-α)-induced apoptosis through suppressing the association ofCLIPR-59 and CYLD[J]. Cell Cycle,2015,14(13):2149-2159.
(收稿:2016-04-15 修回:2016-05-29)
Osthole Promotes TNF-α-induced Apoptosis in Osteosarcoma and the Underlying Mechanism
WANG Jin->jun. Department of Pediatrics,Central Hospital of Jinhua City,Jinhua(321000),China
ObjectiveTo investigate the role of osthole in TNF-α-induced apoptosis in osteosarcoma and the underlying mechanism.MethodsHOS cells were divided into control group,TNF-α group,osthole group,osthole+TNF-α group,and osthole+TNF-α+CYLD siRNA group.The cell viability,cell apoptosis,ubiquitination of RIP1 protein, and the relative expression of cleaved caspase-8 and CYLD were detected by MTT assay,Annexin V/PI staining,coimmunoprecipitation together with Western Blot,respectively.Results The inhibitory rate of cell viability and the apoptotic rate of cells in TNF-α group group and osthole+TNF-α group were significantly higher than that in control group(12.5%±0.9%,58.6%±3.8%vs 0;8.3%±0.5%,39.9%±2.5%vs 1.9%±0.3%;all P<0.05).Those index in osthole+ TNF-α+CYLD siRNA group were significantly lower than those in osthole+TNF-α group(22.1%±1.2%vs 58.6%±3.8%; 13.5%±0.9%vs 39.9%±2.5%;all P<0.05).Compared with control group and TNF-α group,the relative expression of ubiquitin protein conjugated with RIP1 was significantly lower and the relative expression of cleaved caspase-8 was higher in osthole+TNF-α group(RIP1:0.28±0.02 vs 1.00±0.07,0.81±0.06;caspase-8:0.46±0.04 vs 0.01±0.01,0.08±0.02; CYLD:0.81±0.05 vs 0.28±0.02,0.30±0.02;all P<0.05).The relative expression of ubiquitin protein conjugated with RIP1 in osthole+TNF-α+CYLD siRNA group was significantly higher than that in osthole+TNF-α group(0.77±0.05 vs 0.28±0.02,P<0.05),indicating that transfection with CYLD siRNA significantly impaired the synergistic effect of osthole on the TNF-α-induced cell death and apoptosis.Conclusion Osthole promotes TNF-α-dependent deubiquitination of RIP1 and the subsequent cleavage of caspase-8 and apoptosis by upregulating the expression of CYLD.
osteosarcoma;osthole;TNF-α;RIP1;deubiquitination;caspase-8;apoptosis
浙江省金华市中心医院儿一科(金华 321000)

