过氧乙酸对池塘水体的增氧抑菌抑藻效果研究
张 帅,潘连德,郑 串
(上海海洋大学省部共建水产种质资源发掘与利用教育部重点实验室,上海201306)
过氧乙酸对池塘水体的增氧抑菌抑藻效果研究
张 帅,潘连德,郑 串
(上海海洋大学省部共建水产种质资源发掘与利用教育部重点实验室,上海201306)
为寻找一种既安全可靠,又能增加水体溶氧、杀灭水体病原菌并改善水体环境的抑藻试剂,用多功能水质分析仪检测在10、20、30℃条件下,过氧乙酸(体积分数为15%)在池塘水和蒸馏水中的放氧效果。结果表明:温度越高放氧越快,但温度越高氧气的饱和量越低,气体外溢,故测出的溶解氧浓度数值较低;采用滤纸片法和二倍稀释法测定过氧乙酸和3种常用杀菌剂对6种常见水产病原菌(副溶血弧菌、维氏气单胞菌、嗜水气单胞菌、溶藻弧菌、沃氏葡萄球菌和腐生葡萄球菌)的抑菌效果,结果显示,抑菌效果依次为恩诺沙星>过氧乙酸>聚维酮碘>高锰酸钾;对暂养的黄丝藻藻华进行毒杀,结果显示,随着时间的延长,加入高浓度过氧乙酸的试验组水体开始混浊,藻丝体开始断裂,叶绿素a含量减少;各时段下,过氧乙酸浓度组叶绿素a含量明显低于对照组(P<0.05),随着时间的延长各浓度组超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量均呈先增长后下降的趋势,说明黄丝藻藻丝体受到了过氧乙酸的破坏,开始解体甚至死亡。研究表明,在水产养殖池塘中使用过氧乙酸,增氧、抑菌、抑藻效果明显。
过氧乙酸;黄丝藻;增氧;抑菌;抑藻
随着水产养殖规模的不断扩大,养殖环境日趋恶化,各种病菌大量增加,水生动物病害日渐增多[1]。然而,常用杀菌药物的副产品和药物残留严重威胁着水产品安全,对人身健康造成了极大危害。市场上缺乏一种既能杀灭病菌又对环境和养殖动物不产生危害的药物。
在养殖水体和景观水体中,丝状藻类大量生长易形成藻华,消耗水中营养物质,并释放有毒物质,造成水质恶化。目前,主要靠物理法[2]、化学法[3]和生物法[4]控制藻华,但效果不理想,急需探求一种对环境破坏性小又便于长期操作的方法。
过氧乙酸是一种广谱、高效杀菌剂,杀菌能力强、价格低且使用方便。过氧乙酸通过其强氧化作用,可对病毒、真菌性病害和细菌性病害等产生较强的杀灭作用。用过氧乙酸杀灭孢子时其适应范围更广,能比其他杀菌剂更适应低温[5],其具有的酸性和氧化性,已被用于杀灭水体中的蓝绿藻和小球藻[6]。但过氧乙酸同大多数药物一样,受浓度、酸碱度、作用时间、温度、有机物和化学物质等因素的影响[7-8]。本研究中,分析了过氧乙酸在池塘中的增氧作用以及对常见水产病原菌和丝状藻藻华的抑制效果,旨在为水产养殖中更好地发挥其增氧、抑菌和抑藻效果提供参考依据。
1 材料与方法
1.1 材料
试验用过氧乙酸(体积分数为15%)由索尔维科技股份有限公司提供。黄丝藻Tribonema藻华采集于上海浦东新区临港新城一养殖池塘,去除其上所附的杂物,放入超白玻璃缸内,注入池塘水,于室内自然光照下暂养。试验用病原菌为BYK0621副溶血弧菌Vibrio parahemolyticus、4S-15维氏气单胞菌Aeromonas veronii、4S-12嗜水气单胞菌A.hydrophila、BYK0639溶藻弧菌V.alginolyticus、33沃氏葡萄球菌Staphlococcuswarneri、55腐生葡萄球菌S.soparophytics,均由上海海洋大学省部共建水产种质资源发掘与利用教育部重点实验室保存。
1.2 方法
1.2.1 过氧乙酸的增氧效果试验 在温度为(10± 1)、(20±1)、(30±1)℃条件下,分别取1 L蒸馏水和池塘水,在烧杯中加入过氧乙酸,使其浓度为1 mg/L,试验设3个重复组,用多功能水质分析仪测定水中溶解氧的浓度。
1.2.2 过氧乙酸对常见水产动物病原菌的抑菌效果试验 选择MHA为培养基,参照Nagashima等[9]的方法,采用滤纸片法分别检测浓度均为20 mg/L的过氧乙酸、高锰酸钾、恩诺沙星、聚维酮碘对副溶血弧菌、维氏气单胞菌、嗜水气单胞菌、溶藻弧菌、沃氏葡萄球菌、腐生葡萄球菌的抑菌效果。用麦氏比浊管测定接种在平板上的菌落浓度,使其维持在107~108CFU/mL,并于28℃条件下培养,24 h后测量其抑菌圈直径。
1.2.3 过氧乙酸对不同水产动物病原菌最小抑菌浓度(MIC)和最小杀菌浓度(MBC)的测定采用连续二倍稀释法,参照文献[10]中的方法测定MIC,将已知浓度的过氧乙酸进行二倍稀释,以液体培养基作为阳性对照。用麦氏比浊管控制培养基中菌的浓度,使其控制在3×108CFU/mL,并于恒温培养箱(28℃)中培养24 h,用肉眼观察和酶标仪测量相结合的方法判定MIC和MBC。澄清管为限制细菌生长的最小浓度,即MIC;将澄清管在MHA培养基上划线培养,无细菌生长时的最小浓度,即MBC。按照以上方法重复测定3次。
1.2.4 黄丝藻藻丝体的培养及过氧乙酸浓度的设定 分别称取2 g的黄丝藻藻丝体,用蒸馏水洗净,放于3 L含有BG11培养基的锥形瓶中,日光灯照射,用照度计测得光照强度为2000 lx,光暗比为12 h∶12 h,培养温度为(22±1)℃。过氧乙酸抑藻浓度分别设为0.5、1、2、5、10、20 mg/L,并设对照组,每组设3个重复。
1.2.5 过氧乙酸对黄丝藻藻丝体结构的改变 使用徕卡MD3000显微镜观察不同浓度下过氧乙酸对黄丝藻的毒性,观察不同时间下细胞壁、细胞膜、色素体的形态结构变化,并拍照。
1.2.6 过氧乙酸对黄丝藻叶绿素a含量的影响试验 用可见光分光光度计测定叶绿素a的含量,每隔24 h取样一次,每次取黄丝藻藻丝体0.08 g,用纸吸干、剪碎,放入有刻度的试管中,迅速转移至冰箱(-40℃)中冷冻12 h以上或过夜,取出后立即加入4 mL已经预热(80℃)的95%乙醇,并在恒温(80℃)水浴锅中萃取2 min,然后使用超声波细胞粉碎仪(冰浴中)进行粉碎,放入冰箱(4℃)中黑暗静置4 h后,转入离心管中,用95%的乙醇定容到8 mL,放入离心机中以4000~4500 r/min离心10 min,取上清液,用分光光度计测定630、645、663 nm波长下的吸光度值[11]。藻丝体中叶绿素a含量(mg/g)的计算公式为

其中:M为藻丝体质量(g);V为定容的体积(L)。
1.2.7 过氧乙酸对藻丝体超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量的影响试验 每24 h取样测定一次。具体测定参考Mitrovic等[12]的方法,取黄丝藻藻丝体0.20 g,用纸吸干、剪碎,加入冷却至4℃的0.05 mol/L磷酸缓冲液5 mL(pH 7.82,内含4 mmol/L EDTA-Na2),在低温下用超声波细胞粉碎仪破碎,破碎的浆液于4℃下以8000~10 000 r/min离心10 min,用上清液测定SOD活性和MDA含量,试验在24 h内测定完毕。
1.3 数据处理
试验结果均用平均值±标准差(mean±S.D.)表示。试验数据用SPSS 20.0软件进行单因素方差分析(One-Way ANOVY),用Duncan’s法进行多重比较,显著性水平设为0.05。
2 结果与分析
2.1 不同温度下过氧乙酸的放氧能力
从表1可见:过氧乙酸在水中有放氧的能力, 10℃下,4 h时蒸馏水中放氧量为10.460 mg/L,池塘水中为14.145 mg/L,均达到最大值;20℃下,3 h时蒸馏水中放氧量为9.910 mg/L,池塘水中为13.585 mg/L,均达到最大值;30℃下,2 h时蒸馏水中放氧量为8.075 mg/L,池塘水中为9.440 mg/L,均达到最大值。由此可知,温度越高过氧乙酸放氧越快,饱和量越低,因而导致气体外溢,故测出的溶解氧浓度数值较低。
2.2 4种试剂对6种病原菌的抑菌效果比较
从表2可见:4种试剂在抑菌效果中有明显的差距,恩诺沙星对维氏气单胞菌的杀菌效果最强,高锰酸钾对嗜水气单胞菌和沃氏葡萄球菌的杀菌效果最弱。总体看,恩诺沙星效果最好,过氧乙酸次之,高锰酸钾效果最差。
2.3 过氧乙酸对不同病原菌的M IC和MBC
从表3可见:过氧乙酸对6种水产常见病原菌菌的最小抑菌浓度和最小杀菌浓度结果显示,副溶血弧菌、嗜水气单胞菌、维氏气单胞菌、溶藻弧菌、腐生葡萄球菌的MIC均为32 mg/L,沃氏葡萄球菌的MIC为64 mg/L;嗜水气单胞菌、维氏气单胞菌、溶藻弧菌、腐生葡萄球菌的最小杀菌浓度为最小抑菌浓度的2倍,均为64 mg/L,副溶血弧菌、沃氏葡萄球菌的MBC为128 mg/L,其中,沃氏葡萄球菌最小杀菌浓度为最小抑菌浓度的2倍,副溶血弧菌则为4倍。
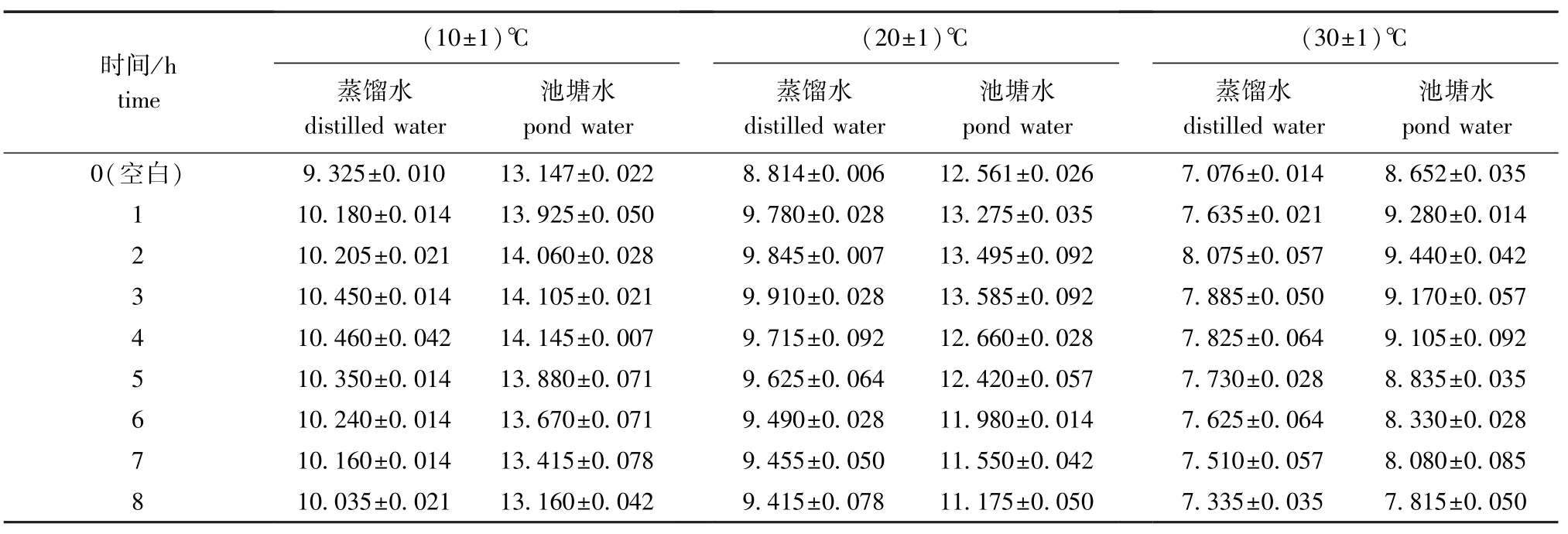
表1 不同温度下过氧乙酸在蒸馏水和池塘水中的放氧量Tab.1 Amount of dissolved oxygen released by peracetic acid in distilled water and fish pond water at different temperature mg/L
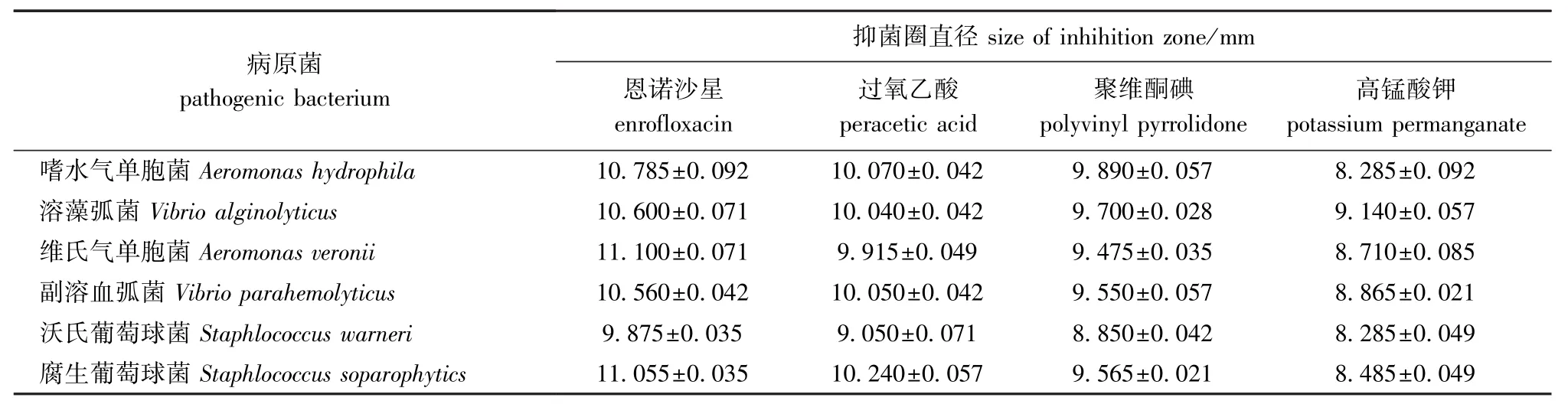
表2 4种试剂对6种病原菌的抑菌效果Tab.2 Bacteriostatic efficacy of four reagents against pathogens

表3 过氧乙酸对病原菌的最小抑菌浓度和最小杀菌浓度Tab.3 Acetic acid peroxide of pathogenic bacterium of the m inimal inhibitory concentrations M IC and MBC m inimum bactericidal concentration mg/L
2.4 过氧乙酸对黄丝藻藻丝体结构的改变
从图1可见:48 h时,试验组水体开始变浑浊,对照组A生长旺盛,藻类呈深绿色,有大量气泡;B、C组藻类颜色变淡呈绿色,依然可见大量气泡,水体浑浊不明显;D、E、F组藻类颜色逐渐变淡呈黄褐色,水体发浑,藻类自溶现象明显;G组藻类呈灰白色,自溶现象非常明显,无气泡产生。这说明叶绿素a合成受阻,细胞解体。
从图2可见:48 h时,6个试验组与对照组出现明显差异,对照组A细胞结构完整,色素体饱满清晰;B组叶绿素a含量微量减少,质壁分离现象不明显;C~G组,随着过氧乙酸浓度的增大,细胞结构变模糊,色素体集中于细胞中间,质壁分离现象越来越明显。这说明处理48 h时各试验组叶绿体受到破坏,叶绿素的合成受到阻碍。
2.5 过氧乙酸对黄丝藻藻华水pH的改变
各组初始(0 h)时黄丝藻藻华水的pH值为7.230。从表4可见:添加过氧乙酸后,随着浓度的升高各浓度组pH逐渐下降;随着时间的延长,对照组pH稳步上升,说明黄丝藻生长状态很好; 0.5、1 mg/L浓度组藻类自身的光合作用效果强于过氧乙酸的酸性作用,故pH值均大于7.230,且呈上升趋势;2 mg/L浓度组藻类自身的光合作用效果弱于过氧乙酸的酸性作用,故48 h内pH值小于7.230,但藻类受损后并无大量死亡,随着时间的推移光合作用开始增强,72 h时pH开始上升;而5 mg/L及以上浓度组pH持续下降,藻类受损后没有恢复,说明丝状藻开始死亡。

注:A,对照组,藻呈深绿色,有气泡;B,浓度为0.5 mg/L,藻呈绿色,有气泡;C,浓度为1 mg/L,藻呈绿色,有气泡;D,浓度为2 mg/L,藻呈黄绿色,水体发浑;E,浓度为5 mg/L,藻呈黄绿色,水体发浑,有自溶现象;F,浓度为10 mg/L,藻呈黄褐色,水体发浑,自溶;G,浓度为20 mg/L,藻呈灰白色,自溶,接近死亡Note:A,in control group,the alga is dark green in color;B,at0.5mg/L,alga is green;C,at1 mg/L,alga is green;D,at2 mg/L,alga is yellow green in themurky water;E,at5 mg/L,alga is yellow green and autolysis;F,at10 mg/L,alga is tawny and autolysis;G,at20 mg/L, alga is greyish white and autolysis,almost death图1 48 h时过氧乙酸引起黄丝藻藻丝体中毒的外部形态结果Fig.1 External patterns of algaTribonemafilaments exposed to peracetic acid for 48 h

注:A,对照组,色素体饱满清晰;B,浓度为0.5 mg/L,叶绿素a含量微量减少;C,浓度为1 mg/L,细胞质细胞壁分离;D,浓度为2 mg/L,细胞结构变模糊,细胞质细胞壁分离;E,浓度为5 mg/L,细胞结构变模糊,细胞质细胞壁分离;F,浓度为10 mg/L,细胞结构变模糊,细胞质细胞壁分离,色素体集中于细胞中间;G,浓度为20 mg/L,细胞结构模糊,细胞质细胞壁分离,叶绿素a基本消失Note:A,in control group,pigment body is clear and full;B,at 0.5 mg/L,chlorophyll a is reduced in content;C,at 1 mg/L,cytoplasm cell wall is separated;D,at2 mg/L,cell structure is variable fuzzy,cytoplasm cellwall is separated;E,at 5 mg/L,cell structure is variable fuzzy, cytoplasm cell wall is separated;F,at10 mg/L,cell structure is variable fuzzy,cytoplasm cellwall is separated,and pigment in themiddle cell; G,at20 mg/L,cell structure is variable fuzzy,cytoplasm cell wall is separated,and chlorophyll a disappeared图2 48 h时过氧乙酸引起黄丝藻藻丝体中毒的显微结构结果(×40)Fig.2 M icroscopic structure of algaTribonemafilaments exposed to peracetic acid for 48 h(×40)

表4 添加过氧乙酸后黄丝藻藻华水pH的变化Tab.4 Changes in pH in algaTribonemabloom in thewater Containing peracetic acid at different time
2.6 过氧乙酸对黄丝藻叶绿素a含量的影响
从表5可见:各时间段下,随着过氧乙酸浓度的升高各浓度组叶绿素a含量逐渐下降,除0.5 mg/L浓度组24 h外,其余浓度组叶绿素a含量均显著低于对照组(P<0.05);随着时间的延长,对照组与低浓度组的叶绿素a含量基本呈增长趋势,而高浓度组受到刺激,出现了抑制现象,其中5 mg/L浓度组叶绿素a含量出现了先增长后降低的趋势,10、20 mg/L浓度组均呈下降趋势。
2.7 过氧乙酸对黄丝藻藻丝体SOD活性的影响
从表6可见:随着时间的推移,各试验组黄丝藻藻丝体SOD活性均呈先升高后降低的趋势,而对照组藻丝体SOD活性的变化规律也与之相同,可能与藻类对营养液的应激反应有关;处理72 h后,除10、20 mg/L浓度组的SOD活性增长外,其他各组均开始降低;96 h时,各试验组SOD活性与24 h时差异不大,除0.5 mg/L浓度组外,其他各组均显著高于对照组(P<0.05)。

表5 不同浓度过氧乙酸对黄丝藻藻丝体叶绿素a含量的影响Tab.5 Effects of different concentrations of peracetic acid on the chlorophyll a contents in algaTribonemafilamentsmg/g
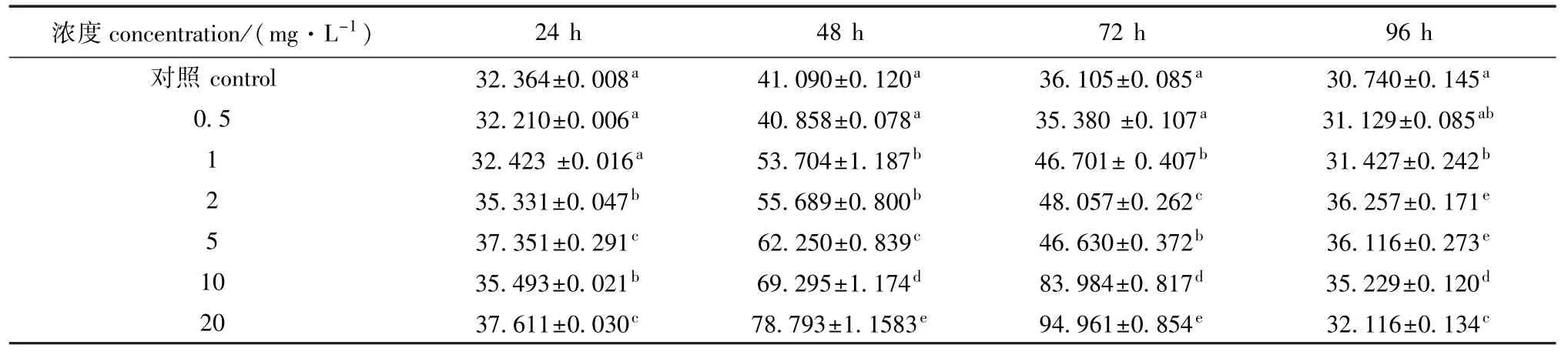
表6 不同浓度过氧乙酸对黄丝藻藻丝体SOD活性的影响Tab.6 Effects of different concentrations of peracetic acid on the SOD activities in algaTribonemafilaments U/mg
2.8 过氧乙酸对黄丝藻藻丝体MDA活性的影响
从表7可见:各时段下,各试验组MDA含量(除0.5 mg/L浓度组外)均显著高于对照组(P<0.05),且浓度越大,MDA含量越高;随着时间的延长,各试验组和对照组MDA含量均呈先增长后降低的趋势。这说明,试验组黄丝藻藻丝体由于受到胁迫,细胞遭到破坏。
3 讨论
3.1 过氧乙酸的增氧效果
过氧乙酸是过氧化物,分子结构不稳定,氧化则产生氧气,可增加水体的溶氧和氧化水中有害物质[13]。过氧乙酸的分解放氧速度与温度、不同介质关系明显[14]。温度越高放氧越快,但温度越高氧气的饱和度越低,所以气体会外溢。不同水质对过氧乙酸的稳定性有影响,主要是水质中金属离子和有机质对过氧乙酸分解有加速作用。此效果可用于水产养殖中救治缺氧动物和改善缺氧水体环境。
3.2 过氧乙酸的抑菌效果
过氧乙酸是酸性强氧化剂,可分解产生H2O,进一步分解生成原子氧、活性羟基自由基(·OH),在酸性条件下能产生很高的电极电位[15],通过氧化反应杀菌,夺取菌体电荷,破坏其结构,主要经酸性作用和氧化作用导致微生物死亡[16]。用过氧乙酸杀孢子时其适应范围更广,比H2O2更有潜力[17],低浓度杀菌时H2O2需要更高的剂量才能达到过氧乙酸的效果[6]。由于过氧乙酸具有弱酸性特性[18],故其在酸性条件下的效果要好于碱性条件下。过氧乙酸对不同水产动物病原菌的抑制效果不同,其对腐生葡萄球菌的抑菌效果最强,4种常用药物对常见病原菌的抑菌效果依次为恩诺沙星>过氧乙酸>聚维酮碘>高锰酸钾。聚维酮碘[19]、大黄提取物[20]等对常见病原菌的抑菌效果与本试验相似。此结果可用于水产养殖中水体微生态(菌相)调节,以此优化水体环境。
3.3 过氧乙酸对黄丝藻的杀灭效果
通过观察黄丝藻藻丝体结构的变化,并对其叶绿素a含量和SOD活性加以测定,可以发现,过氧乙酸对黄丝藻有抑制效果,且浓度越高其抑制效果越明显。王爱卿等[21]利用乙酸的酸性调节水体酸碱度来抑制黄丝藻藻华,裴海燕等[22]用臭氧的氧化作用杀铜绿微囊藻,这是通过两种不同的途径来抑制黄丝藻藻华的方法。过氧乙酸对单胞藻的灭杀也有过报道[23],但过氧乙酸控制丝状藻的研究尚未见报道,本试验中,过氧乙酸集合了酸性和氧化性的特点,在抑制或杀死黄丝藻藻华方面与之前研究有相似的效果。其作用机理推测为,过量的H+降低碳酸酐酶活性,从而使CO2浓缩机制受到影响[24],并使藻细胞的内部结构遭到破坏,从而使光合作用系统受到影响[25]。
叶绿素a是绿色植物光合作用必要元素,是其体内的基本色素[26],叶绿素a含量的高低直接影响植物对能量的利用和光合作用的进行,进而影响到能量的净积累[27]。随着藻类光合作用对CO2含量产生的影响,藻液的pH也随之变化,光合作用时pH增大,呼吸作用时pH降低。随着叶绿素a的减少,光合作用降低,pH也会随之降低。杨福利等[28]研究也表明,白天藻类光合作用导致藻液pH上升。异噻唑啉酮破坏棕囊藻叶绿素a的最低浓度为0.3 mg/L[29],而本试验中0.5 mg/L的过氧乙酸在试验48 h时黄丝藻叶绿素a的含量与对照组产生差异,说明过氧乙酸浓度为0.5 mg/L时对黄丝藻叶绿素就有抑制作用。在亚硝酸盐中,小球藻可诱导产生SOD[30]。本试验表明,在过氧乙酸环境下也可诱导黄丝藻产生SOD,与前者报道相似。陈孝花等[3]研究显示,过氧乙酸环境中,黄丝藻MDA含量随着Cu2+和异噻唑啉酮浓度的增加呈先升高后降低的趋势。上述结果均认为SOD酶活性和MDA含量下降,表明过氧乙酸会使酶系统失活,从而达到抑制黄丝藻的目的。过氧乙酸在抑制水体中丝状藻藻华的同时,由于其是酸性试剂,在藻华泛滥的碱性水体中能发挥很好的中和作用,可优化水体酸碱度,改善水环境。
综上所述,过氧乙酸具有乙酸和过氧化氢的特点,在水产养殖中可以同时发挥增氧、杀菌、抑藻等功效,在杀菌、抑藻的同时可对养殖水体有一定的改善效果,可以预见,过氧乙酸在未来水产养殖中具有广阔的应用前景,有关产品的研发和技术推广有待继续研究。
[1]张文文.常用渔药有效含量、杀菌效果比较及抗生素耐药性初步研究[D].舟山:浙江海洋学院,2014.
[2]梁好,韦朝海,盛选军,等.高铁酸盐预氧化、絮凝除藻的实验研究[J].工业水处理,2003,23(3):26-29.
[3]陈孝花,王爱卿,潘连德,等.两种除藻剂对黄丝藻藻华叶绿素a含量和抗氧化酶活性的影响[J].广东农业科学,2014,41 (18):136-140.
[4]Barry M J,Logan D C.The use of temporary pond microcosms for aquatic toxicity testing:direct and indirect effects of endosulfan on community structure[J].Aquatic Toxicology,1998,41(1-2): 101-124.
[5]Jones L A Jr,Hoffman R K,Phillips CR.Sporicidal activity of peracetic acid andβ-propiolactone at subzero temperatures[J].Applied and Environmental Microbiology,1967,15(2):357-362.
[6]Kitis M.Disinfection of wastewater with peracetic acid:a review [J].Environment International,2004,30(1):47-55.
[7]王冰姝,胡永成,陈惠珍,等.一元包装过氧乙酸消毒液的杀菌效果及毒性试验观察[J].中国热带医学,2006,6(1):18-20.
[8]乔梦阳,孙德栋,王玲玲,等.过氧乙酸预处理污泥对厌氧消化的影响[J].大连工业大学学报,2014,33(3):197-199.
[9]Nagashima Y,Sendo A,Shimakura K,etal.Antibacterial factors in skin mucus of rabbitfishes[J].Journal of Fish Biology,2001,58 (6):1761-1765.
[10]National Committee for Clinical Laboratory Standards.Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically[S].Approved standard M7-A3.3rd ed.Villanova, PA:National Committee for Clinical Laboratory Standards,1993.
[11]杨彩根,宋学宏,孙丙耀.浮游植物叶绿素a含量简易测定方法的比较[J].海洋科学,2007,31(1):6-9.
[12]Mitrovic SM,Allis O,Furey A,et al.Bioaccumulation and harmful effects ofmicrocystin-LR in the aquatic plantsLemna minorandWolffia arrhizaand the filamentous algaChladophora fracta[J].Ecotoxicology and Environmental Safety,2005,61(3):345-352.
[13]Kornienko V L,Kolyagin G A,Kornienko G V,etal.Use of aqueous hydrogen peroxide solutions prepared by cathodic reduction of oxygen for indirect oxidation of chemical substances in situ:a-chievements and prospects[J].Russian Journal of Applied Chemistry,2014,87(1):1-15.
[14]王传虎,方荣生.过氧乙酸制备条件的选择及其稳定性的研究[J].中国消毒学杂志,2006,23(2):100-102.
[15]Chaenko N V,Kornienko G V,Kornienko V L.Indirect electrosynthesis of peracetic acid using hydrogen peroxide generated in situ in a gas diffusion electrode[J].Russian Journal of Electrochemistry,2011,47(2):230-233.
[16]谭伟龙,钱万红,沈建忠.过氧乙酸杀菌剂研究进展[J].医学动物防制,2008,24(9):641-643.
[17]Wagner M,Brumelis D,Gehr R.Disinfection ofwastewater by hydrogen peroxide or peracetic acid:development of procedures for measurement of residual disinfectantand application to a physicochemically treatedmunicipal effluent[J].Water Environment Research,2002,74(1):33-50.
[18]Cavallini G S,De Campos SX,De Souza JB,et al.Evaluation of the physical–chemical characteristics of wastewater after disinfection with peracetic acid[J].Water,Air,&Soil Pollution, 2013,224:1752.
[19]刘诗瑶.高锰酸钾氧化恩诺沙星的产物识别及抑菌特性实验研究[D].哈尔滨:哈尔滨工业大学,2015.
[20]周群兰,郑小平,刘波,等.大黄提取物对嗜水气单胞菌的抑菌效果[J].江苏农业科学,2007(2):64-66.
[21]王爱卿,杨仕豪,李西雨,等.柠檬酸调节水体酸碱度抑制黄丝藻藻华的研究[J].淡水渔业,2016,46(3):52-59.
[22]裴海燕,胡文容.臭氧杀藻特性试验研究[J].工业水处理, 2003,23(9):55-57.
[23]Sung M G,Nam K,Jung JY,et al.Decomposition of peracetic acid after sterilization of amicroalgal cultivation system[J].Bioprocess Biosyst Eng,2015,38:517-522.
[24]程丽华,张林,陈欢林,等.微藻固定CO2研究进展[J].生物工程学报,2005,21(2):177-181.
[25]Satoh A,Kurano N,Miyachi S.Inhibition of photosynthesis by intracellular carbonic anhydrase inmicroalgae under excess concentrations of CO2[J].Photosynthesis Research,2001,68(3):215-224.
[26]Van Vierssen W,Hootsmans M,Vermaat J E.Lake Veluwe,a Macrophyte-Dominated System under Eutrophication Stress[M]. Netherlands:Springer,1994.
[27]马剑敏,马顷,苏秀燕,等.水绵对3种沉水植物的化感作用研究[J].河南农业科学,2011,40(9):70-73.
[28]杨福利,李秀辰,白晓磊,等.小球藻脱氮除磷及其生物量增殖潜力的研究[J].大连海洋大学学报,2014,29(2):193-197.
[29]洪爱华,尹平河,赵玲,等.碘伏和异噻唑啉酮灭杀球形棕囊藻机理的初步研究[J].暨南大学学报:自然科学版,2005,26 (3):396-400.
[30]Rabinowitch H D,Fridovich I.Growth ofChlorella sorokinianain the presence of sulfite elevates cell content of superoxide dismutase and imparts resistance towards paraquat[J].Planta, 1985,164(4):524-528.
Oxygenation,antim icrobial activity and algal control by acetic acid peroxide
ZHANG Shuai,PAN Lian-de,ZHENG Chuan
(Key Laboratory of Exploration and Utilization of Aquatic Genetic Resources,Ministry of Education,Shanghai Ocean University,Shanghai201306,China)
The amount of dissolved oxygen released by acetic acid peroxide(15%)wasmeasured in pond water and distilled water by a dissolved oxygenmeter atwater temperature of10,20 and 30℃and bacteriostatic efficacy of acetic acid peroxide and the other 3 conventional bactericides for six common aquatic pathogenic bacteria includingVibrio parahaemolyticus,V.alginolyticus,Aeromonas veronii,A.hydrophila,Staphylococcus warneri,andS.saprophyticuswas studied by filtermethod and double dilutionmethod to search a suitable algae inhibiting preparation with oxygenation,and antimicrobial activity.The results showed that the higher the temperature was,the more rapidly the dissolved oxygen released,with decrease in oxygen saturation and measured values as the elevated temperature.The sterilization order of the acetic acid peroxide and the other 3 conventional bactericideswas ranged as enrofloxacin>acetic acid peroxide>povidone lodine>potassium permanganate.An algal inhibition test revealed that algaTribonemacollected from aquaculture ponds appeared to be broken and to be decrease in chlorophyll a content,significantly lower chlorophyll a content than that in the control group(P<0.05),as high concentration of acetic acid peroxide was added into the test tanks.There were higher activity of superoxide dismutase(SOD)and content ofmalondialdehyde(MDA)first and then decrease in the alga exposed to various levels of acetic acid peroxide,indicating that the algawas damaged by acetic acid peroxide,evenmortality.The findings indicate thatacetic acid peroxide can be used in oxygenation,antimicrobial activity and algal control in aquaculture.
peracetic acid;Tribonema;oxygenation;bacteriostatic;algae inhibiting
S946.3
A
10.16535/j.cnki.dlhyxb.2016.06.012
2095-1388(2016)06-0651-07
2016-03-11
水产动物遗传育种上海市协同创新中心项目(ZF1206)
张帅(1989—),男,硕士研究生。E-mail:592923279@qq.com
潘连德(1960—),男,教授。E-mail:ldpan@shou.edu.cn

