TNF-α诱导人肺微血管内皮细胞凋亡Caspase-3活性的研究
吉圣珺,叶志坚,陈耀丰,刘剑,张培芳,郑韶欣
(1.佛山市第一人民医院呼吸内科,广东 佛山 528000;2.广州市中山大学孙逸仙纪念医院心内科,广东 广州 510120)
·论 著·
TNF-α诱导人肺微血管内皮细胞凋亡Caspase-3活性的研究
吉圣珺1,叶志坚1,陈耀丰1,刘剑1,张培芳1,郑韶欣2
(1.佛山市第一人民医院呼吸内科,广东 佛山 528000;2.广州市中山大学孙逸仙纪念医院心内科,广东 广州 510120)
目的 探讨凋亡“核心蛋白酶”-半胱氨酸蛋白酶-3(Caspase-3)在肿瘤坏死因子-α(TNF-α)诱导人肺微血管内皮细胞(HPMVECs)凋亡中的作用。方法体外培养HPMVECs,空白对照组置于CO2培养箱中常规培养,TNF-α组分别以10 ng/mL、20 ng/mL、50 ng/mL、100 ng/mL浓度刺激HPMVECs,使用MTT比色法检测各组细胞活性,AnnexinⅤ/PI双染色联合流式细胞术检测细胞凋亡率,流式细胞术检测Caspase-3的活性。结果空白对照组的细胞凋亡率及Caspase-3活性最低;空白对照组和TNF-α组(10 ng/mL、20 ng/mL、50 ng/mL)比较,100 ng/mL TNF-α组的相对细胞活性最低,而细胞凋亡率及Caspase-3活性最高,TNF-α诱导HPMVEC凋亡时呈现出浓度依赖性,随着时间的延长,Caspase-3活性逐渐升高(P<0.05)。结论TNF-α诱导人肺微血管内皮细胞凋亡呈现浓度依赖性,Caspase-3可能参与了这一细胞凋亡过程的调控。
肿瘤坏死因子-α;人肺微血管内皮细胞;凋亡;半胱氨酸蛋白酶-3
慢性阻塞性肺疾病(Chronic obstructive pulmonary disease,COPD)是全世界范围内发病率和死亡率最高的疾病之一。肺动脉高压(Pulmonary hypertension,PH)是其常见的并发症之一,PH的发生与COPD患者死亡率的显著增加相关[1]。缺氧及炎症引起肺血管收缩及重构是慢性阻塞性肺疾病发生肺动脉高压的重要病理生理基础,肺血管内皮损伤是PH发病的起始环节,而血管内皮细胞凋亡是血管内皮损伤的重要机制[2-3]。半胱氨酸天冬氨酸蛋白水解酶(Caspase)家族是一组特异性切割天冬氨酸残基上的肽键继而引起细胞凋亡的蛋白水解酶,是所有凋亡蛋白中最主要的执行者[4]。Caspase-3在血管内皮细胞的凋亡信号传导路径中占据着的核心地位,是凋亡信号传导的共同通路[5]。目前尚未见到有关于TNF-α诱导人肺微血管内皮细胞(HPMVEC)凋亡与Caspase-3活性变化的相关报道。本研究探讨了TNF-α诱导HPMVEC的凋亡及其可能的作用机制。
1 材料与方法
1.1 主要试剂及仪器 HPMVEC株购自上海细胞库,100 mL/L胎牛血清及高糖细胞培养基购自Hy-clone公司,四甲基偶氮唑蓝购自Sigma公司,Caspase-3活性检测试剂盒、流式细胞仪购自BD公司,异硫氰酸荧光素标记的膜联素Ⅴ/碘化丙啶(AnnexinⅤ-fluorescein isothiocyanate/propidium iodide,AnnexinⅤ-FITC/PI)凋亡检测试剂盒购自瑞士Roche公司。
1.2 HPMVEC的复苏和传代培养 从液氮保存罐中取出冻存管(含原代HPMVEC),立即放入37℃水浴中,快速摇晃,直至冻存液完全融化。将其置于含100 mL/L胎牛血清的DMEM培养液中,在37℃、50 mL/L CO2培养箱中培养,隔天换液。内皮细胞呈鹅卵石样贴壁生长,当细胞生长至90%汇合时用2.5 g/L乙二胺四乙酸(Ethylene diamine tetraacetic acid,EDTA)胰蛋白酶进行消化传代,取第4代血管内皮细胞进行实验。
1.3 实验分组及处理 空白对照组:用100 mL/L胎牛血清的DMEM培养基处理内皮细胞,置于50 mL/L CO2培养箱中常规培养;TNF-α组:分别用10 ng/mL、20 ng/mL、50 ng/mL、100 ng/mL TNF-α进行刺激,然后用100 mL/L胎牛血清的DMEM培养基处理内皮细胞,置于50 mL/L CO2培养箱中常规培养。
1.4 MTT法检测HPMVEC的增殖活性 MTT比色法测定各组细胞的活性。收集对数期细胞,调整细胞数;以4 000个/孔细胞接种到96孔板中。37℃、50 mL/L CO2条件下孵育1 d;弃去培养液,按上述实验分组方法处理细胞。吸干培养基,每孔加入20 μL MTT溶液,继续孵育4 h,终止培养。小心吸弃孔内培养上清液,每孔加入150 μL DMSO溶液,置摇床上低度振荡10 min,用酶标仪检测490 nm波长各孔的吸光度(A)值。细胞活力=(A处理组-A空白管)/(A空白对照组-A空白管)× 100%。
1.5 AnnexinⅤ/PI双染色联合流式细胞术检测HPMVEC的凋亡 细胞分为空白对照组、TNF-α处理组。每组取3个6孔板的培养孔,胰蛋白酶消化(不含EDTA)收集细胞,1 000×g离心5 min,弃上清。磷酸盐缓冲液(PBS)重悬细胞后,离心,重复两次后弃上清。分别加入结合缓冲液200 μL重悬并进行细胞计数,调整细胞数。取200 μL细胞悬液,加入5 μL annexinⅤ-FITC混匀,室温避光10 min。再加入5 μL PI染液混匀,流式细胞仪进行检测分析:每份样品取1×104个细胞PI染色,做DNA分析。
1.6 Caspase-3的活性检测 根据预实验结果,实验分为空白对照组、TNF-α处理组。分别收集各组细胞。1 500 r/min离心10 min,用预冷的PBS洗涤细胞两次;4℃、300×g离心5 min,收集(1~5)×105个细胞;加氟甲基酮标记的转录因子2-天冬氨酸-谷氨酸-缬氨酸-天冬氨酸(Transcription factor 2-Asp-Glu-Val-A sp-fluoromethylketone,TF2-DEVD-FMK),37℃反应1 h;流式细胞术分析Caspase-3阳性细胞数和平均荧光强度[6-7]。
1.7 统计学方法 应用SPSS17.0统计学软件进行数据分析,计量资料以均数±标准差(±s)表示,多组比较采用单因素方差分析,组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 MTT比色法检测细胞活性 10 ng/mL、20 ng/mL、50 ng/mLTNF-α处理组与100 ng/mLTNF-α处理组间差异有统计学意义(P<0.05),而100 ng/mL TNF-α处理组的相对细胞活性明显低于空白对照组(P<0.01),TNF-α对细胞活性的抑制与TNF-α剂量呈现剂量依赖关系,见表1。

组别空白对照组TNF-α处理组10 ng/mL 20 ng/mL 50 ng/mL 100 ng/mL OD值1.97±0.05相对细胞活性(%) 100±0.00 1.84±0.01 1.81±0.02a1.71±0.02a1.53±0.02abcd93.68±3.30 92.24±2.55a87.30±2.64a77.93±2.97abcd
2.2 AnnexinⅤ/PI检测HPMVEC凋亡 10 ng/mL、20 ng/mL、50 ng/mL TNF-α处理组与空白对照组间差异均有统计学意义(P<0.05),而100 ng/mL TNF-α处理组的细胞凋亡率最高(P<0.01),TNF-α对细胞活性的抑制与TNF-α剂量呈现剂量依赖关系,见表2。
表2 不同剂量TNF-α刺激下HPMVEC的凋亡率检测(n=3,±s)
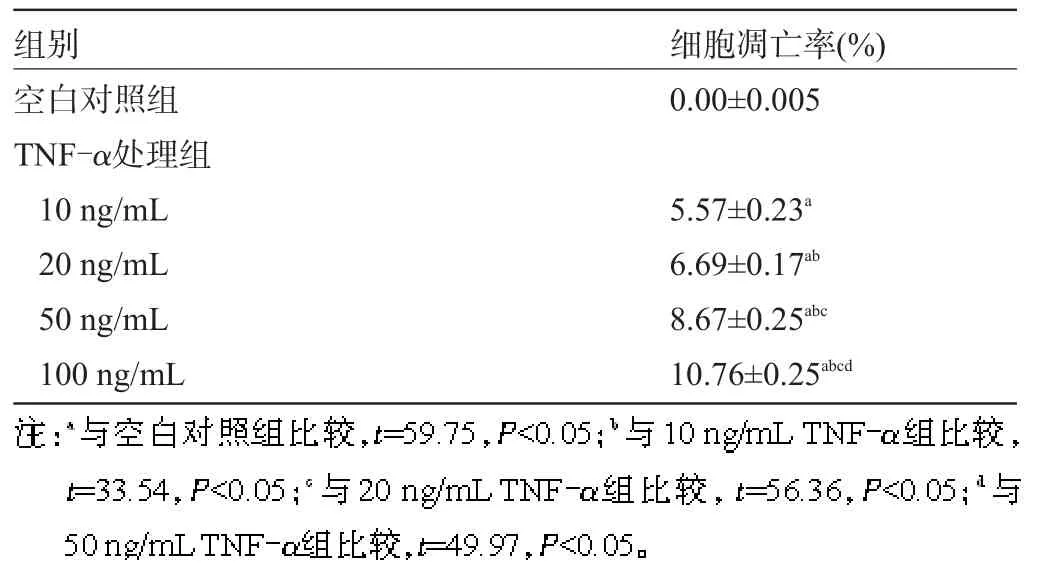
表2 不同剂量TNF-α刺激下HPMVEC的凋亡率检测(n=3,±s)
组别空白对照组TNF-α处理组10 ng/mL 20 ng/mL 50 ng/mL 100 ng/mL细胞凋亡率(%) 0.00±0.005 5.57±0.23a6.69±0.17ab8.67±0.25abc10.76±0.25abcd
2.3 HPMVEC的Caspase-3活性检测 10 ng/mL、20 ng/mL、50 ng/mL TNF-α处理组与空白对照组间差异有统计学意义(t值分别为43.85、96.24、26.45,P值分别为0.000 5、0.000 1、0.001,P<0.05),而100 ng/mL TNF-α处理组的Caspase-3活性最高(t=16.77,P= 0.004),随着时间的延长,Caspase-3活性逐渐升高,与空白对照组比较,100 ng/mL TNF-α组在24 h时Caspase-3的活性最高(t=62.06,P=0.003),见表3。
表3 不同剂量TNF-α刺激下HPMVEC的Caspase-3活性检测(n=3,±s)
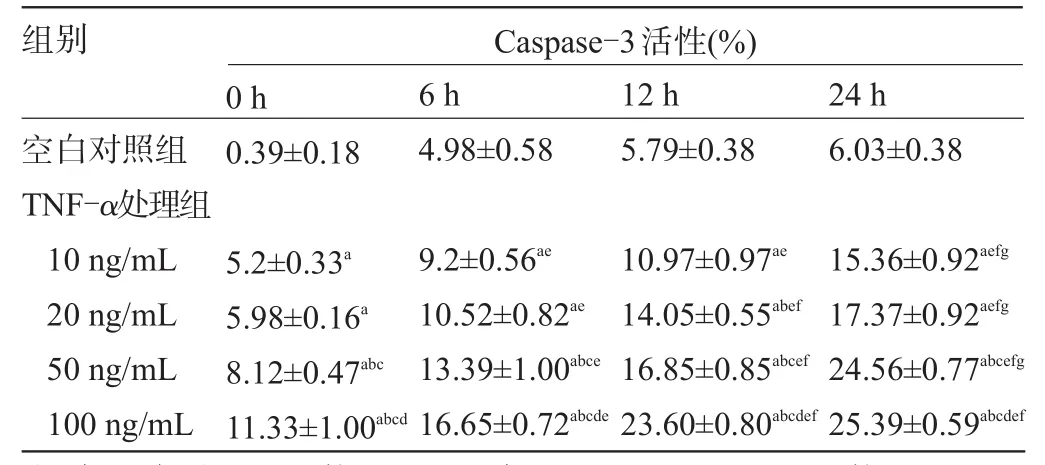
表3 不同剂量TNF-α刺激下HPMVEC的Caspase-3活性检测(n=3,±s)
注:与空白对照组比较,aP<0.05;与10 ng/mL TNF-α组比较,bP<0.05;与20 ng/mL TNF-α组比较,cP<0.05;与50 ng/mL TNF-α组比较,dP<0.05;与0 h组比较,eP<0.05;与6 h组比较,fP<0.05;与12 h组比较,gP<0.05。
组别Caspase-3活性(%) 0 h 6 h 12 h 24 h空白对照组TNF-α处理组10 ng/mL 20 ng/mL 50 ng/mL 100 ng/mL 0.39±0.184.98±0.585.79±0.386.03±0.38 15.36±0.92aefg17.37±0.92aefg24.56±0.77abcefg25.39±0.59abcdef5.2±0.33a5.98±0.16a8.12±0.47abc11.33±1.00abcd9.2±0.56ae10.52±0.82ae13.39±1.00abce16.65±0.72abcde10.97±0.97ae14.05±0.55abef16.85±0.85abcef23.60±0.80abcdef
3 讨 论
COPD是常见的呼吸系统疾病,其发病率及病死率呈现逐年增加的趋势,目前已成为全球第四大致死性病因[8]。PH是其重要的合并症,炎症反应是COPD患者形成PH的重要因素[9],炎症引起的血管内皮细胞凋亡是PH发生的重要机制[10]。近年来,有关于血管内皮细胞凋亡与PH之间的研究逐渐增多[11-13]。
本实验发现,10 ng/mL的TNF-α即可引起HPMVEC发生凋亡,随着TNF-α浓度的增加,HPMVEC凋亡率亦增加;100 ng/mL的TNF-α作用于HPMVEC时,细胞凋亡率最高,TNF-α对细胞活性的抑制与TNF-α剂量呈现出剂量依赖关系。Chen等[14]研究也支持本实验的结果。Kim等[15]发现,细胞凋亡的增加与Caspase-3的表达增强相关。
笔者进一步探讨了TNF-α诱导HPMVEC凋亡的分子机制。目前研究发现,血管内皮细胞凋亡主要有两条信号转导通路,分别由Caspase-8激活的外源性途径即死亡受体途径及Caspase-9激活的细胞内在途径即线粒体通路,而两者最终均需要通过激活Caspase-3来实现,因此,目前认为,Caspase-3是血管内皮细胞发生凋亡的标志物。本实验结果发现,随着TNF-α作用浓度的增加及时间的延长,Caspase-3的活性表达亦随之增强,Caspase-3的活性表达与HPMVEC凋亡率的增加呈正相关关系。与Ohtsubo等[16]研究结果相符合。有关于血管内皮细胞凋亡信号通路的探讨是近年来PH的研究热点,除了 Caspase-3通路,还包括 PI3K/AKT[17]、P38MAPK[18]及STAT3[19-20]等通路途径。在未来的研究中,我们将进一步探讨Caspase-3的上游信号通路,进一步了解TNF-α诱导HPMVEC凋亡的完整信号分子传导途径。
综上所述,笔者认为TNF-α可诱导HPMVEC发生凋亡,并且这一凋亡作用呈现浓度依赖性。而在细胞凋亡过程中,Caspase-3的活性表达增强,因此,TNF-α诱导HPMVEC凋亡可能与上调Caspase-3的活性表达有关。
[1]Hayes D Jr,Black SM,Tobias JD,et al.Prevalence of pulmonary hypertension and its influence on survival in patients with advanced chronic obstructive pulmonary disease prior to lung transplantation [J].COPD,2016,13(1):50-56.
[2]Li S,Xu J,Yao W,et al.Sevoflurane pretreatment attenuates TNF-α-induced human endothelial cell dysfunction through activating eNOS/ NO pathway[J].Biochem Biophys Res Commun,2015,460(3): 879-886.
[3]Yamaji-Kegan K,Takimoto E,Zhang A,et al.Hypoxia-induced mitogenic factor(FIZZ1/RELMα)induces endothelial cell apoptosis and subsequent interleukin-4-dependent pulmonary hypertension[J]. Am J Physiol Lung Cell Mol Physiol,2014,306(12):L1090-L1103.
[4] Choudhary GS,Al-Harbi S,Almasan A.Caspase-3 activation is a critical determinant of genotoxic stress-induced apoptosis[M].New York:Methods Mol Biol,2015:1-9.
[5]吴云飞,郑维银,李焰.Caspase-3在血管内皮细胞凋亡中的作用研究进展[J].西南军医,2013,15(4):408-411.
[6]冯永东,陶德定,谢大兴,等.流式细胞术检测胱氡肽酶3原位激活与两种检测细胞凋亡方法的比较性研究[J].中华检验医学杂志, 2004,27(9):582-585.
[7] Porter AG,Jänicke RU.Emerging roles of Caspase-3 in apoptosis [J].Cell Death Differ,1999,6(2):99-104.
[8] Vijayan VK.Chronic obstructive pulmonary disease[J].Indian J Med Res,2013,137(2):251-269.
[9]李雪英.慢性阻塞性肺病相关肺动脉高压与炎症反应[J].临床肺科杂志,2014,19(5):900-902.
[10]Sage E,Mercier O,Van den Eyden F,et al.Endothelial cell apoptosis in chronically obstructed and reperfused pulmonary artery[J].Respiratory Research,2008,9:19.
[11]Tian W,Jiang X,Tamosiuniene R,et al.Blocking macrophage leukotriene b4 prevents endothelial injury and reverses pulmonary hypertension[J].Sci Transl Med,2013,5(200):2418-2419.
[12]Cao Y,Jiang Z,Zeng Z,et al.Bcl-2 silencing attenuates hypoxia-induced apoptosis resistance in pulmonary microvascular endothelial cells[J].Apoptosis,2016,21(1):69-84.
[13]Liu P,Zhang HM,Tang YJ,et al.Influence of Rho kinase inhibitor fasudil on late endothelial progenitor cells in peripheral blood of COPD patients with pulmonary artery hypertension[J].Bratisl Lek Listy,2015,116(3):150-153.
[14]Chen TG,Zhong ZY,Sun GF,et al.Effects of tumour necrosis factor-alpha on activity and nitric oxide synthase of endothelial progenitor cells from peripheral blood[J].Cell Prolif,2011,44(4): 352-359.
[15]Kim KC,Lee JC,Lee H,et al.Changes in Caspase-3,B cell leukemia/lymphoma-2,interleukin-6,tumor necrosis factor-α and vascular endothelial growth factor gene expression after human umbilical cord blood derived mesenchymal stem cells transfusion in pulmonary hypertension rat models[J].Korean Circ J,2016,46(1): 79-92.
[16]Ohtsubo H,Ichiki T,Imayama I,et al.Involvement of Mst1 in tumor necrosis factor-alpha-induced apoptosis of endothelial cells[J/OL].Biochem Biophys Res Commun,2008,367(2):474-480.
[17]Wang J,Chen Y,Yang Y,et al.Endothelial progenitor cells and neural progenitor cells synergistically protect cerebral endothelial cells from Hypoxia/reoxygenation-induced injury via activating the PI3K/Akt pathway[J].Mol Brain,2016,9(1):1-12.
[18]曾海龙,黄志秋,张艺能,等.p38MAPK/eNOS信号通道在胰高血糖素样肽-1抑制AGEs诱导的人脐静脉内皮细胞凋亡中的作用[J].南方医科大学学报,2016,36(1):116-119.
[19]Bader AM,Brodarac A,Klose K,et al.Cord blood mesenchymal stromal cell-conditioned medium protects endothelial cells via STAT3 signaling[J].Cell Physiol Biochem,2014,34(3):646-657.
[20]Zhang S,Patel A,Moorthy B,et al.Adrenomedullin deficiency potentiates hyperoxic injury in fetal human pulmonary microvascularendothelial cells[J].Biochem Biophys Res Commun,2015,464(4): 1048-1053.
Caspase-3 activity in TNF-α-induced apoptosis of human pulmonary microvascular endothelial cells.
JI Sheng-jun1,YE Zhi-jian1,CHEN Yao-feng1,LIU Jian1,ZHANG Pei-fang1,ZHENG Shao-xin2.1.Department of Respiratory Medicine,the First People's Hospital of Foshan,Foshan 528000,Guangdong,CHINA;2.Department of Cardiology,Sun Yat-sen Memorial Hospital of the Sun Yat-sen University,Guangzhou 510120,Guangdong,CHINA
ObjectiveTo investigate the change of Caspase-3 activity in tumor necrosis factor-α(TNF-α)induced apoptosis of human pulmonary microvascular endothelial cells(HPMVECs).MethodsHPMVECs were cultured in vitro.The blank control was treated in a carbon dioxide incubator.HPMVECs were treated by TNF-α at the concentration of 10 ng/mL,20 ng/mL,50 ng/mL,or 100 ng/mL.The activity of cells,apoptosis rate,as well as the expressions of Caspase-3 in HPMVECs were determined respectively by MTT cell viability assay,flow cytometric analysis with dual Annexin V-FITC/propidium iodide(PI)staining and flow cytometry.ResultsApoptosis rate of cell and Caspase-3 activity were the lowest in the blank control group.Compared with the other groups(10 ng/mL,20 ng/mL,50 ng/mL),the Caspase-3 activity and apoptosis rate of cell in 100 ng/mL TNF-α group were highest,and with the lowest cell activity. The inhibition of TNF-α-induced cell activity was a manner of dose-dependent.The Caspase-3 activity increased gradually with time(P<0.05).ConclusionTNF-α-induced apoptosis of HPMVEC is a manner of dose-dependent,and Caspase-3 may be taking part in the control of apoptosis process.
Tumor necrosis factor-α(TNF-α);Human pulmonary microvascular endothelial cells(HPMVECs);Apoptosis;Caspase-3
R329.2+7
A
1003—6350(2016)14—2237—04
2016-02-23)
国家自然科学基金(编号:81400251);广东省佛山市卫生及计生局医学科研立项课题(编号:2015255)
郑韶欣。E-mail:schwannnn@163.com

