有关电解质强弱关系试题的分类解析
有关电解质强弱关系试题的分类解析
黑龙江 刘成宝
依据电解质在水溶液中能否完全电离将其分为强电解质和弱电解质,再依据弱电解质在水溶液中的电离程度大小可以判断弱电解的相对强弱。通过对电解质的强弱关系和相对强弱关系的性质对比,可以进一步强化对弱电解的电离、水的电离和溶液的pH、盐类水解等电离平衡要点知识的理解、深化、拓展和应用。尤其是有助于对溶液的酸碱性、酸碱反应的定量关系、酸碱反应后所得溶液的酸碱性、溶液中离子浓度的变化、离子浓度的大小关系等重点、难点问题做出正确的判断,从而促进知识和技能的有效迁移,形成良好的思维策略。
一、强弱关系对比与应用
强弱关系的对比一般是指一种强电解质和一种弱电解质在加水稀释、酸碱中和反应等问题的定性判断或定量计算。同时通过问题的解决有助于强化对强弱电解质性质差异的理解和应用。
【例1】(2 0 1 5新课标Ⅰ,1 3)浓度均为0.1 0m o l·L-1、体积均为V0的MOH和R OH溶液,分别加水稀释至体积V,pH随l g(V/V0)的变化如图所示,下列叙述错误的是( )
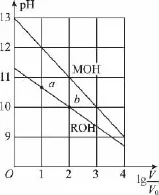
A.MOH的碱性强于R OH的碱性
B.R OH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等
D.当l g(V/V0)=2时,若两溶液同时升高温度,则c(M+)/c(R+)增大
解析:由图象所给的0.1 0m o l·L-1两种碱溶液的pH及大小关系可知MOH为强碱,R OH为弱碱。加水稀释后,弱碱R OH的电离程度增大;当l g(V/V0)=2时,R OH电离程度增大,n(R+)增大,n(M+)不变,c(M+)/c(R+)减小,升高温度后,R OH的电离程度进一步增大,c(M+)/c(R+)减小;无限稀释后,两溶液的pH均略大于7,c(OH-)相等;故正确答案为D。
【例2】(2 0 1 4海南,1 1)室温下,用0.1 0 0 m o l·L-1N a OH溶液分别滴定2 0.0 0m L、0.1 0 0m o l·L-1的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是( )

A.Ⅱ表示的是滴定盐酸的曲线
B.pH=7时,滴定醋酸消耗V(N a OH)小于2 0m L
C.V(N a OH)=2 0m L时,c(C l-)=c(CH3C O O-)
D.V(N a OH)=1 0 m L时,醋酸溶液中:c(N a+)>c(CH3C O O-)>c(H+)>c(OH-)
解析:盐酸为强电解溶液,醋酸为弱电解溶液,由0.1 0 0m o l·L-1的盐酸和醋酸的pH大小可知,曲线Ⅰ表示的是N a OH滴定醋酸,曲线Ⅱ为N a OH滴定盐酸;当醋酸与N a OH恰好反应时生成强碱弱酸盐CH3C O ON a,溶液呈碱性,若溶液pH=7,则所消耗N a OH的体积应小于2 0m L;当V(N a OH)=2 0m L时,醋酸与盐酸均恰好完全反应,由于(CH3C O O-)水解,离子浓度大小关系为c(C l-)>c(CH3C O O-);当V(N a OH)=1 0m L时,得到CH3C O ON a与CH3C O OH浓度比为1∶1的混合溶液,溶液呈酸性,溶液中离子浓度大小关系为c(CH3C O O-)>c(N a+)>c(H+)>c(OH-);正确答案为B。
二、相对强弱关系对比与应用
两种或两种以上的弱电解质根据其电离程度的相对大小,可以判断弱电解质的相对强弱关系。通过相对强弱关系的比较,用于解决和判断溶液酸碱性的相对强弱、离子浓度大小关系、离子间能否发生反应或离子能否大量共存及反应的先后顺序等问题。同时深化对“强酸制取弱酸”规律的理解与应用。
【例3】(2 0 1 5福建,2 3节选)2 5℃,两种酸的电离平衡常数如下表。

Ka1Ka2__________ __H2S O3________1.3×1 0-26.3×1 0-4__H2C O3_______4.2×1 0-75.6×1 0-11
②0.1 0m o l·L-1N a2S O3溶液中离子浓度由大到小的顺序为________________________________________________。
③H2S O3溶液和N a HC O3溶液反应的主要离子方程式为__________________________________________________。

【例4】(2 0 1 3上海,1 9)部分弱酸的电离平衡常数如下表:
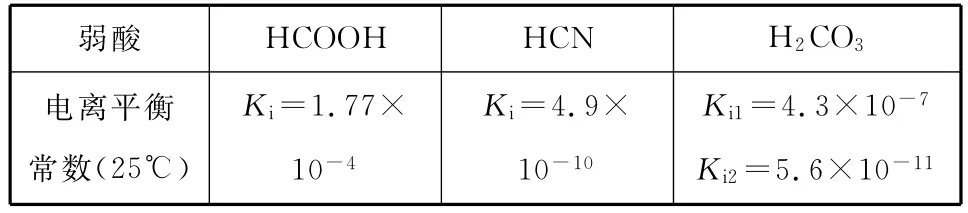
弱酸HC O OH HC N H2C O3电离平衡常数(2 5℃)Ki=1.7 7× 1 0-4Ki=4.9× 1 0-10Ki1=4.3×1 0-7Ki2=5.6×1 0-11
下列选项错误的是( )

C.中和等体积、等pH的HC O OH和HC N消耗N a OH的量前者小于后者
D.等体积、等浓度的HC O ON a和N a C N溶液中所含离子总数前者小于后者

【例5】(2 0 1 3浙江,1 2)2 5℃时,用浓度为0.1 0 0 0m o l/L的N a OH溶液滴定2 0.0 0m L浓度均为0.1 0 0 0m o l/L的三种酸HX、HY、H Z,滴定曲线如图所示。下列说法正确的是( )

A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:H Z<HY<HX
B.根据滴定曲线,可得Ka(HY)≈1 0-5
C.将上述HX、HY溶液等体积混合后,用N a OH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+)

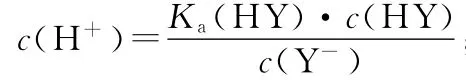
(作者单位:黑龙江省宾县第一中学)

