四川白鹅Calm1结构特征及其差异表达的研究
徐麒麟,何 珲,马 容,陈咨余,易治鑫,康 波,姜冬梅
(四川农业大学 动物科技学院,畜禽遗传资源发掘与创新利用四川省重点实验室,四川 成都 611130)
四川白鹅Calm1结构特征及其差异表达的研究
徐麒麟,何珲,马容,陈咨余,易治鑫,康波,姜冬梅
(四川农业大学 动物科技学院,畜禽遗传资源发掘与创新利用四川省重点实验室,四川 成都611130)
摘要:为阐明鹅Calm1基因结构特征及其表达规律。克隆四川白鹅Calm1基因编码区序列并进行生物信息学分析,应用实时荧光定量PCR技术检测鹅不同等级卵泡和不同组织中Calm1基因的相对表达量。鹅Calm1基因编码区序列全长为450 bp,编码149个氨基酸,其氨基酸序列与原鸡相似性为99%。鹅大脑中Calm1表达量显著高于其他组织(P<0.05)。Calm1在不同等级卵泡组织中均有表达,F2级卵泡中Calm1表达量是小白卵泡(Small white follicles,SWF)的1.76倍(P<0.05),且显著高于F5、F4、F3和F1级卵泡(P<0.05);在排卵后卵泡(Postovulatory follicle,POF)组织中,POF1级卵泡组织中Calm1表达量显著高于POF2、POF3和POF4级卵泡(P<0.05);卵巢组织中Calm1的表达量,是小白卵泡的1.75倍(P<0.05)。Calm1是高度保守、广泛表达的蛋白质,Calm1可能通过影响卵泡细胞增殖和类固醇激素合成来参与调控动物繁殖。
关键词:四川白鹅;实时荧光定量PCR;Calm1;基因表达
钙调蛋白是真核生物细胞广泛存在、高度保守的钙离子结合蛋白[1],钙离子与钙调蛋白结合,并且活化下游钙调蛋白依赖性蛋白激酶或磷酸化酶,进而参与调控细胞生长、增殖及代谢过程[2]。钙调蛋白是心肌细胞钙离子通道重要的调节因子,能够与ATP相互作用进而参与调控机体的生命活动[3]。脊椎动物卵母细胞的减数分裂和受精过程受到多种蛋白激酶的调节,钙调蛋白和钙调蛋白依赖性蛋白激酶Ⅱ参与了卵母细胞成熟[4]。卵母细胞成熟过程是一个复杂的生物学过程[5]。王晨光等[6]研究发现,钙调蛋白参与了MⅠ期卵母细胞向MⅡ期发育的过程,并且可能与细胞内钙离子的核周区分布有关。此外,钙调蛋白与钙离子结合促进了母鸡卵泡膜细胞类固醇激素的分泌,同时抑制了雄烯二酮的产生[7]。
哺乳动物的Calm基因包含3个亚型(Calm1、Calm2和Calm3)[8]。Calm1可参与调节细胞生长、信号转导和神经递质合成与释放[9]。Calm1是鸡卵泡膜细胞雄激素产生的重要调节因子,对类固醇激素分泌具有促进作用[10],Calm1可以激活禽壳腺部钙离子转运系统进而促进蛋壳的形成[11],此外,Calm1还能促进精子活化及运动[12]。康波等[13]研究发现,产蛋期鹅卵巢组织中Calm1表达量显著高于产蛋前期,提示其可能参与鹅卵巢功能的调节。然而,目前关于禽类Calm1的结构特征及表达规律尚未见相关报道。因此,本研究克隆四川白鹅Calm1基因编码区序列,并利用生物信息学软件预测分析Calm1基因及其编码的蛋白质结构和功能;同时采用荧光定量PCR技术研究Calm1在四川白鹅不同卵泡和组织中的表达规律,为进一步研究Calm1调控动物繁殖功能奠定理论基础。
1材料和方法
1.1试验动物及样品采集
选取健康、产蛋高峰期的四川白鹅5只(由四川农业大学家禽育种场提供),采集小白卵泡(Small white follicles,SWF)、小黄卵泡(Small yellow follicles,SYF)、F5、F4、F3、F2、F1、排卵后卵泡(Postovulatory follicle,POF)(依次为POF1、POF2、POF3和POF4)和心脏、肝脏、脾脏、肺脏、肾脏、肾上腺、胸肌、腿肌、大脑、小脑、松果体、下丘脑、垂体、视网膜、脊髓、输卵管及卵巢组织,液氮冷冻后,置于-80 ℃冰箱保存备用。
1.2引物设计与合成
根据GenBank数据库原鸡Calm1和β-actin基因序列,采用Primer 5.0和Oligo 6.0软件设计引物并委托宝生物(大连)有限公司合成。扩增Calm1基因CDS区的上游引物为5′-CCAGCCCAAACAGTG TAATAGT-3′,下游引物为5′-CATGGCTGACCAGCT GACCGAA-3′(PCR产物Calm1-L大小为746 bp)。Calm1荧光定量引物上游为5′-ATGAGGTCGTTG GGTCAAAATC-3′,下游为5′-CCTTGTCAAAGACTC GGAATGC-3′(PCR产物Calm1-S大小为178 bp);β-actin基因上游引物为5′-GCGGCATGCCACACCG TGCCCATCTATGAG-3′,下游引物为5′-GCGAAGCT TGGCCATCTCCTGCTCGAAGT-3′(PCR产物β-actin大小为222 bp)。
1.3组织总RNA提取与cDNA模板制备
按照TRIzol试剂操作说明书提取所采集的组织总RNA,分别取3.0 μL总RNA于1%的琼脂糖凝胶电泳检测总RNA质量。参照TaKaRa反转录试剂盒说明书将总RNA样品反转录成cDNA模板,首先去除基因组DNA,反应体系为10 μL,包括1.0 μL总RNA,2.0 μL 5 XgDNA Eraser Buffer,1.0 μL gDNA Eraser,6.0 μL RNase Free H2O。反应条件为:42 ℃ 2 min和4 ℃ 5 min。反转录反应体系为20 μL,包括10 μL去除基因组DNA的反应液,4 μL 5 XPrimeScript® BufferⅡ,1.0 μL PrimeScript® RT Enzyme MixⅠ,1.0 μL RT Primer Mix和4.0 μL RNase Free H2O。反应条件为:37 ℃ 15 min,85 ℃ 5 s和4 ℃ 5 min,置于-20 ℃冰箱中保存备用。
1.4Calm1基因克隆
将20 μL的Premix TaqTM(2×),各1 μL(10 μmol/L)的Calm1上、下游引物,2.0 μL的组织cDNA模板以及16 μL的无RNase水加入PCR反应管中。反应条件为:95 ℃预变性5 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,35个循环;72 ℃延伸10 min。将PCR产物用1.0%琼脂糖凝胶电泳检测后,选取阳性PCR产物,琼脂糖凝胶电泳回收目的基因片段,将回收产物连接至pMD-19T载体并转化DH5α感受态细胞,菌液PCR鉴定后,挑选3个阳性克隆委托宝生物工程(大连)有限公司测序。
1.5Calm1基因生物信息学分析
应用NCBI在线软件(http://www.ncbi.nlm.nih.gov)比对Calm1编码区序列和氨基酸序列相似性;利用Protparam在线软件预测Calm1基因编码蛋白质的理化性质(http://web.expasy.org/protparam/);应用在线软件PSORT II Prediction分析Calm1的亚细胞定位(http://psort.hgc.jp/form2.html);ProtScale软件分析氨基酸疏水性(http://web.expasy.org/protscale/);NetPhos2.0分析Calm1的磷酸化位点(http://www.cbs.dtu.dk/services/NetPhos/);NetNGlyc 1.0 Server分析Calm1的N-糖基化位点(http://www.cbs.dtu.dk/services/NetNGlyc/);利用SOPMA软件预测Calm1二级结构(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html);利用SWISS-MODEL对Calm1蛋白进行三级结构预测(http://www.swissmodel.expasy.org/);利用MotifScan软件(http://hits.isb-sib.ch/cgi-bin/motif_scan)分析Calm1蛋白质的关键功能结构域。
1.6实时荧光定量PCR
用β-actin作为内参基因,定量检测所采集样品组织中Calm1基因的表达量,每个样品3个重复,反应体系为10 μL:SYBR Green 5.0 μL,上、下游引物(10 μmol/L)各0.2 μL,cDNA模板0.5 μL,RNase Free H2O 4.1 μL。反应条件为:95 ℃预变性3 min;95 ℃变性10 s,61.6 ℃退火30 s,72 ℃延伸30 s(采集荧光),39个循环;95 ℃ 10 s,然后以0.5 ℃/10 s的速率从65 ℃缓慢升温至95 ℃绘制溶解曲线。
1.7统计分析
采用2-ΔΔCt法处理数据,以小白卵泡和心脏中Calm1基因的表达量分别设为1,计算四川白鹅不同等级卵泡和组织中Calm1基因的相对表达量。应用SAS 9.2统计分析软件中的MEANS过程进行描述性统计分析,ANOVA过程进行方差分析和Duncan多重比较,P<0.05表示差异显著。
2结果与分析
2.1Calm1基因克隆
如图1-A所示,所提取的总RNA样品经1%的琼脂糖凝胶电泳检测发现,样品RNA具有清晰完整的28S、18S条带,表明RNA未降解,可用于后续的克隆及荧光定量,利用特异性引物,以提取的总RNA反转录的cDNA为模板,对Calm1基因和β-actin基因进行扩增,经1.5%的琼脂糖凝胶电泳检测,分别获得了与预期大小一致的746,178,222 bp的特异目的条带(图1-B)。

图1 总RNA提取及Calm1、β-actin基因PCR产物电泳图
2.2Calm1基因生物信息学分析
四川白鹅Calm1基因全长450 bp,编码149个氨基酸;Calm1蛋白质分子量为16.811 5 kDa,理论pI值4.06,分子式为C718H1127N187O257S10;不稳定系数为27.20。亚细胞定位预测结果表明,Calm1主要分布于细胞质(52.2%)、细胞核(21.7%)、线粒体(13.0%)、液泡(4.3%)、细胞骨架(4.3%)、内质网(4.3%)。Calm1氨基酸序列中第70位氨基酸残基具有最高分值(1.022),疏水性最强;第79位具有最低分值(-2.489),亲水性最强(图2)。总体而言,亲水性区域明显大于疏水性区域,Calm1属于亲水性蛋白质。

图2 Calm1亲水性/疏水性分析
磷酸化位点预测结果表明,Calm1中含有7个磷酸化位点,其中Ser(丝氨酸,Serine,S)位点有3个(18、82和102),Thr(苏氨酸,Threonine,T)有3个(29、80、和118),Tyr(酪氨酸)有1个(100),糖基化位点预测结果表明,N-糖基化位点有2个(43和61)。通过SOPMA软件预测Calm1基因蛋白质二级结构,结果显示,Calm1氨基酸α-螺旋占62.42%,延伸链占7.38%,β-转角占9.4%,无规则卷曲占20.81%;利用SWISS-MODEL在线软件进行同源建模(图3),得到四川白鹅Calm1蛋白的三级结构模型与小鼠的Calm1三级结构(3wfn.1.A)类似,该蛋白与数据库中提供的模板具有100%同源性。

图3 Calm1三级结构预测
2.3Calm1序列比对分析
四川白鹅Calm1氨基酸序列与原鸡(NP_001103834.1)序列的相似性为99%,与绿头鸭(XP_005031791.1)、人(NP_008819.1)、小鼠(NP_033920.1)和非洲爪蟾(NP_001089059.1)序列相似性均为100%。如图4所示,四川白鹅存在4个EF-hand钙离子结构域和4个EF-hand结构域,除了原鸡的Calm1第97位氨基酸为丝氨酸(其余均为甘氨酸),其他物种的Calm1结构域均高度保守。

….EF-hand 钙离子结构域;─.EF-hand结构域。
2.4Calm1基因在不同组织中的相对表达量
如图5所示,在所检测的17个四川白鹅组织中,大脑组织中Calm1表达量最高,是心脏的10.97倍(P<0.05);在输卵管、脊髓、小脑、肺脏、下丘脑、垂体中,Calm1的表达量也相对较高,分别是心脏的3.55,3.31,2.97,2.88,2.47,2.11倍(P<0.05),肝脏、肾脏、胸肌、腿肌、脾脏、肾上腺、松果体、视网膜、卵巢中Calm1的表达量与心脏组织相比差异不显著(P>0.05)。

H.心脏;L.肝脏;S.脾脏;Lu.肺脏;K.肾脏;AG.肾上腺;BM.胸肌;TM.腿肌;C.大脑;Ce.小脑;PG.松果体;Hy.下丘脑;
2.5Calm1基因在不同卵泡组织中的相对表达量
如图6所示,Calm1在所检测的卵泡组织中均有表达,F2级卵泡中Calm1表达量最高(P<0.05),是SWF的1.76倍且显著高于F5、F4、F3和F1卵泡(P<0.05)。F1卵泡显著高于F5卵泡(P<0.05),但与F4和F3卵泡差异不显著(P>0.05)。在排卵后卵泡中,POF1级卵泡的Calm1表达量最高,是SWF的1.90倍(P<0.05),POF2、POF3和POF4中Calm1的表达量差异不显著(P>0.05)。卵巢组织中Calm1的表达量是SWF的1.75倍且显著高于等级前卵泡(P<0.05)。
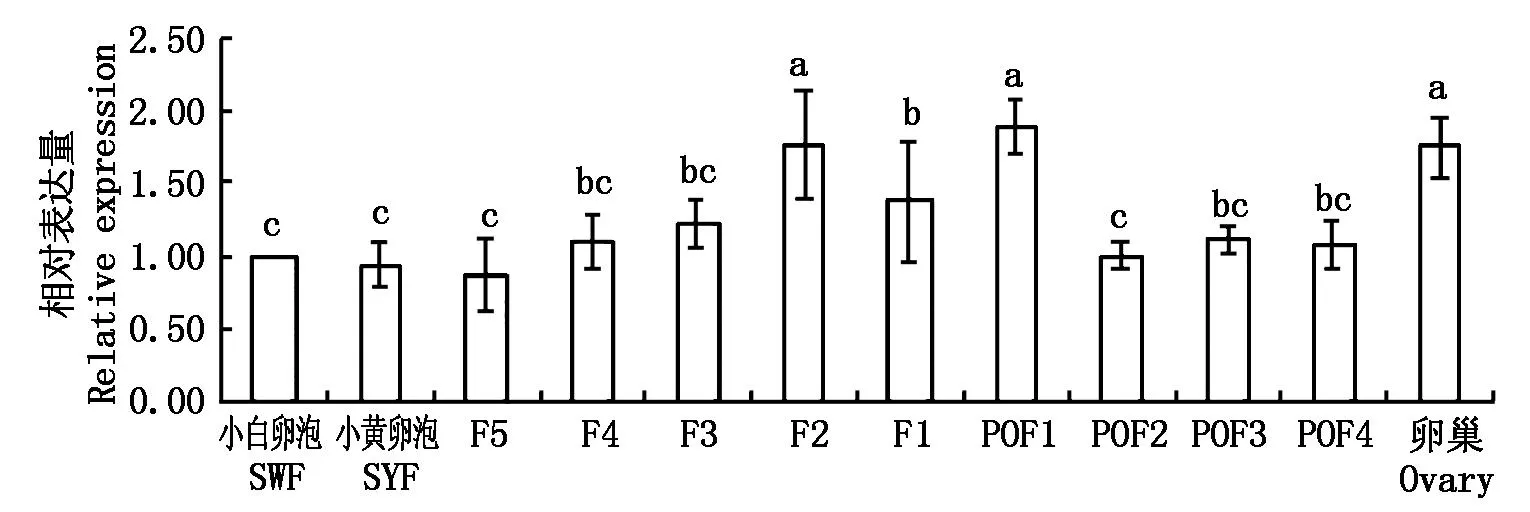
图6 四川白鹅不同等级卵泡中Calm1基因的相对表达量
3讨论与结论
在不同物种之间,钙调蛋白氨基酸一级结构非常保守[14]。封瑞等[15]研究发现,豚鼠Calm2编码区所编码的氨基酸序列与其他种属完全一致。四川白鹅Calm1氨基酸序列的C-末端比绿头鸭少了3个非极性氨基酸(Phe-Phe-Val),提示这3个氨基酸残基对鹅Calm1功能的影响较小。此外,原鸡Calm1第97位氨基酸为丝氨酸,而四川白鹅为甘氨酸,2个氨基酸均为非极性疏水氨基酸,属于保守性突变。四川白鹅Calm1具有7个磷酸化位点和2个N-糖基化位点,表明其具有丰富的转录以及翻译后修饰过程[16]。钙调蛋白属于EF-Hand家族钙离子结合蛋白,包含了进化上保守的4个EF-Hand钙离子结构域[17]。本研究表明,四川白鹅Calm1氨基酸的4个EF-Hand钙离子结构域与其他物种高度保守,提示不同物种钙调蛋白结合钙离子的机制可能较为相似[18]。
Calm1参与调控基因的表达、蛋白质合成、细胞的分裂和增殖等生物学过程[19]。大脑是动物机体的重要生命中枢,其种类丰富的神经元中也表达Calm1[20]。人大脑和骨骼肌组织中Calm1表达量显著高于心脏、胎盘、肺、肝、肾和胰腺组织[20],而且鸡大脑组织中Calm1丰富表达[21]。本研究发现四川白鹅大脑组织中Calm1表达量也显著高于其他组织,说明Calm1在维持大脑正常功能中具有重要作用。文昌鱼Calm1在卵巢组织中的表达量显著高于鳃、肌肉、脊索、睾丸和肠组织[14],爪蟾的卵巢和睾丸组织中Calm1的表达量也很高[22]。然而,本研究发现四川白鹅卵巢组织中Calm1表达量与胸肌和腿肌无显著差异,提示在不同物种之间Calm1组织分布存在一定差异。
Matsuura等[23]研究表明,Calm1能够调节小鼠卵泡的发育和排卵。在本研究中表明,四川白鹅Calm1在不同卵泡组织中均有表达,等级卵泡组织中Calm1的表达量逐渐升高且在F2级卵泡中达到最高值;在排卵后卵泡中,POF1级卵泡的Calm1的表达量最高,POF2、POF3和POF4中Calm1的表达量差异不显著,而且卵巢组织中Calm1表达量也相对较高。郑亦辉等[24]研究发现,湖羊和美利奴羊随着卵泡的发育和直径的增大,Calm1的水平也相应地增加,二者呈现较强的正相关,这与鹅Calm1在不同等级卵泡的表达趋势相似。卵泡组织发育伴随着大量细胞的增殖、凋亡过程,而Calm1在细胞增殖和凋亡过程中具有重要调控作用[19],说明Calm1可能通过影响卵泡细胞的增殖进而影响卵泡的发育。胆固醇是卵泡类固醇激素生成的重要底物[25],cAMP和Ca2+是调控类固醇激素生成的第二信使[26],卵泡发育和成熟均受类固醇激素的调节。Calm1不仅可通过介导cAMP合成进而影响类固醇激素生成[27],而且还可通过促进颗粒细胞内胆固醇的转运和利用来参与调控卵巢颗粒细胞类固醇激素生成[28]。此外,Calm1可以与钙离子结合并调节颗粒细胞类固醇激素的表达[29]。本研究发现鹅POF1级卵泡中Calm1的表达量显著高于F1级卵泡,推测Calm1可能通过影响类固醇激素的合成进而影响卵泡的成熟及排卵。
本研究克隆并获得了450 bp的四川白鹅Calm1基因完整编码区序列,编码了149个氨基酸残基,不同物种之间Calm1氨基酸序列高度保守。Calm1在不同组织中均有表达,大脑组织中Calm1表达量最高。鹅Calm1在围排卵期卵泡组织中的表达量显著高于其他卵泡组织,说明Calm1在鹅卵泡成熟和排卵过程具有重要调控作用。然而,其机制仍有待于进一步研究。
参考文献:
[1]Toutenhoofd S L,Strehler E E.Regulation of calmodulin mRNAs in differentiating human IMR-32 neuroblastoma cells[J].Biochimica et Biophysica acta,2002,1600(1/2):95-104.
[2]赵岚,陆融,姚智.Ca2+/钙调蛋白依赖性蛋白激酶在细胞增殖中的作用[J].细胞生物学杂志,2007,29(3):331-335.
[3]Feng R,Xu J,Minobe E,et al.Adenosine triphosphate regulates the activity of guinea pig Cav1.2 channel by direct binding to the channel in a dose-dependent manner[J]. American Journal of Physiology-Cell Physiology,2014,306(9):856-863.
[4]Yu F H,Jun H L,Yuan S Q.Roles of calmodulin-dependent protein kinase Ⅱ in meiotic maturation and fertilization of oocytes[J].Progress in Biochemistry and Biophysics,2003,30(2):171-174.
[5]柳淑芳,杜立新,王继英.哺乳动物卵母细胞发育机理的研究进展[J].黄牛杂志,2001,27(4):43-45.
[6]王晨光,邓满齐,孙方臻.小鼠卵母细胞体外成熟不同阶段对钙的依赖性[J].实验生物学报,1998,31(2):147-153.
[7]Levorse J M,Tilly J L,Johnson A L.Role of Calcium in the regulation of theca cell androstenedione production in the domestic hen[J].Journal of Reproduction and Fertility,1991,92(1):159-167.
[8]Kobayashi H,Saragai S,Naito A,et al.Calm1 signaling pathway is essential for the migration of mouse precerebellar neurons[J].Development,2015,142(2):375-384.
[9]Flanagan J M,Popendikyte V,Pozdniakovaite N,et al.Intra-and interindividual epigenetic variation in human germ cells[J].American Journal of Human Genetics,2006,79(1):67-84.
[10]Kang B,Guo J R,Yang H M,et al.Differential expression profiling of ovarian genes in prelaying and laying geese[J].Poultry Science,2009,88(9):1975-1983.
[11]Ji H,Wang J,Guo J,et al.Expression of eleven egg performance-associated genes in the ovary of Zi geese anser anser domestica[J].The Journal of Poultry Science,2013,50(2):91-98.
[12]Ignotz G G,Suarez S S.Calcium/calmodulin and calmodulin kinase Ⅱ stimulate hyperactivation in demembranated bovine sperm[J].Biology of Reproduction,2005,73(3):519-526.
[13]康波,姜冬梅,郭静茹,等.籽鹅卵巢组织差异表达基因的研究[J].畜牧兽医学报,2010,41(6):657-663.
[14]Luan J,Liu Z,Zhang S,et al.Characterization,evolution and expression of the calmodulin1 genes from the amphioxusBranchiostomabelcheritsingtauense[J].Acta Biochimica et Biophysica Sinica,2007,39(4):255-264.
[15]封瑞,刘彦,杨磊,等.豚鼠钙调蛋白2基因编码区及3′端非编码区序列克隆[J].中国医科大学学报,2015,44(2):123-126.
[16]Kang S,Xu M,Cooper E C,et al.Channel-anchored protein kinase CK2 and protein phosphatase 1 reciprocally regulate KCNQ2-containing M-channels via phosphorylation of calmodulin[J].The Journal of Biological Chemistry,2014,289(16):11536-11544.
[17]Friedberg F,Rhoads A R.Evolutionary aspects of calmodulin[J].IUBMB Life,2001,51(4):215-221.
[18]Grabarek Z.Insights into modulation of calcium signaling by magnesium in calmodulin,troponin C and related EF-hand proteins[J].Biochimica et Biophysica acta,2011,1813(5):913-921.
[19]袁俊,李朝军.钙调蛋白在PC12细胞分化和迁移中的作用[J].华北农学报,2011,26(1):22-25.
[20]Rhyner J A,Ottiger M,Wicki R,et al.Structure of the human CALM1 calmodulin gene and identification of two CALM1-related pseudogenes CALM1P1 and CALM1P2[J].European Journal of Biochemistry,1994,225(1):71-82.
[21]Ye Q,Berchtold M W.Structure and expression of the chicken calmodulin Ⅰ gene[J].Gene,1997,194(1):63-68.
[22]Chien Y H,Dawid I B.Isolation and characterization of calmodulin genes fromXenopuslaevis[J].Molecular and Cellular Biology,1984,4(3):507-513.
[23]Matsuura T,Sugimura M,Iwaki T,et al.Anti-macrophage inhibitory factor antibody inhibits PMSG-hCG-induced follicular growth and ovulation in mice[J].Journal of Assisted Reproduction and Genetics,2002,19(12):591-595.
[24]郑亦辉,张德福.湖羊与美利奴羊卵巢不同直径的卵泡钙调素含量的变化[J].南京农业大学学报,1990,13(3):128-129.
[25]应诗家,彭中友,李燕,等.绵羊黄体期卵巢类固醇激素调节基因的表达研究[J].畜牧兽医学报,2013,44(11):1775-1780.
[26]Manière G,Vanhems E,Gautron F,et al.Calcium inhibits ovarian steroidogenesis in the blowflyPhormiaregina[J].The Journal of Endocrinology,2002,173(3):533-544.
[27]Jayes F C,Day R N,Garmey J C,et al.Calcium ions positively modulate follicle-stimulating hormone-and exogenous cyclic 3′,5′-adenosine monophosphate-driven transcription of theP450(scc) gene in porcine granulosa cells[J].Endocrinology,2000,141(7):2377-2384.
[28]何俊,陈建锋,刘茹,等.氰戊菊酯对卵巢细胞、组织钙稳态和激素水平的影响[J].中华预防医学杂志,2004,38(1):18-21,73.
[29]Golini V E,Stradaioli G,Sirard M A.Transcriptome analysis of bovine granulosa cells of preovulatory follicles harvested 30,60,90,and 120 days postpartum[J].Theriogenology, 2014,82(4):580-591.
Characterization and Differential Expression Profile ofCalm1 Gene in Sichuan White Goose
XU Qilin,HE Hui,MA Rong,CHEN Ziyu,YI Zhixin,KANG Bo,JIANG Dongmei
(College of Animal Science and Technology,Sichuan Agricultural University,Farm Animal Genetic Resources Exploration and Innovation Key Laboratory of Sichuan Province,Chengdu611130,China)
Abstract:In order to elucidate the characteristics and expression profile of Calm1 in ovarian hierarchical follicles and tissues of Sichuan white goose,the Calm1 coding region sequence of the goose was clone,and it′s structure and function was characterized.The relative abundance of Calm1 mRNA in ovarian follicles and various tissues of Sichuan white goose were assessed by quantitative Real-time PCR.The results showed that the Calm1 coding sequence was 450 bp with encoding 149 amino acid residues.The sequence of the goose Calm1 amino acids shared a 99% similarity compared to Gallus gallus.The level of Calm1 gene expression in cerebrum was significantly higher than others (P<0.05).Calm1 transcripts were detectable in all of the experimental follicles.The level of Calm1 gene expression in F2 was 1.76-fold compared with small white follicles,and was significantly higher than F5,F4,F3 and F1 level follicle (P<0.05).The level of Calm1 in postovulatory follicle 1 was significantly higher than POF2,POF3 and POF4 (P<0.05).The Calm1 expression level in ovarian tissue was 1.75-fold compared with small white follicles (P<0.05).Calm1 is a highly conserved ubiquitous protein.Calm1 may participate in regulating the animal reproduction by affecting the growth of follicular cell proliferation and synthesis of steroid hormones.
Key words:Sichuan white goose;Quantitative Real-time PCR; Calm1;Gene expression
doi:10.7668/hbnxb.2016.01.021
中图分类号:S858.03
文献标识码:A
文章编号:1000-7091(2016)01-0128-06
作者简介:徐麒麟(1992-),男,四川崇州人,在读硕士,主要从事动物卵泡发育机理研究。通讯作者:姜冬梅(1978-),女,黑龙江海林人,实验师,硕士,主要从事动物生产研究。
基金项目:国家自然科学基金项目(31201798);高等学校博士学科点专项科研基金项目(20105103120003)
收稿日期:2015-09-10
康波(1978-),男,黑龙江林口人,副教授,博士,主要从事动物生理与环境生理、家禽遗传育种与繁殖研究。

