自合成超顺磁性纳米颗粒标记脂肪间充质干细胞的体外MR示踪研究
孙 博,董 越,刘 晶,王 楠,石爱军,赵静媛
(大连医科大学附属第一医院,辽宁 大连 116011)
自合成超顺磁性纳米颗粒标记脂肪间充质干细胞的体外MR示踪研究
孙 博,董 越,刘 晶,王 楠,石爱军,赵静媛
(大连医科大学附属第一医院,辽宁 大连 116011)
目的:对新型超顺磁性氧化铁颗粒标记脂肪间充质干细胞的标记和体外示踪可行性研究。方法:新型超顺磁性氧化铁颗粒由大连化物所提供。脂肪干细胞来源于切除的乳腺组织(患者知情同意)。用不同浓度(1、5、10、25、50、100 μg/mL)超顺磁性氧化铁颗粒标记脂肪间充质干细胞,分别行普鲁士蓝染色(观察标记率)、台盼蓝染色(观察细胞活力)、MTT(观察细胞增殖能力)。分别取不同标记浓度1×106个细胞用1.5 mL琼脂糖重悬于2 mL EP管,行MRI扫描。所有MRI均用GE 3.0T signa-HDxt MR扫描仪、8通道腕关节线圈扫描,序列包括SE T1WI、FSE T2WI、GRE T2*WI和R2*mapping序列。MRI扫描信息传至AW VolumeShore 2工作站,分别测量信号强度(T1WI、T2WI、T2*WI),计算并测量R2*值,并计算变化率。结果:在25 μg/mL浓度以上,标记率可以达到95%,随着浓度的增加,细胞内蓝染颗粒逐渐增多。浓度在50 μg/mL以上时,标记的细胞存活率明显下降,增殖能力也受到影响。不同标记SPIO铁浓度(1、5、10、25、50、100 μg/mL)的T1WI和T2WI影像随着铁浓度的升高信号降低,25 μg/mL以上标记的EP管的信号强度T2WI信号降低更为明显;在T2*-GRE序列上,10 μg/mL以上标记的EP管的信号强度明显降低;R2*值也显示随着SPIO铁浓度升高而增高,25 μg/mL以上铁浓度测得的R2*值明显高于10 μg/mL铁浓度。结论:新型超顺磁性氧化铁颗粒能直接有效标记细胞,适当的标记铁浓度对细胞生物学活性无明显影响;最适标记铁浓度为25 μg/mL。
间质干细胞;脂细胞;磁共振成像
Zuk等[1]最早从脂肪抽吸物中成功的分离出具有骨、软骨、肌肉、脂肪等多向分化潜能的脂肪间充质细胞(Adipose-derived stromal cells,ADSCs),是继骨髓来源的又一间充质干细胞。由于其体外培养可稳定扩增,具有多项分化潜能,且来源丰富、容易获得、培养条件不高等,与骨髓MSCs相比更具有优势,因此ADSCs可作为干细胞移植的理想种子细胞[2-3]。那么,将ADSCs移植到体内后,如何追踪其去向、分化、生长情况及对病灶处的修复情况一直是研究的重点。自Weissleder于1999年提出了分子影像学(Molecular imaging,MI)概念后,国内外已有研究者采用磁性颗粒标记移植干细胞进行了广泛的MR体外和活体示踪研究[4-7]。超顺磁性氧化铁(Superparamagnetic iron oxide,SPIO)是一种活体标记物,是目前常用的磁共振成像阴性对比剂,由于SPIO与细胞膜均带负电,未经修饰无法有效标记间充质干细胞,因此多采用带正电荷的转染剂如多聚赖氨酸、硫酸鱼精蛋白、繁枝体等通过静电包裹铁颗粒,使带负电的细胞通过非特异性膜表面吸收过程摄取铁颗粒进入细胞内[8-9]。但是大多数转染试剂都具有一定的细胞毒性作用,限制了临床上的应用。
我们利用大连化物所自合成非螯合的一种纳米磁性Fe3O4颗粒为标记物,以ADSCs为载体,通过对不同标记浓度情况下磁性颗粒标记ADSCs的标记率,标记后干细胞的活性及体外核磁共振成像情况的综合评估,探讨该粒子磁标记的可行性和有效性,为ADSCs移植的MR活体示踪奠定基础。
1 材料与方法
1.1 实验材料和试剂
实验细胞由人乳腺切除术获取的脂肪组织中原代培养获得人ADSCs(脂肪组织由大连医科大学附属第一医院手术室提供,采样经患者签署同意书)。
干细胞标记物超顺磁性纳米Fe3O4(SPIO),此粒子是以Fe3O4为核心,在其外部添加硅和胺丙基增大其表面亲水能力,是一种非螯合的纳米粒子。该粒子大小约为10~18 nm(由中科院大连化物所提供)。该粒子的扫描电镜图见图1。主要试剂 H-DMEM培养基(Gibco,美国),胎牛血清(Gibco,美国),台盼蓝和CCK8(Sigma,美国)试剂,普鲁士蓝染色剂。

图1 纳米SPIO颗粒扫描电镜图。Figure 1. Scanning electron microscope photo of SPIO nanoparticles.
1.2 实验方法
1.2.1 人ADSCs的体外分离、培养和传代
人乳腺切除术获取的脂肪组织,在无菌条件下从无菌袋中取出,表面用大量含1%双抗的磷酸盐缓冲溶液(PBS)冲洗,剪碎大约1 mm3,转入50 mL离心管中,加入等体积1%Ⅰ型胶原酶,37℃恒温水浴摇床振荡(60±15)min,200目网筛过滤分离后溶液1 700 r/min离心20 min后,弃上层混液后,沉淀用PBS冲洗,1 000 r/min离心10 min后,计数,按1×105mL-1接种密度接种于含15%的H-DMEM培养基中,37℃,5%CO2培养。48 h半量换液,以后每2~3 d换液一次。当细胞90%融合时,用0.25%胰蛋白酶(solaribo,美国)和0.02%EDTA(Gibco,美国)消化细胞,待细胞大部分回缩变并有少量细胞漂浮于溶液中时,加入等量含血清的培养基终止消化,反复吹打后将含细胞的悬液1 000 r/min离心5 min,细胞接种密度为1×105mL-1。
1.2.2 SPIO标记ADSCs细胞和相关检测
取生长状态良好的第三代ADSCs细胞,接种于24孔板,待细胞密度达80%时,PBS冲洗2次,实验组,按100、50、25、10、5、1 μg/mL浓度的SPIO加入培养基中,孵育24 h。同期培养未标记的ADSCs为对照组。
台盼蓝染色:取标记好的ADSCs,PBS冲洗2次,0.25%胰酶和0.02%EDTA消化细胞,1000r/min离心5 min,弃上清,残余液体吹打呈悬液,通过台盼蓝染色,对细胞进行计数。存活率=活细胞/总细胞× 100%。
普鲁士蓝染色:取标记好的ADSCs,PBS冲洗2次,加入4%多聚甲醛室温固定30 min,打掉后PBS冲洗3次,加入新鲜的普鲁士蓝溶液(A液:2%亚铁氰化钾,B液:2%盐酸;临用前A、B液等量混合,静止5 min)37℃水浴作用30 min,PBS冲洗3次,加入0.1%中性红复染5 min,观察结果,核呈红色,Fe3+呈蓝色,表明标记成功。标记率=标记细胞/视野中所有细胞×100%
取磁标记ADSCs分别调整细胞数为5×103蛐孔,接种于6块96孔培养板,每板7组,每组3孔,每孔150 mL,每3天换液。每24 h取出1板,每孔加入MTT(0.2 mg蛐mL)培养液150 μL,37℃孵育4 h,吸尽孔内液体,每孔加入150 μL DMSO,震荡10 min,自动酶联免疫检测仪测定490 nm吸光度,取3孔吸光度值的平均值。
1.2.3 体外磁标记ADSCs核磁共振影像
细胞正常传代,按1×106个细胞接到25 cm3瓶中,静置24 h后,细胞融合达80%~90%,标记细胞,SPIO浓度为 100、50、25、10、5、1 μg/mL,37℃孵育24 h,标记细胞PBS洗2次,胰酶消化,4℃多聚甲醛固定成悬液,然后离心后重悬于装有60℃ 1%琼脂1.5 mL于2 mL的EP管内,自然冷却固化后置于MR扫描仪成像。
MR扫描使用GE signal HDxt 3.0TMR超导型扫描仪,8通道HD Wrist Array。成像序列如下,SE T1W:TR/TE 2 762/23.8 ms,TI 860 ms,FOV 13 cm ×13 cm,层厚3.0 mm,层间隔0.3 mm,256×192。FSET2:TR/TE 2 000/82.8 ms,带宽25 kHz,FOV 13 cm× 13 cm,层厚3.0 mm,层间隔0.3 mm,256×256。T2*-GRE:TR/TE 300/20,带宽31.2 kHz,FOV 13 cm× 13 cm,层厚3.0 mm,层间隔0.3 mm,256×192。R2* mapping:TR/TE 150/2.2,带宽41.7 kHz,FOV 12 cm× 12 cm,层厚4 mm,层间隔0 mm,256×192。
1.3 影像资料分析
MRI扫描信息传至ADW 4.4工作站,分别测量(T1WI、T2WI、T2*WI)信号强度及信号强度变化率(△SI=(SI1-SIn)/SI1)。R2*mapping扫描后原始数据在ADW 4.4工作站上使用Reportcard 4.0软件经重建后测量感兴趣区 R2*值及 R2*值变化率(△R2*=(R2*n-R2*1)/R2*1)。
2 结果
2.1 不同浓度SPIO标记ADSCs
在第三代 ADSCs中加入 0、1、5、10、25、50、100 μg/mL浓度的SPIO,作用24 h。用普鲁士蓝染色结果发现铁标记主要存在于ADSCs细胞的胞浆中,染成蓝色;通过细胞计数计算标记率,细胞标记率=一个视野中所标记细胞数/总细胞×100%。SPIO在10μg/mL浓度以上,标记率达到80%以上,在25μg/mL浓度以上,标记率可以达到95%,25、50、100 μg/mL浓度下的标记率没有显著差异(图2);随着浓度的增加,细胞内蓝染颗粒逐渐增多(图3)。台盼蓝检测细胞存活率结果发现在浓度为50μg/mL和100μg/mL浓度标记的细胞存活率明显下降,与25 μg/mL以下浓度的标记细胞的存活率有明显差异(图4)。
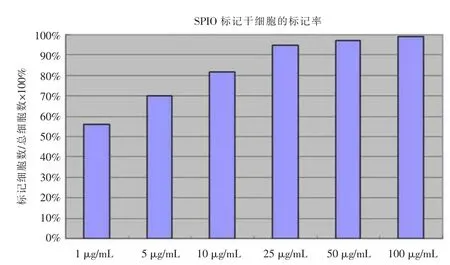
图2 SPIO标记ADSCs标记率(n≥5)。Figure 2.The SPIO labeling efficiency of ADSCs(n≥5).
2.2 SPIO标记ADSCs MTT
见图5。随着标记浓度的增高,时间的推移,在早期SPIO的浓度对细胞增殖影响不明显,50 μg/mL SPIO标记细胞在第5天时出现了显著性差异,而在第7天100 μg/mL SPIO标记细胞增殖能力明显下降,25 μg/mL的增殖能力最强。
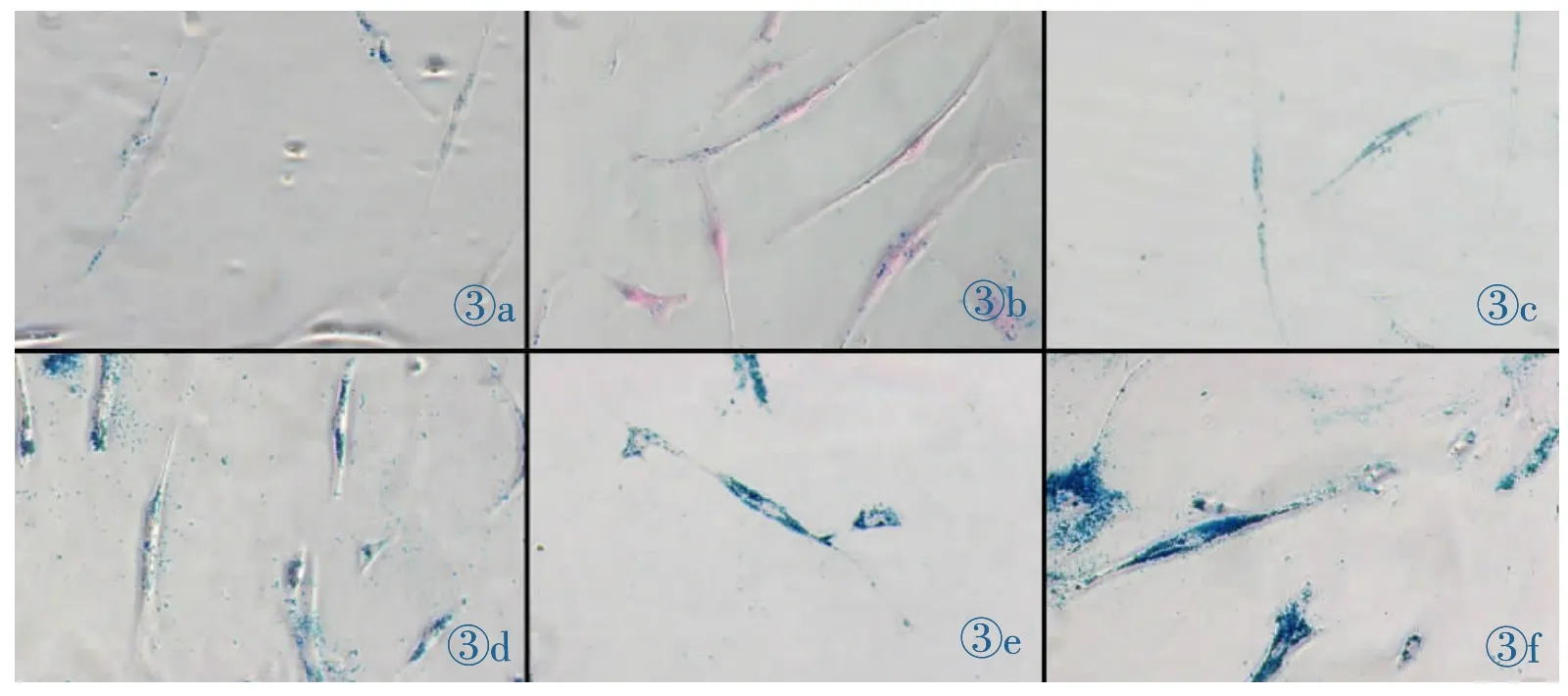
图3a~3f 标记的铁浓度分别为1、5、10、25、50、100μg/mL,蓝染颗粒逐渐增多。Figure 3a~3f. The SPIO labeling concentration: 1, 5,10,25,50,100 μg/mL, accordingly blue-stain particles gradually increased.
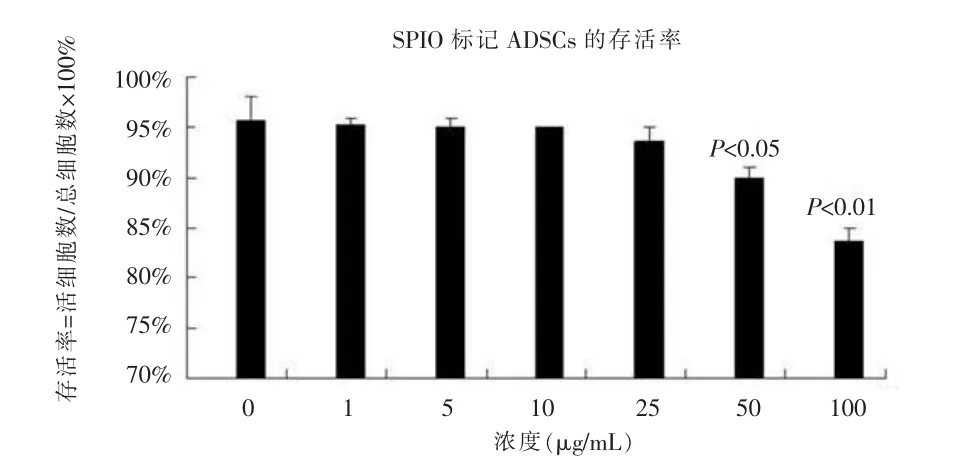
图4 SPIO标记ADSCs细胞的存活率。Figure 4.The survival rate of SPIO labeled ADSCs。
2.3 磁共振结果
不同标记浓度EP管(SPIO铁浓度1、5、10、25、 50、100 μg/mL)的T1WI和T2WI影像随着铁浓度的升高信号降低,25 μg/mL以上标记的EP管的信号强度T2WI信号降低更为明显;在T2*-GRE序列上,10 μg/mL以上标记的EP管的信号强度明显降低;R2*mapping序列也显示随着SPIO铁浓度增高信号降低,但是与 25、50、100 μg/mL铁浓度测得的R2*值明显高于10 μg/mL,50 μg/mL和100 μg/mL高于25 μg/mL(图6和表1)。
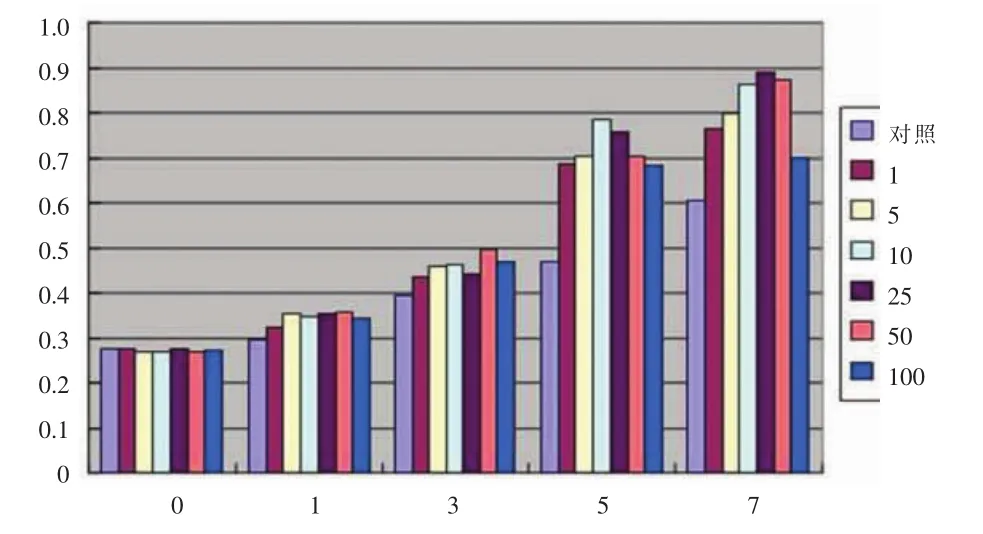
图5 横坐标为天数,分别为标记后0、1、3、5、7天,纵坐标为吸光度值(OD值),分为7组(SPIO铁浓度0、1、5、10、25、50、100μg/mL)。Figure 5. Abscissa:days(0,1,3,5,7 days),ordinate:optical density of groups based on SPIO labeling concentration:0,1,5, 10,25,50,100 μg/mL.
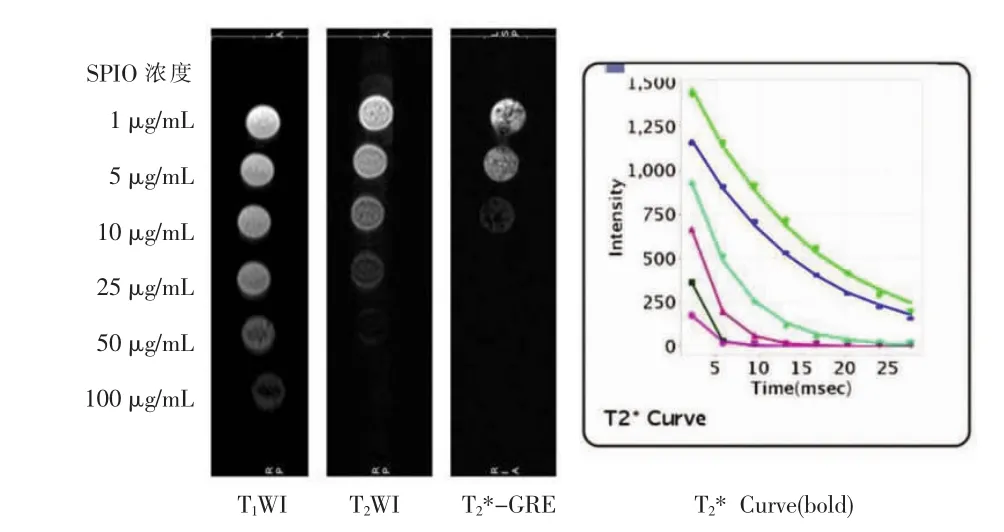
图6 随着SPIO标记浓度的增加,标记细胞测得T1WI、T2WI、T2*-GRE信号降低;T2*值信号曲线。Figure 6. The signal of T1WI,T2WI,T2*-GRE decreased along with the SPIO labeling concentration increased.The curve of T2*signal value.

表1 SPIO各种铁浓度时MRI各序列测量结果
3 讨论
干细胞移植是当今再生医学研究的热点与前沿课题,但干细胞移植后如何活体监测其迁徙情况一直是困扰广大研究者的瓶颈问题。以往的研究多采用脂质体、病毒载体将荧光标记蛋白转导入干细胞内,但这类方法只能用组织化学或分子生物学手段进行移植后的检测,无法做到细胞移植后活体水平无创的实时动态标记检测,且存在毒性大,病毒安全性不高等缺点。自20世纪90年代Weissleder[4]提出分子影像学的概念以来,SPIO已成为磁共振分子影像学研究的主要技术手段之一。多项研究证明,MRI可在较长时间活体监测实验动物体内不同部位SPIO标记干细胞的存活、定居、迁移甚至分化,具有空间分辨率高、定位精确、组织结构显示清晰等优点。
菲立磁是经美国FDA认证的少数可临床应用的MR对比剂之一,它是网状内皮系统特异性、敏感性高且安全的核磁共振阴性对比剂,可明显提高实质性器官尤其是肝脏局灶病变的早期定位及定性鉴别诊断。菲立磁属广谱性标记物,颗粒表面带负电荷,标记效率低[10],需要转染剂修饰后方能提高标记细胞效率。对干细胞标记不具有特异性。目前中国自合成的超顺磁性Fe3O4仍在研究阶段,并未能用于临床。鉴于以上问题本实验采用自合成纳米磁性Fe3O4,以Fe3O4为核心,表面用硅包被,再加以胺丙基修饰,主要目的是增加其亲水能力,由于表面带有电荷,SPIO容易静电聚团,因此在标记前需超声振荡。
通过实验结果发现,新型的SPIO颗粒可以直接标记脂肪干细胞,并随着标记铁浓度的增加,标记率逐渐增高。铁浓度在10 μg/mL以上时,标记率可以达到80%,在高于25 μg/mL时,标记率可以达到95%以上,浓度增加,标记率并没有显著差异。但是在细胞活性的检测中发现当SPIO的浓度在50μg/mL以上时,会影响细胞活性,细胞活性明显下降,考虑与过多的铁颗粒,影响细胞活性有关。对标记的脂肪干细胞进行细胞活性检测时也发现,在标记的早期(3天以内),各种铁浓度标记的干细胞的增殖能力没有显著差异,但随着时间的延长,可以见到高浓度(50 μg/mL以上)的铁颗粒标记的干细胞,细胞增殖能力有一定程度的下降,并且浓度越高,影响越明显。因此从标记的有效性,以及对干细胞活性和增殖能力几个方面综合分析,25 μg/mL铁浓度的新型SPIO颗粒可以有效标记ADSCs,并不影响干细胞的基本活性,对细胞无损害。
自合成SPIO的核心为Fe3O4颗粒,对外加磁场敏感性高,可以同时缩短T1WI、T2WI信号,但主要缩短T2值。进行MR成像,随着铁浓度的逐渐升高,常规T1WI和T2WI序列信号逐渐减低,SPIO的铁浓度≥25 μg/mL时,T2WI信号降低较T1WI更为显著,信号强度变化率能达到82.3%。T2*-GRE序列对磁场不均匀更为敏感,使用翻转的梯度回波,不使用180°的重聚脉冲,小角度激发,具有极好的对比噪声比,对SPIO的检出更为敏感[11-12];所以当SPIO浓度达到10 μg/mL以上时,影像上即能显示信号的明显降低,同时T2*-GRE序列信号强度变化率的显著减低,可达到79.5%。T2*-GRE序列对低浓度的SPIO具有较强的检查能力,与周斌等[13]的研究结果相符。
Anderson等[14]已经证明了T2*与非纤维化的肝细胞内铁浓度的93%呈负性对数的线性相关,R2*技术可以应用于肝脏铁含量的定量[15-16]已经得到了美国FDA批准。本实验应用R2*mapping序列对体外标记SPIO的干细胞进行成像,通过半定量测定,间接反映细胞内铁含量。MRI通过测量横向弛豫率R2*来反应铁的含量。对含有 Fe3O4纳米颗粒(SPIO)的琼脂糖凝胶试管内进行扫描,所得数据通过GE-Repordcard 4.0软件包进行数据分析,结果显示:不同铁浓度SPIO标记的干细胞的EP管随着浓度的增加R2*升高,当SPIO的铁浓度≥25 μg/mL时,R2*值明显增高,得到了200.7%变化率,证明了应用R2*mapping序列进行SPIO的半定量测定对自合成SPIO标记干细胞体外检测的可行性。但对活体标记干细胞的检查还待研究。
因此新型自合成SPIO纳米颗粒易于被ADSCs摄取,具有较好的生物相容性,25 μg/mL铁浓度为较理想的标记浓度,可以达到有效标记并被MR检测,又不影响细胞活性和基本功能;T2*-GRE和R2* mapping、T2WI序列都可作为检测自合成SPIO纳米颗粒敏感序列,T2*-GRE更为敏感。
[1]Zuk PA,Zhu M,Mizuno H,et al.Multilineage cells from human adipose tissue:implications for cell-based therapies[J].Tissue Eng,2001,7(2):211-228.
[2]Gronthos S,Franklin DM,Leddy HA,et al.Surface protein characterization of human adipose tissue-derived stromal cells[J].Cell Physiol,2001,189(1):54-63.
[3]De Ugarte DA,Morizono K,Elbarbary A,et al.Comparison of multi-lineage cells from human adipose tissue and bone marrow [J].Cells Tissues Organs,2003,174(3):101-109.
[4]Weissleder R.Molecular imaging:exploring the next frontier[J].Radiology,1999,212(3):609-614.
[5]Neri M,Maderna C,Cavazzin C,et al.Efficient in vitro labeling of human neural precursor cells with superparamagnetic iron oxide particles:relevance for in vivo cell tracking[J].Stem Cells, 2008,26(2):505-516.
[6]Zhang Z,Mascheri N,Dharmakumar R,et al.Superparamagnetic iron oxide nanoparticle-labeled cells as an effective vehicle for tracking the GFP gene marker using magnetic resonance imaging [J].Cytotherapy,2009,11(1):43-51.
[7]Peldschus K,Kaul M,Lange C,et al.Magnetic resonance imaging of single SPIO labeled mesenchymal stem cells at 3 Tesla[J].Rofo,2007,179(5):473-479.
[8]Liu G,Yang H,Zhang XM,et al.MR imaging for the longevity of mesenchymal stem cells labeled with poly-L-lysine-Resovist complexes[J].Contrast Media Mol Imaging,2010,5(2):53-58.
[9]Arbab AS,Yocum GT,Wilson LB,et al.Comparison of transfection agents in forming complexes with ferumoxides,cell labeling efficiency,and cellular viability[J].Mol Imaging,2004,3(1):24-32.
[10]Bulte JW,Kraitchman DL.Monitoring cell therapy using iron oxide MR contrast agents[J].Curr Pharm Biotechnol,2004,5(6): 567-584.
[11]Roshal LM,Tzyb AF,Pavlova LN,et al.Effect of cell therapy on recovery of cognitive functions in rats during the delayed period after brain injury[J].Bull Exp Bio Med,2009,148(1): 140-147.
[12]Choi JS,Kim MJ,Kim JH,et al.Comparison of multi-echo and single-echo gradient-recalled echo sequences for SPIO-enhanced liver MRI at 3 T[J].Clin Radiol,2010,65(11):916-923.
[13]周斌,于春鹏,李丹,等.大鼠骨髓间充质干细胞的超顺磁性氧化铁颗粒标记及MR成像 [J].中国医学影像技术,2008,24(12):1879-1882.
[14]Anderson LJ,Holden S,Davis B,et al.Cardiovascular T2-star (T2*)magnetic resonance for the early diagnosis of myocardial iron overload[J].Eur Heart J,2001,22(23):2171-2179.
[15]Ghugre NRL,Enriquez CM,Coates TD,et al.Improved R2* measurements in myocardial iron overload[J].J Magn Reson Imaging,2006,23(1):9-16.
[16]Wood JCL,Enriquez C,Ghugre N,et al.MRI R2 and R2* mapping accurately estimates hepatic iron concentration in transfusion-dependent thalassemia and sickle cell disease patients[J].Blood,2005,106(4):1460-1465.
MR tracking in vitro of adipose tissue-derived stem cells labeled with self-synthesis superparamagnetic iron oxide nanoparticles
SUN Bo,DONG Yue,LIU Jing,WANG Nan,SHI Ai-jun,ZHAO Jing-yuan
(The First Affiliated Hospital of Dalian Medical University,Dalian Liaoning 116011,China)
Objective:To assess the effects of superparamagnetic iron oxide(SPIO)nanoparticles on viability and function of adipose tissue-derived stem cells(ADSCs),and characterize the magnetic properties of the SPIO-labeled ADSCs in vitro.Methods:The silicon and amine coated SPIO(Fe3O4)nanoparticles were donated by Dalian Institute of Chemical Physics.ADSCs were obtained and cultured from adipose tissue of patients who had a mastectomy under informed consent.The SPIOs label was added to the cultures at Fe concentrations equivalent to 1,5,10,25,50,100 μg/mL and incubated for 24 h.Control cultures were incubated without SPIOs.The labeling efficiency was calculated as number of Prussian blue labeled cells/total number of cells in the sample.MTT was used for cell viability assay.ADSCs were incubated with SPIO at 25 μg/mL for 24 h.T1WI,T2WI,T2*WI and R2*mapping images were acquired using a 3.0T-MR scanner(GE signal HDxt,USA),values and change rate of T1WI,T2WI,T2*WI and R2*were measured.Results:We observed a good correlation between SPIO uptake and the iron concentration in the culture medium.As the concentration of iron increased,the amount of intracellular iron increased,but there is no significant difference when the concentration was greater than 25 μg/mL.Treatment with doses up to 25 μg/mL significantly affected the survival and proliferation of ADSCs.At the same time values of T2*WI and R2*rise obviously.Conclusion:The amine-surface-modified SPIO nanoparticles are not deleterious to ADSCs and do not affect their proliferation,and which appeared to be a candidate for in vitro ADSCs labeling.The optimum concentration is 25 μg/mL.
Mesenchymal stem cells;Adipocytes;Magnetic resonance imaging
R339.23;R318;R445.2
A
1008-1062(2016)06-0385-05
2015-10-29;
2015-12-14
孙博(1979-),男,辽宁本溪人,副主任医师。E-mail:sunboycmu@163.com
董越,大连医科大学附属第一医院放射科,116011。E-mail:dyy1026@sina.com

