喷射蒸煮技术在制备易消化玉米浓缩蛋白中的应用
王超跃,王永辉,杨晓泉,王金梅,郭 健
(华南理工大学轻工与食品学院食物蛋白工程研究中心,广州 510640)
喷射蒸煮技术在制备易消化玉米浓缩蛋白中的应用
王超跃,王永辉,杨晓泉※,王金梅,郭健
(华南理工大学轻工与食品学院食物蛋白工程研究中心,广州 510640)
摘要:为了提供一种具有良好消化性的玉米蛋白,该研究以玉米黄粉(corn gluten meal,CGM)为原料,利用亚临界脱脂及酶解超滤技术制备了一种蛋白纯度较高的玉米浓缩蛋白(corn protein concentrates,CPC),并重点考察了制备过程中喷射蒸煮对玉米浓缩蛋白功能性质及消化性的影响。研究结果表明,经喷射蒸煮处理后的玉米浓缩蛋白(jet cooking corn protein concentrates,JC-CPC),普通高温处理的玉米浓缩蛋白(heat treatment corn protein concentrates,HT-CPC)以及未经高温处理的玉米浓缩蛋白(CPC),三者在蛋白质质量分数及氨基酸组成上无明显差异(P>0.05)。但JC-CPC的溶解性及功能性质(持水性、起泡性及泡沫稳定性)均显著高于CPC和HT-CPC(P<0.05)。体外模拟消化试验结果表明,JC-CPC的水解度(24.02%±0.49%)明显高于CPC和HT-CPC(分别为9.23%±0.45%和14.52%±1.26%)(P<0.05),其可溶性氮释放量(62.05%±0.75%)亦高于HT-CPC(40.25%±0.19%)、JC-CPC(21.02%±0.72%)(P<0.05)。同时,JC-CPC消化产物的抗氧化试验结果表明,其消化产物具有较高的还原力及1,1-二苯基-2-苦基肼(1,1-Diphenyl-2- picrylhydrazyl,DPPH)自由基的清除能力。因此,利用喷射蒸煮技术,结合亚临界及超滤除杂技术能够为食品工业提供一种具有良好消化性的玉米浓缩蛋白,有望为玉米黄粉的利用提供一条有效途径。
关键词:蛋白;酶;溶解性;喷射蒸煮;脱酰胺;消化性;抗氧化活性
王超跃,王永辉,杨晓泉,王金梅,郭健. 喷射蒸煮技术在制备易消化玉米浓缩蛋白中的应用[J]. 农业工程学报,2016,32(3):301-308.doi:10.11975/j.issn.1002-6819.2016.03.043http://www.tcsae.org
Wang Chaoyue, Wang YongHui, Yang Xiaoquan, Wang Jinmei, Guo Jian. Application of jet-cooking in preparation of digestible corn protein concentrates[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2016, 32(3): 301-308. (in Chinese with English abstract)doi:10.11975/j.issn.1002-6819.2016.03.043http://www.tcsae.org
Email:swwangcy@163.com
0 引 言
玉米黄粉(corn gluten meal,CGM)是工业湿磨法生产玉米淀粉过程中的副产物,通常其中含有50%~65%的蛋白质,蛋白质成分主要组成是醇溶蛋白和谷蛋白,另有少量的球蛋白和白蛋白,且具有水溶性差、生物利用率低、营养价值比较低等特点[1]。此外,由于CGM油脂及色素含量较高,极易被氧化,从而导致产品品质变差。以上2个原因大大限制了CGM在食品工业中的应用。但近年来的大量研究表明,玉米蛋白的水解物或玉米蛋白肽具有很多生理活性,如玉米肽药物具有抗氧化、抗衰老、醒酒等功能[2],亦可制成血管紧张素转化酶(angiotensin-converting enzyme,ACE)抑制肽[3]。同样能够利用玉米蛋白制备功能性纳米颗粒[4]。但由于玉米蛋白溶解性差,在人体胃肠道内难以被消化,通常直接食用玉米蛋白无法发挥其功能特性。因而,如何改善玉米蛋白的功能性质及消化性,一直是蛋白质深加工领域研究的热点。
脱酰胺作用(deamidation)即在酶、酸、碱等的作用下,脱去蛋白质氨基酸侧链的氨基,产生负电荷羧基,以达到增加静电排斥、伸展和解聚蛋白的目的。有研究[5-7]表明,食物蛋白的功能特性与食物蛋白的结构特征紧密相关,脱酰胺过程中的热处理和pH值等都会对蛋白质的结构产生影响,从而改变蛋白质的功能特性。经过脱酰胺后,小麦面筋蛋白的功能特性和风味会有所改善,可被高效利用。相对于无机酸等脱酰胺方法,有机酸脱酰胺不会产生致癌物质并具有生物安全性[8],所以采用有机酸脱酰胺是该领域的研究热点之一,其主要应用于改变食物蛋白的风味和制备功能性蛋白肽,较少应用于改善蛋白质的消化性。
喷射蒸煮(jet cooking)是一种水热处理技术,主要应用在淀粉和蛋白质加工工业中。喷射蒸煮发生器中的高压水蒸气与物料剧烈对撞能够产生高温和高剪切力的作用,分散不溶于水的淀粉颗粒或伸展大分子蛋白质链。该技术主要运用于蛋白质结构的改性,提高蛋白质的提取率。不仅如此,喷射蒸煮处理本身具有脱酰胺的作用。有研究[9-11]发现,利用喷射蒸煮技术对挤出-压榨法制备的低变性豆粕进行处理,能够使变性粕的得率从40%增加至82%。此外,喷射蒸煮技术也被应用于湿热接枝,进行糖基化反应,但关于喷射蒸煮改善蛋白质的消化性的研究却鲜有报道。
因此,本研究首先应用亚临界萃取、酶解和超滤技术对玉米黄粉进行脱脂及脱淀粉的浓缩处理,然后利用喷射蒸煮技术对浓缩液进行处理后制备玉米浓缩蛋白,重点讨论喷射蒸煮结合柠檬酸的处理对玉米蛋白的功能性质、可消化性的的影响,并考查了消化产物的抗氧化活性。本文结合了柠檬酸脱酰胺和喷射蒸煮改性技术,旨在为食品工业提供一种具备良好消化性的玉米浓缩蛋白,并为开发一种连续化的生产工艺提供参考。
1 材料与方法
1.1试验材料
玉米黄粉(CGM)购于山东御馨生物科技有限公司;α-淀粉酶(酶活力为3.5 AU/g)、Alcalase 2.4 L碱性蛋白酶(酶活力为2.4 AU/g)购于丹麦诺维信公司;胰蛋白酶(效价1∶3 000)、胃蛋白酶(效价1∶250)购于美国Sigma公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picryl-hydrazyl, DPPH)购于阿拉丁公司;其他试剂购于国药集团化学试剂有限公司,均为分析纯。
1.2仪器与设备
Genesys 10s型紫外分光光度计,美国Thermo公司;CR22G型离心机,日本Hitachi公司;高效液相色谱,美国Waters公司;喷射蒸煮发生器:广州南联食品机械公司;UT-788型亚临界萃取釜:河南安阳仪器公司;UF4040(B)型不锈钢超滤膜,上海凯发仪器公司;B-290型喷雾干燥塔,瑞士Buchi仪器公司;KDN-102C型定氮仪,上海纤检仪器公司。
1.3试验方法
1.3.1样品的制备工艺流程
图1为由玉米黄粉(corn gluten meal,CGM)制备玉米浓缩蛋白(corn protein concentrates,CPC)、普通高温处理玉米浓缩蛋白(heat treatment corn protein concentrates,HT-CPC)和喷射蒸煮处理玉米浓缩蛋白(jet cooking corn protein concentrates,JC-CPC)的工业化制备流程。具体过程如下:
1)亚临界萃取技术是将物料与有机溶剂在亚临界萃取釜内混合,再经过浸提、蒸发等步骤,实现从物料中分离目标组分或除去多余杂质的一种技术[12-13]。本步骤利用亚临界萃取的原理,旨在利用亚临界技术脱去玉米黄粉中的粗脂肪,其过程的条件参考前期试验结果:萃取溶剂为丁烷,料液比1∶10 g/mL,压力0.75 MPa,温度为50℃,提取时间30 min,循环2次,后烘干去除有机溶剂;
2)α-淀粉酶酶解过程:参照前期试验,将上述萃取后的原料溶于水中,料液比1∶15 g/mL,调节pH值6.0,温度为90℃,酶的质量分数为5%,酶解时间1 h,酶解结束后调节pH值7.0;
3)不锈钢膜超滤技术可以用于分离、浓缩、纯化和精制等工艺,具有选择性好、高效、循环利用等特点[14-15]。本步骤系利用不锈钢膜超滤技术除去酶解过程中产生的可溶性杂质,即可溶性的杂质透过不锈钢膜而被除去,达到纯化蛋白的目的。膜超滤浓缩条件参考前期试验结果:温度100℃,进口压力0.5 MPa,出口压力0.3 MPa,流速2.0 L/min,循环2次,收集蛋白浓缩液。
4)收集蛋白浓缩液后分别经过以下不同处理过程:①直接将收集的蛋白浓缩液进行喷雾干燥后得到CPC,喷雾干燥参数参照前期试验结果:进口温度150℃,进料速度0.2 L/h;②参照前期试验,向蛋白浓缩液加入2 mol/L的柠檬酸溶液,料液比1∶15 g/mL,充分搅拌后过喷射蒸煮发生器,温度为140℃,时间为90 s。完毕后,调节pH值7.0,脱盐后喷雾干燥,喷雾干燥参数参照前期试验:进口温度150℃,进料速度0.2 L/h。得到JC-CPC;③参照前期试验,向蛋白浓缩液加入2 mol/L的柠檬酸溶液,料液比1∶15 g/mL,充分搅拌后高压锅灭菌锅处理,温度121℃,时间10 min。完毕后,调节pH值7.0,脱盐后喷雾干燥,得到HT-CPC;喷雾干燥参数参照前期试验:进口温度150℃,进料速度0.2 L/h。
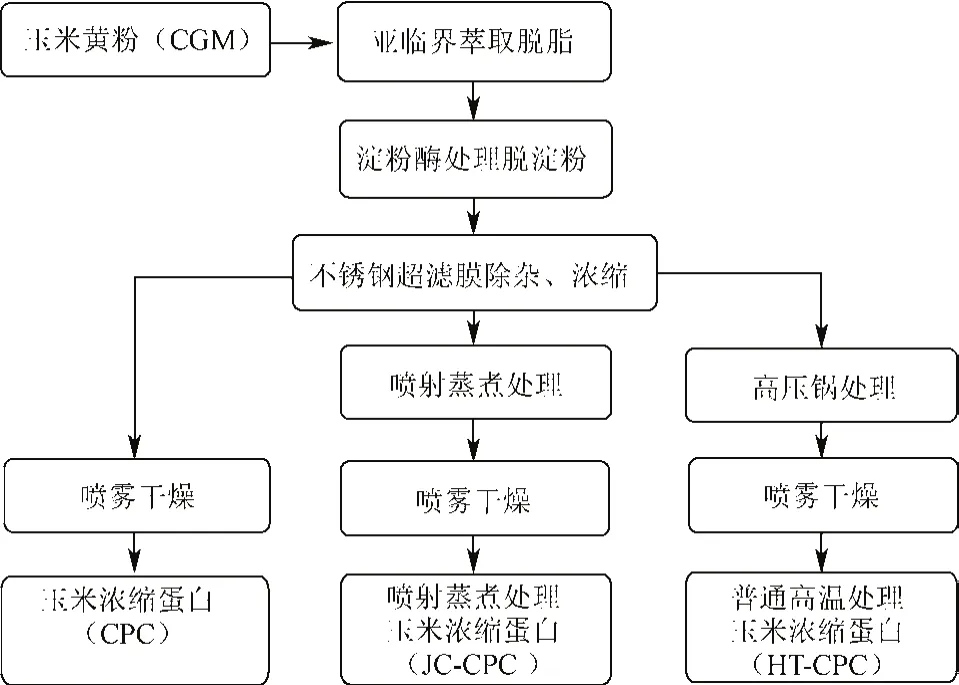
图1 样品制备工艺流程Fig.1 Technological process of preparation of samples
1.3.2玉米浓缩蛋白成分分析
1)蛋白质含量和得率的测定:蛋白质含量的测定采用微量凯氏定氮法[16]。样品中蛋白质质量分数与回收率计算公式如下

式中m1为样品中的蛋白质量,mg;m2为样品的总质量,mg。

式中m3为经过不同处理过程后得到的样品的蛋白质量,mg;m4为原料中的蛋白质量,mg。
2)样品中碳水化合物测定采用3,5-二硝基水杨酸法[17]。取适量的样品于试管中,加入1.5 mL3,5-二硝基水杨酸试剂后摇匀,在沸水浴中加热5 min,取出后立即放入盛有冷水的烧杯中冷却至25℃,再以蒸馏水定容至25 mL刻度处,混匀后在540 nm波长下测定吸光值。以葡萄糖作标准曲线,标准曲线:Y=0.00472X+0.01453,R2=0.9992,X为样品质量浓度,mg/mL;Y为吸光值,nm。
3)粗脂肪的测定:采用索氏抽提法[18]。称取适量的样品包裹于滤纸中,于索氏抽提器中用乙醚反复抽提5 h,将样品烘干后称量,按以下公式计算粗脂肪质量分数
粗脂肪质量分数=[(M1−M2)/(M1−M3)]×100。(3)式中M1为滤纸与样品的总质量,g;M2为抽提5 h后滤纸与样品的总质量,g;M3为滤纸的质量,g。
1.3.3脱酰胺度测定
采用微量弥散皿法[19]测定JC-CPC和HT-CPC的脱酰胺程度。脱酰胺产生的氨含量测定:在弥散皿中央加入20 g/L的硼酸3 mL,取1 mL处理后的样品于弥散皿周围,加入适量饱和氢氧化钠溶液后密封吸收,25℃下放置24 h后测定氨含量;完全脱酰胺样品制备:准确称取0.5 g蛋白质样品置于安培管,加入2 mol/L的盐酸5 mL后抽真空密封,置于115℃烘箱中水解3 h,完全脱酰胺样品氨含量测定方法同上。脱酰胺度计算公式如下

1.3.4溶解度测定
取1.0 g蛋白加入100 mL去离子水,搅拌30 min后用2 mol/L的NaOH液将蛋白液调成pH值2-10共9个梯度,8 000×g离心30 min,分别测定各个pH值下可溶性蛋白质量[20]。溶解度计算公式如下

1.3.5氨基酸组成分析
分别取CPC、HT-CPC和JC-CPC 3种蛋白样品各200 mg置于安培瓶中,加入6 mol/L的盐酸后密封,置于110℃烘箱中完全水解24 h后待测。水解结束后采用高效液相色谱和PICO.TAG氨基酸分析柱测定氨基酸,测定条件为:检测波长254 nm,温度38℃,样品流速1 mL/min。
1.3.6蛋白功能性质测定
1)持水性(water-holding capacity, WHC):配制适量1% 3种样品的蛋白液各15 mL,于磁力搅拌器中搅拌30 min,后8000×g离心30 min处理,小心地弃去上清液后称量此时离心管的质量。持水性计算公式如下

式中m6为离心管的质量,g;m0为去除上清液后离管与蛋白质的质量,g;m5为离心管中蛋白质的质量,g。
2)持油性(oil-holding capacity, OHC):准确称取 3种蛋白样品各1 g置于离心管中,分别加入10 m L食用调和油,用涡旋搅拌器混匀10 min,让样品与油充分混合,再经8 000×g,30 min离心后,小心地弃去上层油,称量此时离心管的质量。持油性计算公式如下
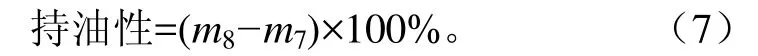
式中m7为空离心管的质量,g;m8为去除上层油后离心管与蛋白质的总质量,g。
3)起泡性(foaming capacity, FC)、泡沫稳定性(foaming stability, FS):配制适量1%不同种样品的蛋白液,利用均质机5 000 r/min均质起泡,迅速地移至100 mL的量筒,记录气泡所占体积V0;后将量筒放在30℃下水浴锅内,静置30 min后,记录剩余气泡体积Vx (mL)。起泡性、泡沫稳定性计算公式如下

式中V0为泡沫所占的体积,mL;Vr为泡沫的残留体积,mL;量筒的体积取V为100 mL。
1.3.7体外模拟消化
体外模拟消化试验采用Nunes等[21-22]报道的模型,并作适当修改。配制1%的蛋白液,加入胃蛋白酶进行酶解。酶解条件为:酶的质量分数为1%,温度为37℃,pH 值1.5。在0、1、5、10、30、60和120 min时分别取样。120 min(即胃蛋白酶消化阶段结束)后,加入胰蛋白酶再消化120 min,pH值6.7,其他条件同上。在121、125、130、150、180和240 min时分别取样。测定以下指标:
1)氮释放量测定:蛋白消化过程中可溶性氮释放量采用TCA-NSI法[23-24]测定。取5 mL不同消化时间的样品溶液加入5 mL 10%三氯乙酸(trichloroacetic acid, TCA)终止消化,反应30 min后8 000×g离心15 min,取沉淀部分(TCA不溶性氮组分)待测。样品蛋白质总氮和TCA不溶性氮含量均采用微量凯氏定氮法测定。氮释放量计算公式如下
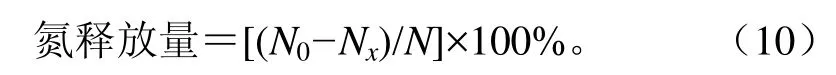
式中Nx为消化x min时的不溶性氮量,mg;N0为消化初始的不溶性氮量,mg;N为蛋白样品中的总氮量,mg。
2)水解度测定:采用茚三酮比色法[25]测定消化液水解度。分别对不同消化阶段的水解液进行稀释,取稀释后的水解液4.0 mL,加入缓冲溶液(pH值8.0)1.5mL,茚三酮溶液1.5 mL,置于沸水浴中,反应20 min后用冰水迅速冷却至25 ℃,去离子水稀释至相同倍数,测定其吸光度(570 nm)。水解度计算公式如下

1.3.8抗氧化活性
抗氧化活性主要测定DPPH 自由基的清除能力和对比还原力的大小,设计以下2组试验。第1组(JC-CPC消化产物):经过胃蛋白酶和胰蛋白酶后,8 000×g离心20 min,弃沉淀,冷冻干燥(−40℃,0.1 kPa)后待测。第2组(对照组):利用Alcalase 2.4 L碱性蛋白酶对JC-CPC进行酶解,酶解条件:酶的质量浓度和酶解时间与第一组一致,温度为50℃,pH值为8.0,酶解结束后,8 000×g离心20 min,弃沉淀,冷冻干燥后待测。
1)还原力测定:配制一定浓度的酶解产物溶液,加入0.2 mol/L PBS缓冲液(pH值6.6)及1% K3[Fe(CN)6]溶液1.0 mL,50℃水浴加热20 min,加入10%TCA溶液1.0 mL,充分混匀,4℃下5000×g离心20 min,取上清液1.5 mL,加入去离子水1.5 mL和0.1% FeCl3溶液0.3 mL,充分震荡后室温下反应20 min,测定吸光值(700 nm处)。
2)1,1-二苯基-2-苦基肼(1,1-diphenyl-2- picrylhydrazyl,DPPH)自由基清除率测定:将消化产物冻干粉配制成2 mL不同浓度样品液,加入1 mmol/L的DPPH乙醇溶液2.0 mL。充分震荡后避光30 min,测定其吸光值(517 nm处)。空白样只添加乙醇,对照组用蒸馏水代替消化产物。DPPH自由基清除率计算方式如下式中A样品为样品组吸光值;A空白为空白组吸光值;A对照为对照组吸光值。

1.4数据处理
采用SPSS 17.0统计软件对数据进行方差分析、相关性分析,用Duncan多重比较进行显著性分析,显著性水平为P<0.05。所有试验数据均采用平均值±标准差(Mean±SD)表示。
2 结果与分析
2.1玉米浓缩蛋白成分分析
由表1可以看出,CGM中粗脂肪质量分数约6.02%±1.01%,经过亚临界脱脂后,粗脂肪被完全脱去,CPC、HT-CPC和JC-CPC中已经检测不到粗脂肪的存在;CGM中的碳水化合物主要是以淀粉形式存在,质量分数为29.11%±0.40%,经过α-耐温淀粉酶酶解后,CGM中的淀粉被α-淀粉酶解为可溶性糖,再经过超滤后被除去,CPC、HT-CPC中JC-CPC的碳水化合物含量大幅降低(P<0.05);CGM中的蛋白质质量分数为58.90%±1.21%,经过亚临界脱脂和淀粉酶酶解脱淀粉后,制得的CPC蛋白质质量分数可达到81.31%±0.31%。这是因为亚临界脱脂使得脂肪被完全除去,淀粉酶酶解使得淀粉被酶解为可溶性糖而降低含量,蛋白质含量则相应地提高,但是亚临界和酶解过程不会对蛋白质产生影响。在工业化生产中,除了不锈钢膜超滤除杂、浓缩技术外,也可以用传统的离心技术等代替。故CPC、HT-CPC和JC-CPC的蛋白质质量分数、回收率等并没有明显差异(P>0.05),同时也说明普通高温处理和喷射蒸煮处理均不会对样品的蛋白质质量分数和回收率产生影响。

表1 玉米黄粉及3种玉米浓缩蛋白的组成百分比及回收率Table 1 Component and yield of CGM, CPC, HT-CPC and JC-CPC
2.2HT-CPC和JC-CPC的脱酰胺度
脱酰胺处理是对蛋白质修饰改性的手段之一,蛋白质通过脱酰胺处理后,谷氨酰胺及天冬酰胺可分别转变为亲水性谷氨酸和天冬氨酸,这通常可以提升蛋白质的溶解性及功能性。经过脱酰胺处理后,HT-CPC的脱酰胺度为15.15%±1.21%,JC-CPC的脱酰胺度为28.73%± 0.87%;造成JC-CPC的脱酰胺度高于HT-CPC可能有以下两方面原因:通常情况下,在脱酰胺处理过程中,温度越高,脱酰胺度也越高[8]。JC-CPC经过喷射蒸煮处理时,温度可以达140℃,高于普通高温处理的温度(121℃);另一方面,虽然喷射蒸煮处理过程只有90 s,少于普通高温处理的时间(10 min),参照前人的研究[9],可以认为喷射蒸煮处理过程中水蒸气与物料的剧烈对撞产生高温高剪切力作用,这使得柠檬酸和蛋白质反应脱去酰胺集团的反应速率增加,从而在短时间内提高JC-CPC的脱酰胺程度。
2.3溶解度
溶解度影响蛋白质的提取、纯化、分离与功能特性等,与蛋白质本身的空间结构有着密切的关系,此外也受到温度、pH值等环境因素的影响,是蛋白质的一个重要性质。通过图2可以看出,在25℃条件下,CPC、HT-CPC 和JC-CPC的溶解度均呈现U型趋势,等电点附近pH值5-6蛋白质的溶解度最低;研究[1]表明,CGM含有醇溶蛋白、谷蛋白、白蛋白等蛋白,谷蛋白、白蛋白等在酸碱性条件下呈现出一定的溶解性,故CPC、HT-CPC和JC-CPC在酸性和碱性条件下同样具备一定的溶解性。在碱性条件下,JC-CPC的溶解度高于HT-CPC和CPC (P<0.05);在酸性条件下3种样品溶解度的变化与碱性条件下类似。结合脱酰胺度的数据可知,脱酰胺度越高,溶解性越高。有研究[5]表明,样品制备过程中酸性条件下的脱酰胺作用使得蛋白质脱去难溶于水的酰胺基团,生成可溶于水的羧基基团,增加整个体系的负电子含量,削弱了蛋白质之间的相互作用,增强了蛋白质与水的作用,这能够极大地提高蛋白质的溶解性;另一方面,喷射蒸煮处理的过程中能够产生高温高剪切力作用,使玉米蛋白中致密的结构进一步解离和伸展,从而导致原来掩蔽在内部的肽链和一些极性基团转向表面[8]。但单独使用普通高温处理的HT-CPC的溶解性低于经过喷射蒸煮处理的JC-CPC溶解性(P<0.05),说明是上述两方面的综合作用使得JC-CPC的溶解度得到了提高。

图2 3种玉米浓缩蛋白在不同pH值下的溶解度Fig.2 Solubility profile of three kinds of corn protein concentrates at different pH values
2.4氨基酸分析
通过表2可以看出,CPC中含有大量的谷氨酸、亮氨酸、脯氨酸、丙氨酸等疏水性氨基酸,缺乏赖氨酸、组氨酸等亲水性氨基酸,这造成了其溶解性比较差,也影响着玉米蛋白的应用,这与前人的研究一致[2]。这也说明,CGM经过脱脂脱淀粉的过程后,蛋白质中氨基酸的成分并没有改变。CPC经过普通高温处理和喷射蒸煮处理后,HT-CPC和JC-CPC的主要的氨基酸组成(如亮氨酸、丙氨酸等)也没有发生改变。
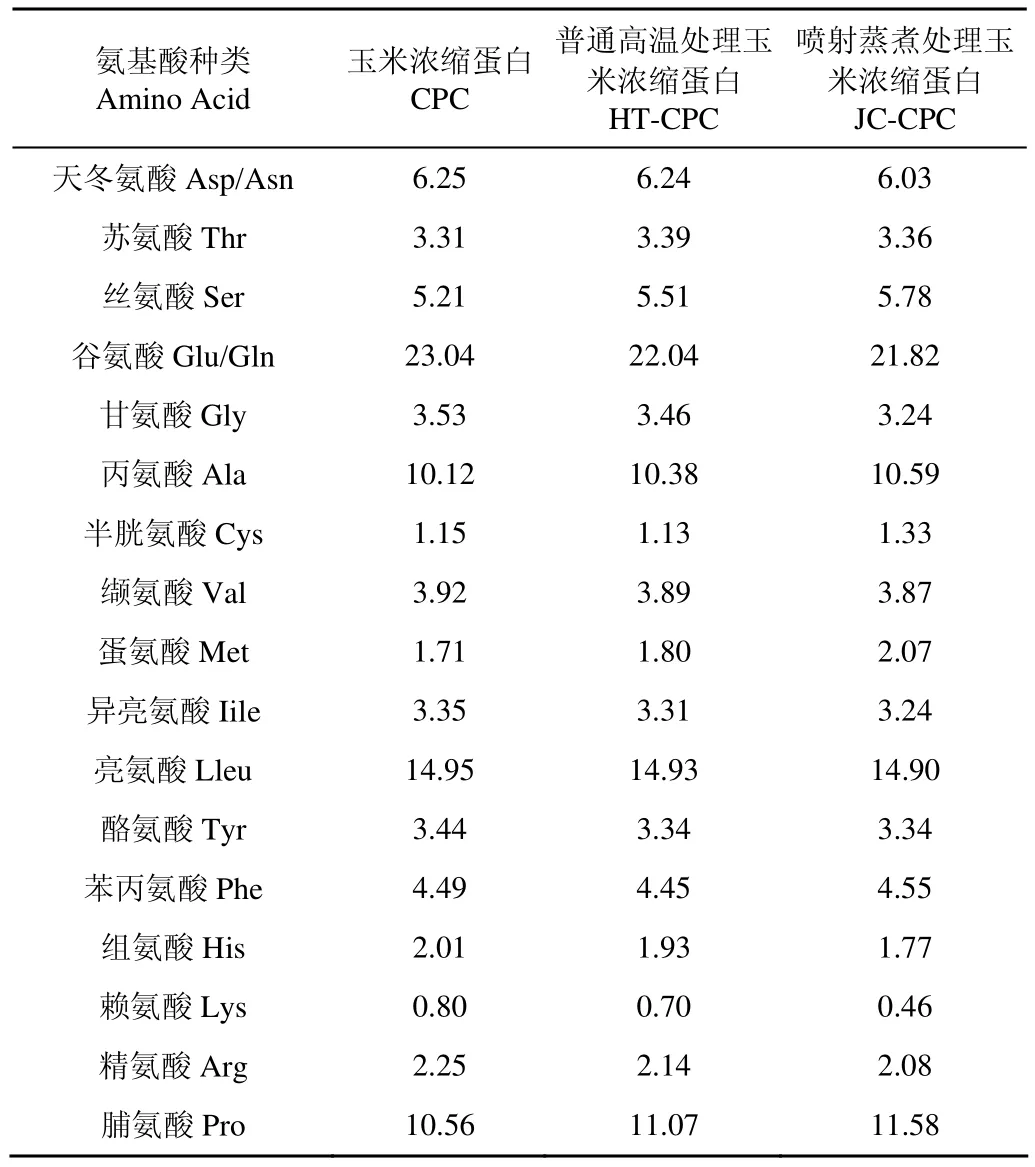
表2 3种玉米浓缩蛋白的氨基酸组成分析Table 2 Amino acid composition of three kinds of corn protein concentrates %
2.53种玉米浓缩蛋白的功能性质
通过表3可以看出,经过喷射蒸煮处理后,JC-CPC的持水性为6.4 mL/g±1.01 mL/g高于HT-CPC、CPC(P<0.05);相对于CPC,HT-CPC和JC-CPC的起泡能力和泡沫稳定性均显著增加(P<0.05)。其中,JC-CPC的起泡能力最高、泡沫稳定性最好,分别达到35.87 mL±1.58 mL和45.33%±0.27%;有研究[10,26]表明,高温高湿处理会使蛋白质的持水性增加,这使得HT-CPC与JC-CPC 2种样品经过高温处理的样品的持水性高于未经过任何高温处理的样品。而且喷射蒸煮处理过程中产生的高温高剪切作用会使蛋白质中原本结构致密的蛋白结构发生去折叠,导致掩蔽在内部的肽链和极性基团得到展开,这就使得蛋白质更加容易吸附在气-水界面上,持水性也相应地增加;另一方面,柠檬酸脱酰胺作用使得蛋白质的溶解性增加,其起泡能力也会随之增强。而且柠檬酸脱酰胺作用使得蛋白质亲水基团和疏水基团趋近于平衡,这有利于泡沫体系中气泡的稳定性。
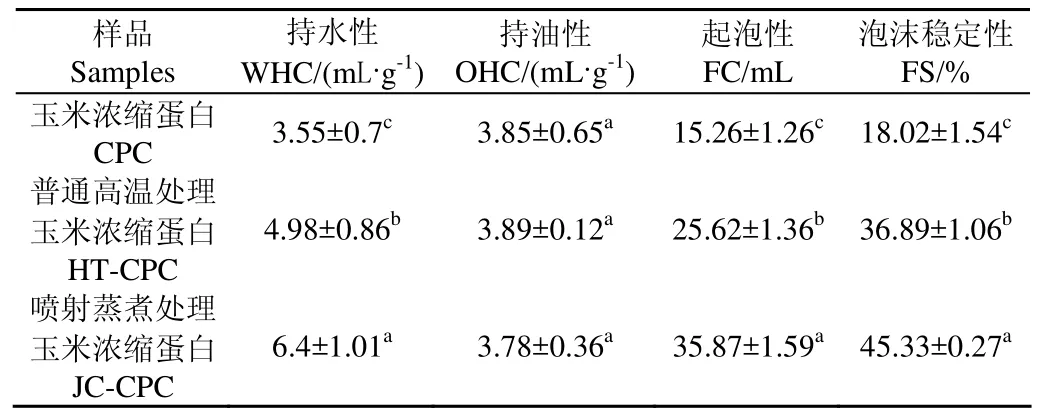
表3 3种玉米浓缩蛋白的功能性质Table 3 Functional properties of three kinds of corn protein concentrates
2.6体外模拟消化结果
由图3a可以看出,经过胃蛋白酶消化后,JC-CPC的水解度达到12.98%±0.45%,高于CPC和HT-CPC (P<0.05);经过胰蛋白酶消化后,3种样品的水解度均不同程度地增加。JC-CPC的水解度达到24.02%±0.49%,高于CPC(9.23%±0.45%)和HT-CPC(14.52%±1.26%)(P<0.05);消化过程中可溶性氮释放量可以作为水解度的补充,反映蛋白质被消化过程的情况。

图3 3种玉米玉米浓缩蛋白体外模拟消化试验结果Fig.3 Results of in vitro digestion of CPC, HT-CPC and JC-CPC
由图3b可以看出,在模拟胃肠道消化中,CPC、HT-CPC和JC-CPC的可溶性氮释放量随着消化时间的增加而增加。在胃蛋白酶消化阶段(0~120 min),CPC、HT-CPC和JC-CPC的可溶性氮释放量增加趋势相似,都是在消化的开始阶段(0~60 min)急剧地增加,然后增速逐渐趋缓,直到胃蛋白酶消化阶段结束(120 min时)而到达最大值。当胃蛋白酶消化120 min时,JC-CPC的可溶性氮释放量达到41.22%±0.60%,高于CPC和HT-CPC(P<0.05),分别为12.55%±1.59%和17.71%± 0.49%。在加入胰蛋白酶后,氮溶系数呈现出与胃蛋白酶消化阶段相似的变化趋势。在消化结束后,JC-CPC的可溶性氮释放量为62.05%±0.75%,高于CPC和HT-CPC (P<0.05)。本研究的结果和前人的研究[15]都表明:一方面,柠檬酸的脱酰胺作用和喷射蒸煮处理增加了蛋白质的溶解度,这使得蛋白质与酶结合的速率更快,从而提高了蛋白质的消化性。另一方面,喷射蒸煮处理过程中产生的高温高剪切作用使蛋白质聚集体中的肽链进一步展开,部分极性基团转向表面,从而暴露出了更多蛋白酶结合位点,有利于蛋白质和酶结合,同样提高了蛋白质的消化性。CPC主要是以聚集态形式存在,结构致密,溶解性较低,消化性差;HT-CPC的制备过程中虽然存在柠檬酸脱酰胺作用,溶解度有了一定程度地提高,但并没有高温高剪切作用,蛋白酶的作用位点的暴露程度不如JC-CPC,故消化性不如JC-CPC。
2.7抗氧化活性
有研究[2,27]表明,利用碱性蛋白酶对玉米蛋白进行酶解后得到的酶解产物具有良好的生理活性,故本试验选取碱性蛋白酶在相同条件下酶解得到的酶解产物作为对照,比较其与JC-CPC消化产物的抗氧化性。

图4 喷射蒸煮处理玉米浓缩蛋白消化产物的抗氧化性Fig.4 Antioxidant activity of JC-CPC after in vitro digestion
通过图4a可以发现,随着酶解产物浓度质量的升高,其吸光值逐渐升高,且由JC-CPC的酶解产物的吸光值高于对照样的吸光值。吸光值越高,表示样品的还原能力越强,即抗氧化活性越好,这就说明JC-CPC消化产物的还原力大于碱性蛋白酶酶解产物的还原力(P<0.05);通过图4b可以发现,随着酶解产物浓度的升高,DPPH自由基清除率逐渐升高,当消化产物的浓度质量达到15 mg/mL时,DPPH自由基清除率达到91.21%±0.18%。DPPH自由基清除率越高,表明其抗氧化性越好[28-29]。不同浓度下,JC-CPC的消化产物与碱性蛋白酶酶解的产物的DPPH自由基清除率相似。综合上述试验结果可以说明:经过消化后JC-CPC消化产物具备了与碱性蛋白酶酶解产物相当的抗氧化活性,可以在人体胃肠道内被直接吸收利用。
3 结 论
相对于普通高温处理的玉米浓缩蛋白(heat treatment corn protein concentrates,HT-CPC)以及未经高温处理的玉米浓缩蛋白(corn protein concentrates,CPC),经过喷射蒸煮处理后的玉米浓缩蛋白(jet cooking corn protein concentrates,JC-CPC),其起泡性及泡沫稳定性得到显著地提高(P<0.05)。CPC、HT-CPC和JC-CPC随着pH值变化,溶解曲线均呈现典型的U型,等电点均在pH 值5.0~6.0之间,此时溶解性均较差,而在pH值>7.0和pH值<4.0时,JC-CPC的溶解性则明显高于CPC和HT-CPC(P<0.05)。体外模拟消化试验结果表明,JC-CPC的水解度(24.02%±0.49%)明显高于CPC和HT-CPC (P<0.05),其可溶性氮释放量(62.05%±0.75%)亦高于HT-CPC和JC-CPC(P<0.05)。另外,消化产物抗氧化活性结果表明,JC-CPC消化产物的还原力高于碱性蛋白酶制备的酶解产物(P<0.05),其DPPH自由清除率则与碱性蛋白酶制备的酶解产物相当(P>0.05)。这说明JC-CPC的消化产物同样具备了良好的抗氧化活性。综上结果表明,利用亚临界萃取、酶解和超滤工艺对玉米黄粉进行脱脂和脱淀粉处理,再通过喷射蒸煮结合柠檬酸进行脱酰胺处理后,玉米浓缩蛋白的功能性质得到了明显提高。更重要的是,玉米浓缩蛋白的消化性明显的改善,更易被人体消化吸收,并且消化产物具备良好的生理活性。但在今后的工作中需对前处理的超滤工艺进行进一步地研究,寻求更好的工业化路线。
[参考文献]
[1] 林松毅,王可,刘劲波. 电子束辐照技术提高玉米蛋白粉酶解效果[J]. 农业工程学报,2014,30(22):300-308. Lin Songyi, Wang Ke,Liu Jingbo. Improving effect of enzyme hydrolysis of corn gluten meal by assistant of electron beam irradiation[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2014, 30(22): 300-308. (in Chinese with English abstract)
[2] 隋玉杰,何慧,石燕玲,等. 玉米肽的醒酒活性体外试验及其醒酒机理研究[J]. 中国粮油学报,2008,23(5):54-58.Sui Yujie, He Hui, Shi Yanling, et al. A study on mechanism and tests in vitro for corn peptides facilitating alcohol metabolism[J]. Journal of the Chinese Cereals and Oils Association, 2008, 23(5): 54-58. (in Chinese with English abstract)
[3] Ren X, Ma H, Mao S, et al. Effects of sweeping frequency ultrasound treatment on enzymatic preparations of ACE-inhibitory peptides from zein[J]. European Food Research and Technology, 2014, 238(3): 435-442.
[4] Kangkang Li, Shouwei Yin, Yechong Yin, et al. Preparation of water-soluble antimicrobial zein nanoparticles by a modified antisolvent approach and their characterization[J]. Journal of Food engineering. 2013, 119(2): 343-352.
[5] Chaoying Qiu, Weizheng, Sun Chuncui, et al. Effect of citric acid deamidation on in vitro digestibility and antioxidant properties of wheat gluten[J]. Food Chemistry, 2013, 141(3): 2772-2778.
[6] Suda ASakurai H, Kumagai H, Arai S, et al. Improvement of digestibility, reduction in allergenicity, and induction of oral tolrance of wheat gliadin[J]. Bioscience, Biotechnology and Biochemistry, 2007, 71(4): 977-985.
[7] Zhongqing Jiang, Tuula Sontag Strohm, Hannu Salovaara. Oat protein solubility and emulsion properties improved by enzymatic deamidation[J]. Journal of Cereal Science, 2015, 64(6): 126-132.
[8] Liao L, Liu T X, Zhao M M, et al. Functional, nutritional and conformational changes from deamidation of wheat gluten with succinic acid and citric acid[J]. Food Chemistry, 2010, 123(1): 123-130.
[9] Ning Xia, Jinmei Wang, Xiaoquan Yang, et al.Preparation and characterization of protein from heat-stabilized rice bran using hydrothermal cooking combined with amylase pre-treatment[J]. Journal of Food Engineering, 2012, 110(1): 95-101.
[10] Fantaa G F, Kenarb J A, Byarsb J A, et al. Properties of aqueous dispersions of amylase-sodium palmitate complexes prepared by steam jet cooking[J]. Carbohydrate Polymers, 2010, 81(3): 645-651.
[11] Jinmei Wang, Xiaoquan Yang, Shouwei Yin. Structural rearrangement of ethanol-denatured soy proteins by high hydrostatic pressure treatment[J]. Journal of Agriculture and Food Chemistry, 2011, 59(13): 7324-7332.
[12] Edgar Uquiche, Natalia Cirano, Sonia Millao. Supercritical fluid extraction of essential oil from Leptocarpha rivularis using CO2[J]. Journal of Chemical Education. 2015, 77(23): 307-314.
[13] 盛国华. 亚临界水技术在有效提取食品副产物中的应用[J].中国食品添加剂,2009(2):127-129. Sheng Guohua. Application of Subcritical water technology in the effective extraction food by-products[J]. China food Additives, 2009(2): 127-129. (in Chinese with English abstract)
[14] Rao L, Hayat K, Lü Y, et al. Effect of ultrafiltration and fining adsorbents on the clarification of green tea[J]. Journal of Food Engineering, 2011, 102(4): 321-326.
[15] Evans P J, Bird M R. The role of black tea feed conditions upon ultrafiltration performance during membrane fouling and cleaning[J].Journal of Food Process Engineering, 2010, 33(2): 309-332.
[16] GB/T5009.5-1985,微量凯氏定氮法[S].
[17] GB/T5009.7-2008,3,5-二硝基水杨酸法[S].
[18] GB/T5009.6-2003,索氏抽提法[S].
[19] Flores I, Cabra V, Quirasco M C, et al. Emulsifying Properties of chemically deamidated corn (Zea Mays) gluten meal[J]. Food science and technology international, 2010, 16(3): 241-250.
[20] Wang Jinmei, Yang Xiaoquan, Yin Shouwei, et al. Growth kinetics of amyloid-like fibrils derived from individual subunits of soy β-conglycinin[J]. Journal of Agricultural and Food Chemistry, 2011, 59(20): 11270-11277.
[21] Nunes A, Correia I, Barros A, et al. Sequential in vitro pepsin digestion of uncooked and cooked sorghum and maize samples[J]. Journal of Agricultural and Food Chemistry, 2004, 52(7): 2052-2058.
[22] Sun Jin Hur, Beong Ou Lim, Eric A Decker, et al. In vitro human digestion models for food applications[J]. Food Chemistry, 2011, 121(1): 1-12.
[23] Shi Jun Gea, Hong Bai, Hong-Shen Yuan, et al. Continuous production of high degree casein hydrolysates by immobilized proteases in column reactor[J]. Journal of Biotechnology, 1996, 50(2/3): 161-170.
[24] Walter J Wolf, Mardell L Schaer, Tomas P Abbott. Nonprotein nitrogen content of defatted jojoba meals[J]. Journal of the Science of Food and Agriculture, 1994, 65(3): 277-288.
[25] 刘丽红,雷清华. 茚三酮比色法与甲醛滴定法测定棉籽粕蛋白水解度的比较[J]. 化学工程与装备,2012(11):160-163. Liu Lihong, Lei QingHua. Ninhydrin colorimetry and formaldehyde titration method to determine the comparison of cottonseed meal protein hydrolysis[J]. Chemical Engineering and Equipment, 2012(11): 160-163. (in Chinese with English abstract)
[26] 夏宁. 喷射蒸煮制备米糠、碎米蛋白及其功能性研究[D].广州:华南理工大学,2012. Xia Ning. Preparation and function of protein from rice bran and broken rice using hydrothermal cooking[D]. Guangzhou: South China University of Technology, 2012. (in Chinese with English abstract)
[27] 陈楠楠,任娇艳,赵谋民. 琥珀酸脱酰胺对小麦面筋蛋白抗氧化性的影响[J]. 食品工业科技,2011,33(11):49-52. Chen Nannan, Ren Jiaoyan, Zhao Moumin. Effect of deamidation with succinic acid on the antioxidant of enzymatic hydrolysates of wheat gluten[J]. Food Tecnology, 2012, 33(11): 49-52. (in Chinese with English abstract)
[28] Shahidi F, Liyana-Pathirana C M, Wall D S. Antioxidant activity of white and black sesame seeds and their hull fractions[J]. Food Chemistry, 2006, 99(3): 478-483.
[29] Klompong V, Benjakul S, Kantachote D, et al. Anti-oxidative activity and functional properties of protein hydrolysate of yellow stripe trevally (Selaroides leptolepis) as influenced by the degree of hydrolysis and enzyme type[J]. Food Chemistry, 2007, 102(4): 1317-1327.
Application of jet-cooking in preparation of digestible corn protein concentrates
Wang Chaoyue, Wang Yonghui, Yang Xiaoquan※, Wang Jinmei, Guo Jian
(Protein Research and Development Center, College of Light Industry and Food Sciences, South China University of Technology, Guangzhou 510640, China)
Abstract:Corn protein concentrates (CPC) were prepared continuously from corn gluten meal (CGM). Firstly, sub-critical fluid and α-amylase were used to remove crude fat and degrade starch. Then, the resultant protein suspension was concentrated and separated by ultra-filtration membrane. The ultra-filtration membrane process was used to remove the impurities produced by the first process such as soluble carbohydrate. The concentrated protein suspension was incubated with 0.2 M citric acid and treated by jet cooking device at 140℃ for 90 s. Finally, 3 samples could be acquired by spray-drying process. In order to study the effect of jet cooking on the functional properties of CPC, solubility profile, deamidation degree, and amino acid composition were investigated. Moreover, the digestibility in vitro and the antioxidant activity of digestive product were investigated. We expected to provide an effective and continuous process technology for the application of CGM, and prepared a kind of CGM which exhibited excellent functional properties and digestibility in vitro. The results showed that protein content of CGM was improved after the removing of crude fat and starch. However, there was no difference among CPC, JC-CPC (jet cooking CPC) and HT-CPC (heat treatment CPC) in the amino acid composition, protein content and recovery rate (P>0.05). The results of solubility suggested that CPC, HT-CPC and JC-CPC exhibited a typical U-shaped solubility curve, with the minimum at the pH value of 5.0-6.0 and gradually increasing at the pH value below 4.0 and above 7.0. When the pH value was below 4.0 and above 7.0, the solubility of JC-CPC was superior to CPC and HT-CPC. These results may be ascribed to the effect of deamidation that led to translate insoluble amino acid (Asn or Gln) to soluble amino acid (Asp or Glu), and the high temperature and high shear force during the treatment of jet cooking process which made the protein unfold and disaggregate. And owing to the effect of high temperature and high shear force during the jet cooking process, the foaming capacity and the foaming stability of JC-CPC were improved significantly (P<0.05) compared to CPC and HT-CPC. In the process of digestion in vitro, the nitrogen release of 3 samples increased rapidly at the beginning, and then gradually slowed down. After digestion, the nitrogen release of JC-CPC cloud reached up to 62.05%±0.75%, higher than the CPC (21.02%±0.19%) and HT-CPC (40.25%±0.72%) (P<0.05), and the degree of hydrolysis cloud reached up to 24.02%±0.49%, higher than the CPC (9.23%±0.45%) and HT-CPC (14.52%±1.26%) (P<0.05). These results were mainly due to the improvement of protein’s solubility and the protein unfolding which may expose more protease binding sites and hence led to enzymatic hydrolysis more efficient during the jet cooking process. In addition, the reducing capacity of digestive product of JC-CPC was better than that treated by alcalase alkaline protease (P<0.05), while the 1,1-Diphenyl-2-picrylhydrazyl (DPPH) inhibition of JC-CPC after pepsin and trypsin treatment was similar to that treated by alcalase alkaline protease. We can draw a conclusion that the product of JC-CPC after digestion in vitro possesses good antioxidant activity and physiological activity which may be beneficial to human beings, as well as the product treated by alcalase alkaline protease. It also means that the digestive product of JC-CPC cloud can be directly absorbed by human beings in the gastrointestinal tract. JC-CPC exhibits excellent functional properties, and digestibility property in vitro is attributed to the effect of jet cooking. The outcomes of the above research may prove a valid way to the application of CGM in further processing of plant proteins.
Keywords:protein; enzymes; solubility; jet cooking; deamidation; digestion; antioxidant activity
通信作者:※杨晓泉,男,教授,博士生导师,从事粮食、油脂与植物蛋白工程研究工作,华南理工大学植物蛋白中心主任。广州华南理工大学轻工与食品学院食物蛋白工程研究中心,510640。Email:fexqyang@scut.edu.cn
作者简介:王超跃,男,从事粮食、油脂与植物蛋白工程研究工作。广州华南理工大学轻工与食品学院食物蛋白工程研究中心,510640。
基金项目:公益性行业科技(201303071-05);广东省教育厅产学研基地滚动项目(2013CXZDC003);国家高新技术研究发展计划(863 计划)项目(2013AA102208-3)。
收稿日期:2015-08-23
修订日期:2015-11-10
中图分类号:TS201.1
文献标志码:A
文章编号:1002-6819(2016)-03-0301-08
doi:10.11975/j.issn.1002-6819.2016.03.043

