基于不同根系分布形式的盐渍化农田向日葵根系吸水模拟
马 韬,李 琦,杨丽清,曾文治,伍靖伟,黄介生(.武汉大学水资源与水电工程科学国家重点实验室,武汉 43007;.内蒙古河套灌区义长灌域管理局,内蒙古 五原 0500)
土壤盐渍化是干旱半干旱地区普遍存在的环境问题,威胁着这类地区的农业发展和粮食安全[1]。我国盐渍土总面积高达3 600万hm2,占全国可利用土地面积的4.88%[2],广泛分布在我国华北、西北等主要粮食产区。其中,河套灌区的土壤盐渍化问题尤为严重,约有65%的实有耕地已经演化成盐渍化土壤,制约着当地农业经济的发展。
根系是作物对土壤盐渍化危害最敏感的器官[3]。当根系遭受土壤环境中的盐分胁迫时,通常以改变根系形态和分布的方式来适应胁迫[4,5]。根系分布的改变会在时间和空间上影响根系对水分和养分的吸收过程,并最终影响作物产量[6]。当前,对作物根系分布的研究大多集中于水稻[7]、小麦[8]、玉米[9]、棉花[10]等作物,还没有学者针对向日葵这一河套灌区种植面积最大的经济作物建立根系分布函数。此外,已有的对根系分布的研究大都是基于根长密度得到的分布函数,还没有针对根系吸收面积这一与根系水分吸收速率紧密相关的指标[11]提出的分布函数。
本文参考Wu等建立归一化根系分布函数的方法[12],利用土柱试验实测数据,分别建立了轻度和中度2种盐分胁迫情况下基于向日葵根系总吸收面积和根长密度的2种分布函数。并且,运用HYDRUS-1D软件,将其应用于微区试验的根系吸水计算中,通过比较不同时刻土壤含水率的模拟效果来评价这2种根系分布函数的适用情况。
1 材料和方法
1.1 研究区概况
本实验于2014年6-9月在内蒙古河套灌区义长试验站永联基地进行[图1(a)]。河套灌区地处北纬40°19′~41°18′,东经106°20′~109°19′,年降水量为139~222 mm,且集中在6-8月,年蒸发量为2 200~2 400 mm,蒸降比在10以上。强烈的蒸发使得土壤水及地下水不断地向上运移,最终导致土壤水分蒸发后所携带的盐分在土壤表层聚集,从而造成了河套灌区严重的土壤盐渍化问题。
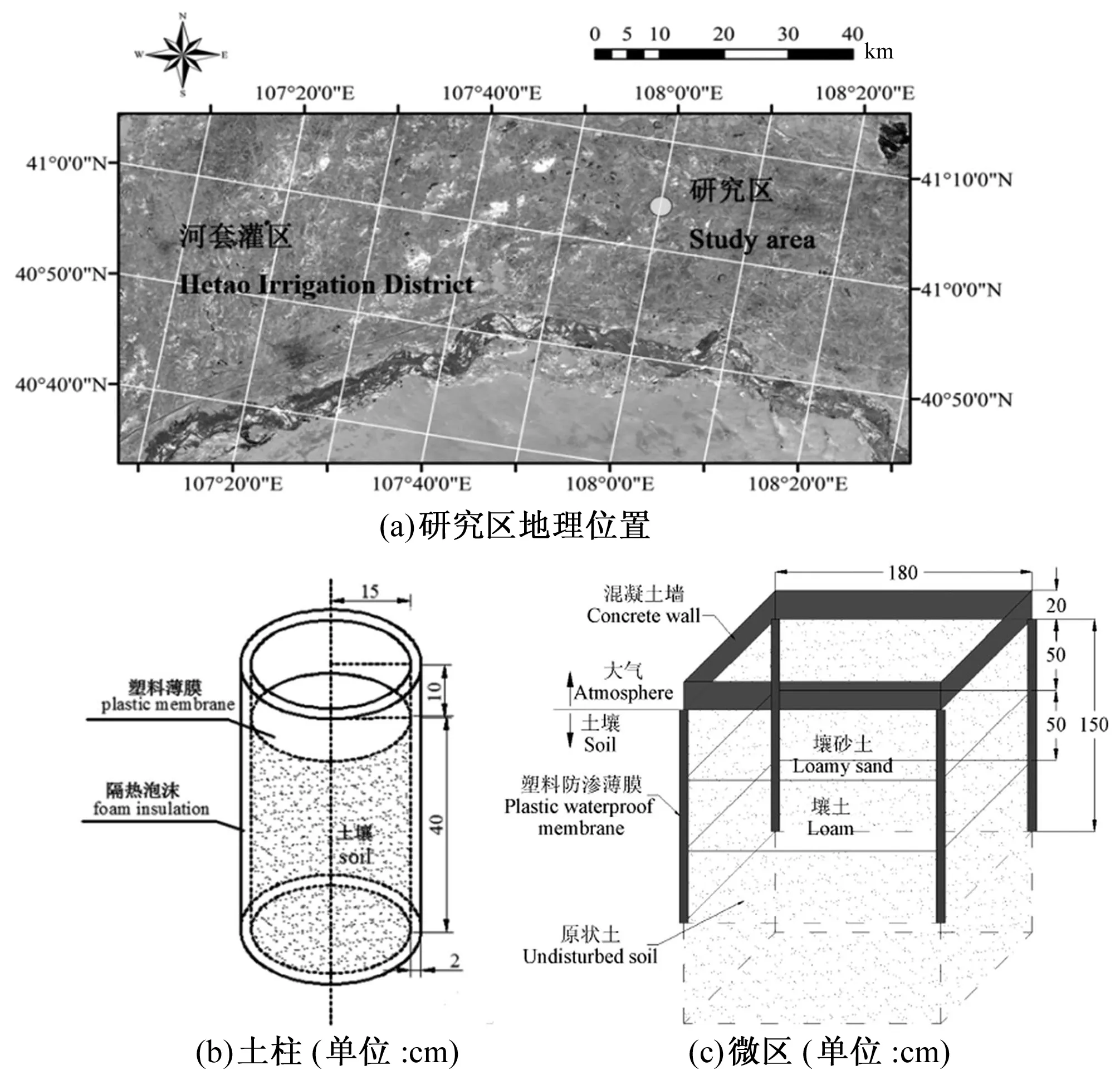
图1 研究区地理位置及土柱和微区试验示意图Fig.1 Location of study site and schematic diagram of experiment bucket
1.2 试验材料与设计
试验分为精细观测的土柱种植试验以及模拟大田情况的微区种植试验。土柱试验在高50 cm、内径30 cm的铁皮桶中进行,桶壁厚度4mm,外包2 cm厚的泡沫保温层[图1(b)]。土柱所装填土壤均为取自附近农田的粉壤土,填土高度40 cm,填土密度1.3 g/cm3。该试验的研究因素为土壤盐分含量(S)、灌溉量(W)和施氮量(N)3种,采用三因素随机区组设计,每个研究因素设置2个水平,共设置24个土柱。李琦等对该试验的分析显示[13],施氮量对反映向日葵根系吸水特性的各项指标的影响均不显著,故本文的研究中将忽略施氮量处理间的差异。为避免水分胁迫的影响,本文挑选出其中12个充分灌溉处理的土柱,只考虑其盐分处理的差异。将这些土柱分为轻度盐分胁迫处理S0(0.10%~0.25%)和中度盐分胁迫处理S1(0.30%~0.45%)2个水平,其中盐分以干土的百分含盐量计,每个水平有6个重复。该试验各研究因素的控制方法、根系指标的获取方法及田间管理措施均可参考李琦等[13]的介绍。
微区试验在边长为1.8 m的正方形观测微区中进行[图1(c)],四周距离地表0~1.5 m深度范围内均用不透水塑料膜包裹,以防止水分的侧向流动,底部可与地下水连通,内填原状土壤。本试验在4个微区中进行,仅设置2个不同的盐分处理,且盐分处理水平与土柱试验保持一致,将播种前0~20 cm土壤含盐量控制为S0(0.10%~0.25%)和S1(0.30%~0.45%)2个水平,每个水平两个重复。其中,1号和2号微区为S0处理,3号和4号微区为S1处理。在生育期保证微区内向日葵不受水分胁迫,且根据曾文治等[14]提出的当地最优施氮量(135 kg/hm2)施加氮肥。
试验微区和土柱于2014年6月5日同时播种品种为LD5009的食用向日葵,并于2014年9月17日-9月26日间收获,两者的种植方式和田间管理措施均保持一致。
1.3 根系吸水模型及根系分布函数
本文对根系吸水的计算采用Feddes模型[15]:
S(z,t)=α(h,z)β(z)Tp
(1)
式中:z为土壤深度,cm;S(z,t)为t时刻z深度处的根系吸水速率,d-1;α(h,z)为水盐联合胁迫反应函数,无量纲;Tp为作物潜在蒸腾速率,cm/d;β(z)为标准化的根系吸水分布函数,无量纲,可以表示为:
(2)
式中:Lrd(z)是相对根长密度分布函数;Lr是最大根深。
随着根系的生长,在每个生育时段均不同,不利于统一计算,因此Wu[12]在前人的基础上,提出了归一化根长密度分布的概念,将根系深度转化为0到1范围内的标准化根深,可以用式(3)综合考虑全生育期不同时刻的根长密度分布:
(4)
式中:Lnrd(zr)就是Wu提出的归一化根长密度分布函数;zr是标准化根系深度,范围为0~1。
1.4 HYDRUS-1D模型的构建
HYDRUS-1D是由美国盐土实验室开发的软件,用于计算和模拟饱和-非饱和带的一维溶质运移和水分运动。
(1)边界条件和土壤剖面设置。土壤水分运动上边界为变化的大气边界,输入由气象数据计算得到的每日变化的潜在蒸发量和蒸腾量;下边界为变水头边界,输入由监测的地下水位得到的变化的水头数值;溶质运移的上下边界均为零通量边界。模拟深度为地表以下250 cm,将土层分成5层,分别为0~10、10~20、20~30、30~40以及40~250 cm。
(2)模型参数。由实测微区土壤粒径,利用HYDRUS-1D模型自带Rosetta程序计算得到5个van Genuchten模型中的土壤水力参数。Feddes根系吸水模型中水盐胁迫因子的参数取值,结合Zuo[8]和Ning[10]的研究结果进行适当调整后,确定如下:水分胁迫参数p0=-15 cm,p0pt=-25 cm,p2h=-600 cm,p2l=-1 000 cm,p3=-16 000 cm;盐分胁迫分段函数斜率为5.2,阈值为7.7。
(3)初始输入数据和模拟时段。以播种前取样获得的实测土壤含水率和盐分含量作为初始输入数据,运行HYDRUS-1D模型。模型模拟运算时间单位为d,时间步长采用变化步长,最大步长为5 d,最小步长为10~5 d,模拟时段为全生育期(播种后第1~107 d)。
1.5 模型评价指标
采用决定系数(R2)、均方根误差(RMSE)、纳什系数(NSE) 3种指标对模型的模拟效果进行评价:
(7)

均方根误差(RMSE)用来衡量模拟值同真值之间的偏差,结果越接近0,表示同真值的差异越小;纳什系数(NSE)可用来衡量模型的模拟质量,NSE越接近1,表示模型模拟质量越好,可信度越高;决定系数(R2)可用来衡量相关密切程度,R2越接近1相关性越好。
2 结果与分析
2.1 两种向日葵根长密度分布函数的建立
本文参照Wu[12]建立归一化根长密度分布函数的方法,在土柱试验所得根系指标中挑选出根长密度(RLD)和根系总吸收面积(RAA)这2个指标,并基于这两种指标建立不同盐分处理下的归一化根系分布函数,结果见表1及图2、图3。

表1 不同盐分处理下根长密度和根系总吸收面积的分布函数Tab.1 Root length density(RLD)and root absorption area(RAA)distribution function under different saline conditions

图2 不同盐分条件下根长密度分布函数Fig.2 Root length density(RLD)distribution function under different saline conditions
2种根系分布函数采用2种不同的函数形式,RLD分布函数运用指数函数拟合,RAA分布函数运用多项式函数拟合。表1中的结果显示,各形式的分布函数均能取得较好的拟合效果,除S0处理下的RAA分布函数外,相关系数均大于0.9。
2.2 基于4种不同根系分布函数的根系吸水模拟评价
Zuo[8]和Ning[10]参照Wu建立归一化根系分布函数的思想,基于大量的实测数据分别建立了小麦和棉花的根长密度分布函数:
Zuo函数:Lnrd(zr)=3.85(1-zr)2.85
(8)
Ning函数:Lnrd(zr)=1.96(1-zr)0.96
(9)
这2种根系分布函数形式简单,对于小麦和棉花有着较强的适用性,但是否适用其他作物还有待研究。因此,本文将以上提到的4种根系分布函数(RLD函数、RAA函数、Zuo函数和Ning函数)分布输入到HYDRUS-1D软件中,运用其模拟4个微区试验中向日葵全生育期内的土壤含水率变化。将模拟得到的播种后第20、66和107 d土壤剖面上5、15、25、35、50和90 cm深度处的土壤体积含水率和实测值进行比较(见图4),通过计算1.5节中介绍的各项统计指标(见表2),对不同根系分布函数应用于土壤水分运动模型后的模拟效果进行评价。

图3 不同盐分条件下根系总吸收面积分布函数Fig.3 Root absorption area(RAA)distribution function under different saline conditions

图4 应用不同根系分布函数计算得到各微区土壤含水率的模拟值与实测值比较Fig.4 Comparison between simulated and observed soil water content based on different root distribution functions
由图4可以发现,S0处理下(1号和2号微区),与Zuo函数、Ning函数相比,应用RAA函数和RLD函数模拟得到的土壤含水率与实测值更加接近,能够更好地集中在1∶1线附近。而对于S1处理的微区(3号和4号微区),应用这4种分布函数模拟得到的结果差异较小。

表2 应用不同根系分布函数模拟土壤含水率结果统计指标分析Tab.2 Analysis of simulated results using statistics index(RMSE, NSE and R2)
注:括号中的百分比表示应用相应函数模拟所得结果的统计指标相比于应用RAA函数所得指标的增加或下降程度。
表2的结果显示,在4个微区中,应用RAA函数的RMSE值均为最小。其中,在S0处理的微区中,应用Zuo函数和Ning函数得到的RMSE均远大于RAA函数。对于纳什系数(NSE),在4个微区中,应用Zuo函数和Ning函数模拟所得结果的NSE最小,模拟质量最差;应用RLD函数模拟所得结果的NSE明显优于前两者,但仍小于RAA函数。同样,对于决定系数(R2),应用RAA函数得到的R2均为4种分布函数中最大的。因此,与3种基于根长密度建立的分布函数相比,基于根系总吸收面积建立的RAA函数在应用于HYDRUS-1D的土壤水分运动模拟时能够取得更好的模拟效果,尤其在受轻度盐分胁迫的情况下,模拟结果的准确性明显优于其他3种分布函数。
2.3 应用RAA函数的根系吸水量计算
以上分析显示,RAA函数能更好地模拟河套灌区盐渍化农田中根系的吸水规律,因此本节继续运用RAA函数及HYDRUS-1D模型,计算每日根系吸水速率和逐日累积根系吸水量,通过模拟的结果探讨盐分对根系吸水的影响。
将RAA函数输入HYDRUS-1D模型计算得到全部4个微区全生育期内每日的根系吸水速率如图5所示。从图5中可以看出,各处理在时间上变化趋势一致,在苗期根系吸水速率较小,进入蕾期后根系吸水速率迅速增大,至花期吸水速率达到最大,为根系吸水的鼎盛时期。在进入成熟期后,吸水速率逐渐减少。在整个生育期中,S1处理微区(3号和4号微区)的吸水速率均小于S0处理的微区(1号和2号微区)。以1号和3号微区为例,在苗期,3号微区(S1)的平均日吸水速率与1号微区(S0)相比减少37.26%,在蕾期时这个数值增加至69.29%,在花期时减小为54.41%,在成熟期进一步减小至36.04%。将2号和4号微区进行对比也可反映出相似的规律。这说明,受中度盐分胁迫根系的耐盐性在苗期和蕾期时较弱,其中蕾期时盐分对根系吸水的抑制作用最为明显。在进入花期之后,根系的耐盐性逐渐增强,且根系吸水速率的逐渐减小,盐分的抑制作用逐渐减弱。

图5 不同盐分情况下向日葵逐日根系吸水速率Fig.5 Daily sunflower root water uptake rate under different saline conditions
3 结 论
(1)本文针对轻度和中度盐分胁迫条件下的向日葵根系分布,基于土柱实验结果,分别提出了基于根长密度和根系总吸收面积2种指标的分布函数(RLD函数和RAA函数),实验结果显示该两种模型能够较好地反映相应盐分条件下向日葵根系在一维土壤剖面上的分布。
(2)将RAA函数应用于HYDRUS-1D软件后,模拟结果显示其对轻度和中度盐分胁迫条件下根系吸水和土壤水分运动的模拟精度优于其他3种基于根长密度的分布函数,特别是在轻度盐分胁迫条件下,模拟精度提升明显。
(3)通过HYDRUS-1D软件计算得到逐日根系吸水量,反映出在向日葵全生育期内盐分胁迫对根系吸水始终具有抑制作用,且这种抑制作用在蕾期最为明显,在进入花期后随着根系耐盐性的提升而逐渐减弱。
[1] Paul D, Lade H. Plant-growth-promoting rhizobacteria to improve crop growth in saline soils: a review[J]. Agron Sustain Dev, 2014,34(4):737-52.
[2] 王佳丽, 黄贤金, 钟太洋, 等. 盐碱地可持续利用研究综述[J]. 地理学报, 2011,66(5):673-684.
[3] Wang Y N, Li K X, Li X. Auxin redistribution modulates plastic development of root system architecture under salt stress in Arabidopsis thaliana[J]. Journal of Plant Physiology, 2009,166(15):1 637-1 645.
[4] Gregory P. Root growth of chickpea, faba bean, lentil, and pea and effects of water and salt stresses[C]∥ World crops: Cool season food legumes. Springer, 1988:857-867.
[5] Galvan-ampudia C S, Testerink C. Salt stress signals shape the plant root[J]. Current opinion in plant biology, 2011,14(3):296-302.
[6] 王法宏, 王旭清, 刘素英,等. 根系分布与作物产量的关系研究进展[J]. 山东农业科学, 1997,(4):47-50.
[7] 吴伟明, 宋祥甫, 孙宗修,等. 不同类型水稻的根系分布特征比较[J]. 中国水稻科学, 2001,(4):37-41.
[8] Zuo Q, Zhang R, Shi J. Characterization of the root length density distribution of wheat using a generalized function[C]∥ Timlin D, Ahuja L R. Enhancing Understanding and Quantification of Soil-Root Growth Interactions. American Society of Agronomy Publisher, 2013:93-117.
[9] 齐文增, 刘惠惠, 李 耕,等. 超高产夏玉米根系时空分布特性[J]. 植物营养与肥料学报, 2012,18(1):69-76.
[10] Ning S, Shi J, Zuo Q, et al. Generalization of the root length density distribution of cotton under film mulched drip irrigation[J]. Field Crops Research, 2015,177:125-136.
[11] 刘彬彬. 水分胁迫对玉米幼苗形态建成、生理代谢及根系吸水的影响[D]. 陕西杨凌:中国科学院研究生院(教育部水土保持与生态环境研究中心), 2008.
[12] Wu J Q, Zhang R D, Gui S X. Modeling soil water movement with water uptake by roots[J]. Plant and Soil, 1999,215(1):7-17.
[13] 李 琦, 马 韬, 曾文治,等. 水、盐和施氮量交互作用对向日葵水分利用的影响[J]. 中国农村水利水电, 2016,(3):27-30.
[14] 曾文治, 徐 驰, 黄介生,等. 土壤盐分与施氮量交互作用对葵花生长的影响[J]. 农业工程学报, 2014,30(3):86-94.
[15] Feddes R A, Kowalik P J, Zaradny H X. Simulation of field water use and crop yield[M]. Centre for Agricultural Publishing and Documentation, 1978.

