EDTA络合回收模拟含锰废水中锰的研究
张贞发 杨斌 吴鑫 李发林

【摘 要】为了回收模拟含锰废水中的锰元素,以EDTA二钠盐为络合剂,采用原子吸收分光光度法(AAS)检测废水中的锰含量。当溶液的pH值为12.0左右呈现出碱性,EDTA用量达到废水量的0.9‰,搅拌10min后,EDTA对锰元素的回收率达到78.0%。
【关键词】EDTA;回收;锰
【Abstract】EDTA was used as a chelating agent To recycle the manganese in the wastewater. The manganese content was detected by Atomic Absorption Spectroscopy(AAS). When EDTA dosage is 0.9 ‰,the recovery of manganese is 78.0% after stirring 10min.
【Key words】EDTA; Recycle; Manganese
在锰矿的开采和深加工过程中,由于设备和技术等各方面的影响,造成含锰废料和含锰废水中含有大量的锰,污染较为严重[1]。工厂中的含锰废水和含锰废渣往往会集中堆放在工厂内,既占用了大量场地,又容易遇到雨水冲刷等原因而伴随地表径流进入江河湖泊,造成重金属元素的污染[2]。过量的锰元素进入人体内会引起中毒,对人的神经系统、生殖系统、肝脏、肺和心血管有危害,甚至引起急性锰中毒[3]和慢性锰中毒,表现出轻度精神障碍和自主神经功能紊乱,甚至造成锥体外系损害,还可能会伴随精神症状[4]。因此,控制排放的工业废水中的锰含量,回收废水中含的锰元素,有利于环境保护和人类健康。回收含锰废水中锰的方法主要有离子交换法、化学沉淀法、微生物法等[5-7]。在含锰废水中加入常用的EDTA(乙二胺四乙酸二钠)络合剂,与锰离子发生络合反应,有效降低水中锰含量,并且成本相抵比较低。
1 材料与方法
1.1 材料与仪器
模拟含锰废水(自制,锰含量为50mg·L-1),乙二胺四乙酸二钠(分析纯),硝酸(分析纯),氢氧化钠(分析纯),去离子水(自制)。
TAS-990型原子吸收分光光度计(北京普析通用仪器有限公司),79-1型磁力搅拌器(江苏金坛医疗仪器厂),PHS-3C型实验室pH计(上海今迈仪器仪表有限公司),其他常用玻璃仪器。
1.2 方法
1.2.1 实验过程
用移液管移取模拟含锰废水样品25mL,置于50 mL小烧杯中,滴加氢氧化钠溶液调节到所需要的pH值,加入设计量的乙二胺四乙酸二钠盐,放在磁力搅拌器上搅拌达到设计的时间后,过滤,用3 mL去离子水洗涤滤渣三次,将滤液转移到100mL容量瓶中,定容,检测锰含量,计算回收率。
1.2.2 检测条件和标准曲线
采用原子吸收分光光度法检测废水中的锰含量。灯电流:2.0mA,光谱带宽:0.2 nm,火焰类型:乙炔-空气火焰,乙炔流量:1700mL·min-1,检测波长:279.5nm。
配制锰元素标准使用液,浓度分别为0 mg·L-1、0.5 mg·L-1、1.0 mg·L-1、2.0 mg·L-1、3.0 mg·L-1、4.0 mg·L-1,装于聚乙烯瓶中低温储存备用。
1.2.3 方法
以回收率判断废水中锰元素的回收效果。
Vx为处理后水样的体积(L);Cx为处理后滤液定容后锰元素的浓度(mg·L-1),超过标准溶液浓度上限(4.0 mg·L-1)应稀释后重新检测;V0为处理前所取水样的体积(L);C0为处理前所取废水样中锰元素的浓度(mg·L-1)。
2 结果与分析
2.1 EDTA用量对回收率的影响
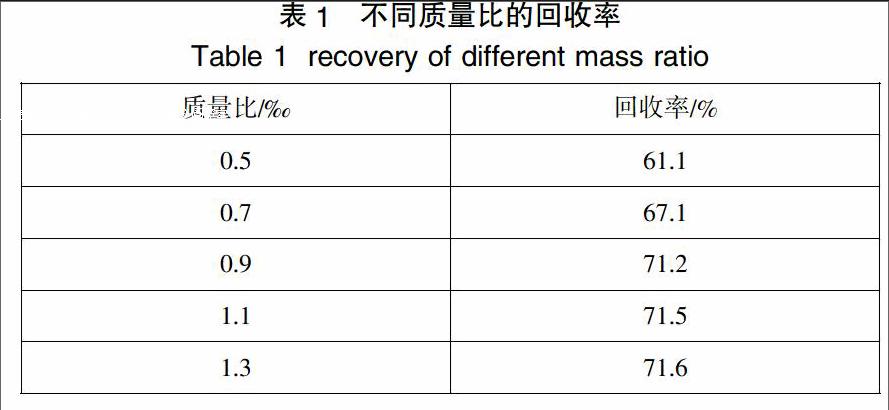
取含锰废水样品25mL,分别加入占废水质量0.5‰、0.7‰、0.9‰、1.1‰、1.3‰量的EDTA,此时溶液的pH值为2.0左右,搅拌30min后,抽滤,分别用3 mL去离子水洗涤滤渣三次,收集滤液,转移至100mL容量瓶中,定容,检测,计算回收率。结果如表1.
实验的结果表明,EDTA的用量对回收率有一定的影响。当EDTA的量增加时,回收率随着增加,当EDTA的用量增加到超过废水质量的0.9‰时,继续增加EDTA用量,回收率不会显著增加。说明EDTA的用量并不是越多越好,超过了0.9‰后,继续增大用量对回收率的增加影响不大,同时还会增加成本。
2.2 搅拌时间对回收率的影响
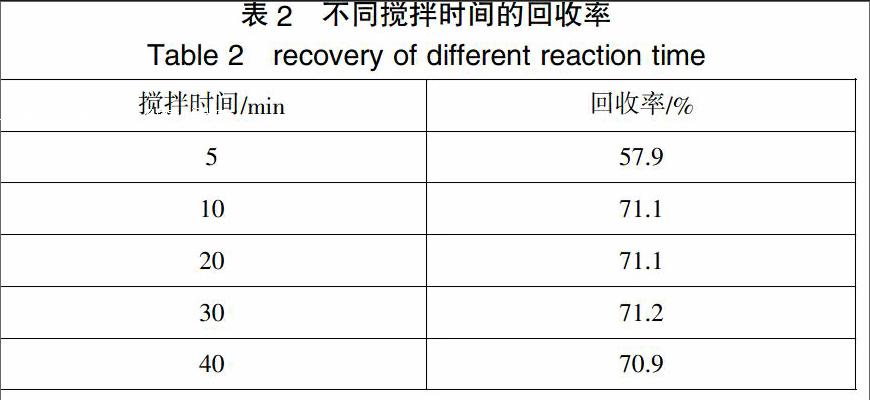
取含锰废水样品25mL,加入占废水质量0.9‰的量的乙二胺四乙酸二钠,此时溶液的pH值为2.0左右,分别搅拌10min、20min、30min、40min、50min后,过滤,用3 mL去离子水洗涤滤渣三次,收集滤液,转移至100mL容量瓶中,定容,检测,计算回收率。
结果表明,当搅拌时间为5分钟时,回收率达到57.9%,继续延长搅拌时间,当搅拌时间为10min时,回收率达到71.1%,再继续延长搅拌时间,回收率基本稳定。这可能是由于锰离子与EDTA发生的络合反应的反应速率较快,只要混合均匀,反应在短时间内基本达到平衡,延长时间并不能有效的提高锰元素的回收率。
2.3 pH值对回收率的影响
取含锰废水样品25mL,用氢氧化钠溶液调节至所需要的pH值分别为2.5,4.5,6.5,8.5,10.5,12.0,之后加入占废水质量0.9‰的乙二胺四乙酸二钠,分别搅拌10min后,过滤,用3mL去离子水洗涤滤渣三次,收集滤液,转移至100mL容量瓶中,定容,检测,计算回收率。
由表中可以看出,当溶液呈现出碱性时,回收率较高,当溶液呈现出酸性时,回收率较低。说明EDTA回收锰的络合反应适合在碱性条件下进行。可能是由于锰离子与EDTA形成的络合物在碱性条件下溶解度降低,成为含锰量比较高的固体状态的滤渣,滤渣被过滤后,从而降低滤液中的锰含量,达到较好的回收效果。当溶液pH值为12.0,回收率达到78.0%,但是滤液的pH值比较高,排放时需要进行中和处理。不然也会对环境造成危害污染水体及水中的生物。
3 结论
EDTA由于具有络合作用,可以和锰离子发生络合反应回收废水中的锰,在不同的pH值情况下,络合物的溶解性能和稳定常数有所不同。当pH比较大时,溶解度较低,通过过滤出去含锰量较高的络合物固体滤渣,可有效降低废水中的锰含量。EDTA与废水中的锰离子发生络合反应的速度快,所需时间短。废水的pH值对锰的回收率有较大影响。当溶液pH值为12.0,EDTA用量超过废水量的0.9‰,充分搅拌10min后,对锰的回收率达到78.0%。
【参考文献】
[1]孟君.含锰废水控制与治理研究进展[J].安徽农业科学,2008,36(32):14273-14274.
[2]任伯帜,刘斌全,郑谐,周义.锰矿区土-水界面污染流中重金属来源分析[J].环境污染与防治,2014,36(12):6-10.
[3]荆俊杰,谢吉民.微量元素锰污染对人体的危害[J].广东微量元素科学,2008,15(2):6-9.
[4]张瑞丹,檀国军,郭力,等.慢性锰中毒致神经系统受损4例临床分析[J].中国神经精神疾病杂志,2014,40(11):662-665.
[5]冒爱荣,钱晓荣,陈亮,等.阳离子淀粉对含锰(Ⅶ)废水的絮凝性能研究[J].安徽农业科学,2011,39(12):7430-7431.
[6]房苜茹,明宪权,陆孟华,等.锰矿浸渣中水溶性锰的回收[J].化工环保,2014,34(06):543-547.
[7]李振飞.从某废渣中回收锰的探索性试验研究[J].中国锰业,2014,32(03):17-19.
[责任编辑:杨玉洁]

