高密度CO2对凡纳滨对虾肌球蛋白疏水性的影响
郭明慧,邓倩琳,刘书成,邓楚津,吉宏武,李承勇,高 静(广东海洋大学食品科技学院//广东省水产品加工与安全重点实验室//广东普通高等学校水产品深加工重点实验室,广东 湛江 524088)
高密度CO2对凡纳滨对虾肌球蛋白疏水性的影响
郭明慧,邓倩琳,刘书成,邓楚津,吉宏武,李承勇,高静
(广东海洋大学食品科技学院//广东省水产品加工与安全重点实验室//广东普通高等学校水产品深加工重点实验室,广东湛江 524088)
摘要:为揭示高密度 CO2(Dense Phase Carbon Dioxide,DPCD)诱导肌球蛋白形成凝胶的机制,利用ANS探针法和荧光法,分别测定在压力5~30 MPa、温度50~70 ℃、时间10~50 min等不同处理条件下肌球蛋白表面疏水性和酪氨酸内源荧光值,探讨DPCD对凡纳滨对虾肌球蛋白高级结构的影响。研究表明:与未处理的肌球蛋白相比,DPCD处理能使肌球蛋白的表面疏水性和酪氨酸内源荧光值显著增加(P<0.05);在相同温度下,DPCD处理的肌球蛋白的表面疏水性和酪氨酸内源荧光值显著高于水浴热处理的(P<0.05);DPCD处理压力、温度升高以及时间延长,均能使肌球蛋白的表面疏水性和酪氨酸内源荧光值显著增加(P<0.05)。DPCD能够诱导肌球蛋白疏水基团暴露,使紧密的高级结构发生松散。
关键词:高密度CO2;肌球蛋白;表面疏水性;酪氨酸
虾糜制品(虾肉丸和虾肉肠)是虾类高附加值产品之一。虾糜制品是利用虾肉中蛋白质发生变性和聚集而形成的凝胶类制品。肌球蛋白不仅是虾肉中含量最高的蛋白,而且是形成具有三维网络弹性凝胶的主要蛋白,对虾糜制品的品质(弹性、多汁性、口感等)具有重要影响[1-3]。在蛋白质形成凝胶过程中,蛋白质暴露的疏水基团越多,疏水性越强,蛋白质就越易发生聚集[4];另外,蛋白质的疏水性也是影响分子间相互作用的主要因素[5]。因此,测定蛋白质疏水性的变化可以初步反映蛋白质发生变性聚集的可能性。高密度CO2(dense phase carbon dioxide,DPCD)处理是一种非热加工技术,它能够在灭菌保证食品安全的同时,最小程度地影响食品原有风味和色泽等[6]。利用DPCD技术对食品进行杀菌钝酶的同时,也会诱导食品蛋白质发生一定程度的变性[7]。本课题组前期研究表明:DPCD能够诱导虾肉糜形成凝胶;与热诱导凝胶相比,DPCD诱导的凝胶具有较高的凝胶强度和更为致密的凝胶网络结构,并且保留了更多的水分和营养成分[8-9]。
本研究以凡纳滨对虾(Litopenaeus vannamei)肌球蛋白为研究对象,利用ANS探针法和荧光法分别测定肌球蛋白表面疏水性和酪氨酸内源荧光值在不同处理条件下(压力5~30 MPa、温度50~70 ℃、时间10~50 min)的变化,初步探讨DPCD对凡纳滨对虾肌球蛋白高级结构的影响,旨在为研究DPCD诱导虾肉糜形成凝胶的机制提供基础数据。
1 材料和方法
1.1材料
凡纳滨对虾(Litopenaeus vannamei),购于湛江东风水产批发市场,加氧保活运至实验室。用自来水清洗后,选取完整、大小均一个体,去头、壳、肠腺,待用。
1.2试剂与仪器
试剂:快速Lowry法蛋白含量测定试剂盒,购于上海荔达生物科技有限公司;8-苯氨基-1-萘磺酸(ANS),购于美国Sigma公司;5-三磷酸腺苷二钠盐(ATP)、二硫代苏糖醇(DTT)、牛血清蛋白标准购于广州市齐云生物技术有限公司;其他化学试剂均为分析纯。CO2气体纯度为99.9%,购于湛江氧气厂。
仪器与设备:HA221-50-10-C型超临界装置(南通市华安超临界萃取有限公司);UX2200H电子天平(日本岛津仪器有限公司);UV-2550紫外可见分光光度计(日本岛津);PHS-3C型精密pH计(上海雷磁仪器厂);CR22GⅡ型高速冷冻离心机(日本日立公司);HH-8数显恒温水浴箱(常州澳华仪器有限公司);RF-5301PC荧光分光光度计(日本岛津仪器有限公司);5417R冷冻离心机(德国Eppendorf公司)。
1.3试验方法
1.3.1肌球蛋白的提取参照Stafford等[10]的方法,将鲜活的凡纳滨虾对虾去头去尾去肠线,肌肉切碎后置于绞肉机中搅碎。称取一定量的虾肉,加入5倍20 mmol/L PBS缓冲液(pH 7.0),均质后离心(5 500 g,10 min),取沉淀再重复上述过程2次。向所得沉淀中加入2倍提取液(0.45 mol/L KCl,5 mmol/L ATP,7.5 mmol/L MgCl2,0.15 mmol/L DTT,pH 6.4)搅拌15 min后离心(10 000 g,10 min)。4层纱布过滤后,取滤液与9倍体积的预冷蒸馏水混合静置10 min,离心(6 000 g,10 min)得沉淀,加入1/5倍3 mol/L KCl-0.6 mmol/L DTT-0.12 mol/L Tri-Maleate缓冲液(pH 7.5),于4℃静置12 h,加入1/10倍0.11 mol/L ATP-55 mmol/L MgCl2-5.5 mmol/L EGTA溶液(pH 7.5)后,于4℃静置12 h,加硫酸铵饱和溶液,采用硫酸铵饱和度为40%~45%来分离纯化肌球蛋白。离心后取沉淀于0.6 mol/L KCl-0.1 mmol/L DTT-20 mmol/L PBS(pH 7.0)缓冲液中透析至无SO42-检出,期间更换透析液。取透析后的溶液于100 000 g转速下超速离心1 h后所得溶液即为肌球蛋白溶液。以上操作均在4℃条件下进行,所用缓冲液需先预冷至4℃。
1.3.2高密度CO2处理将质量浓度为1.0 mg/mL肌球蛋白溶液,分别取5 mL于10 mL试管中,瓶口覆盖一层透气性好的有机滤膜(防止蛋白质在处理过程中随二氧化碳气体流失)。间歇式DPCD处理基本流程参考文献[11],具体如下:实验开始时,首先打开制冷及冷却循环,设置处理釜所需温度,将样品放入处理釜中,密封,开启高压泵泵入CO2气体,待压力上升至所需压力,关闭高压泵,封闭处理釜进出口的阀门,维持处理釜内的压力和温度,静态处理一段时间后,卸压并取出样品,完成一次处理,再进行下一步分析。压力和温度的精确度分别是±0.4 MPa和±0.5 ℃。
设定DPCD处理的因素和水平。压力处理:固定温度60 ℃,时间30 min,设置压力水平为5、10、15、20、25、30 MPa;温度处理:固定时间30 min,压力15 MPa,设置温度水平为50、55、60、65、70 ℃;时间处理:固定温度60 ℃,压力15 MPa,设置时间水平为10、20、30、40、50 min。
1.3.3表面疏水性测定以8-苯胺基-1-萘磺酸铵(ANS)为荧光探针法[12]。根据已测得的蛋白含量,将可溶性蛋白在0.01~0.5 mg/mL范围内稀释成一定梯度。取各不同浓度溶液2 mL,加入20 µL 10 mmol/L ANS-20 mmol/L PB 缓冲液(pH 7.0),混匀,静置10 min后测其荧光强度。采用Gemini EM -KAD荧光酶标仪在374 nm的激发波长和485 nm的发射波长下测定。以不加ANS的样品溶液为空白对照。以蛋白质浓度为横坐标,荧光强度为纵坐标作图,曲线的初始斜率即为蛋白分子的表面疏水性。
1.3.4酪氨酸内源荧光测定将蛋白质浓度稀释为0.05 mg/mL。采用Gemini EM-KAD荧光酶标仪在激发波长为280 nm条件下,以1 nm/s的扫描速度记录各条件下肌球蛋白在300~400 nm之间的发射图谱,取荧光扫描图谱中的峰值为该条件下荧光强度。以含有0.6 mol/L KCl的缓冲溶液为空白对照。
1.3.5数据处理每个试验重复3次,数据用“平均值±标准差”表示。数据处理用JMP7.0软件进行方差分析(ANOVA)和Tukey’s HSD法多重比较。
2 结果与分析
2.1DPCD处理压力对肌球蛋白疏水性的影响
蛋白质是由一定氨基酸顺序卷曲成特定的空间结构,多数构成蛋白质的非极性氨基酸侧链分布在分子内部形成疏水内核,而极性氨基酸分布在表面的亲水环境中。用ANS探针法能够较准确的反应蛋白质的表面疏水性变化[13]。蛋白质的内源荧光主要是含有芳香族氨基酸的色氨酸、酪氨酸和苯丙氨酸在激发光下产生荧光,其荧光光谱图对环境极为敏感。在蛋白质结构研究中,通常用色氨酸和酪氨酸作为内源探针来检测其微环境的变化,来间接判断蛋白质三级结构的构象变化。酪氨酸是非极性氨基酸,其荧光强度的增强或减弱,代表了内部疏水区域中酪氨酸残基的暴露状况,以及蛋白质结构的松散程度[14]。
从图1可见,与未处理的肌球蛋白相比,DCPD处理可以使肌球蛋白分子的表面疏水性显著增加(P< 0.05),而且随着处理压力的增加,肌球蛋白分子表面疏水性也显著增大(P < 0.05)。压力在0~10 MPa范围时,肌球蛋白分子表面疏水性显著增加(P < 0.05);压力在10~25 MPa范围变化时,肌球蛋白分子表面疏水性变化不显著(P > 0.05);压力超过30 MPa时,肌球蛋白分子表面疏水性又显著增加(P <0.05)。
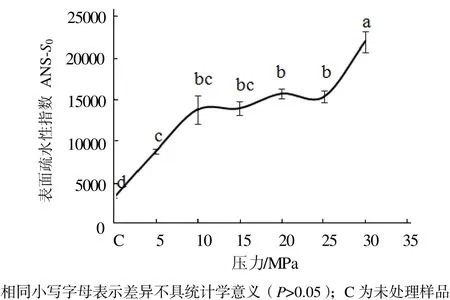
图1 压力对肌球蛋白表面疏水性指数的影响Fig.1 Effect of pressure on the surface hydrophobicity of myosin proteins
从图2可见,与未处理的肌球蛋白相比,DPCD处理可以使肌球蛋白的酪氨酸内源荧光值显著增加(P < 0.05),而且随着处理压力的增加,肌球蛋白的酪氨酸内源荧光值也显著增加(P < 0.05)。压力在0~5 MPa范围内,酪氨酸荧光值增加显著(P < 0.05);压力在5~10 MPa范围内,酪氨酸荧光值变化不显著(P > 0.05);压力在10~30 MPa范围内,酪氨酸荧光值变化显著(P < 0.05)。何轩辉[15]认为蛋白质受不同压力的影响时,酪氨酸内源荧光值的变化反应了蛋白质结构疏松与紧促之间的相互转化。因此,肌球蛋白分子经过DPCD处理后,其酪氨酸内源荧光值增加,可能是肌球蛋白分子逐渐由紧促向疏松发生转变。
出现图1和图2的现象,可能是因为当压力在0~10 MPa范围内时,CO2由气态逐渐向超临界状态转变,其理化性质(如密度等)发生显著变化[16],使其CO2与肌球蛋白发生强烈相互作用,从而暴露出较多的疏水基团,高级结构发生松散;当压力在10~25 MPa范围内时,CO2均维持在超临界状态,其理化性质的变化可能不明显,从而使CO2与肌球蛋白的相互作用并无显著变化,疏水基团和高级结构处于一定的水平。曹莹莹等在研究高压处理肌球蛋白时也发现肌球蛋白分子表面疏水性随压力的增加而增加[17]。

图2 压力对肌球蛋白酪氨酸内源荧光值的影响Fig.2 Effect of pressure on the intrinsic tyrosine fluorescence of myosin proteins
2.2DPCD处理温度对肌球蛋白疏水性的影响
从图3可见,与未处理的肌球蛋白相比,DPCD处理和水浴热处理都能使肌球蛋白的表面疏水性显著增加(P < 0.05),而且在相同温度下DPCD处理组的表面疏水性均显著高于水浴热处理组(P < 0.05)。从图4可见,与未处理的肌球蛋白相比,DPCD处理和水浴热处理均能使肌球蛋白分子的酪氨酸内源荧光值显著增加(P < 0.05),而且在相同温度下DPCD处理组的酪氨酸内源荧光值要显著大于水浴热处理组的(P < 0.05)。
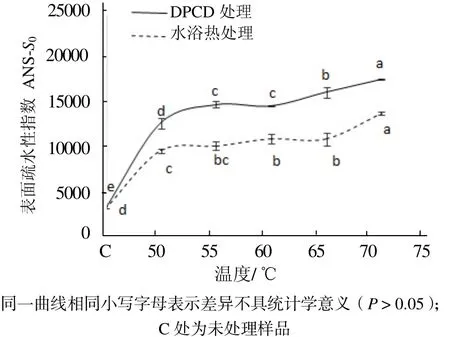
图3 温度对肌球蛋白表面疏水性指数的影响Fig.3 Effect of temperature on the surface hydrophobicity of myosin proteins
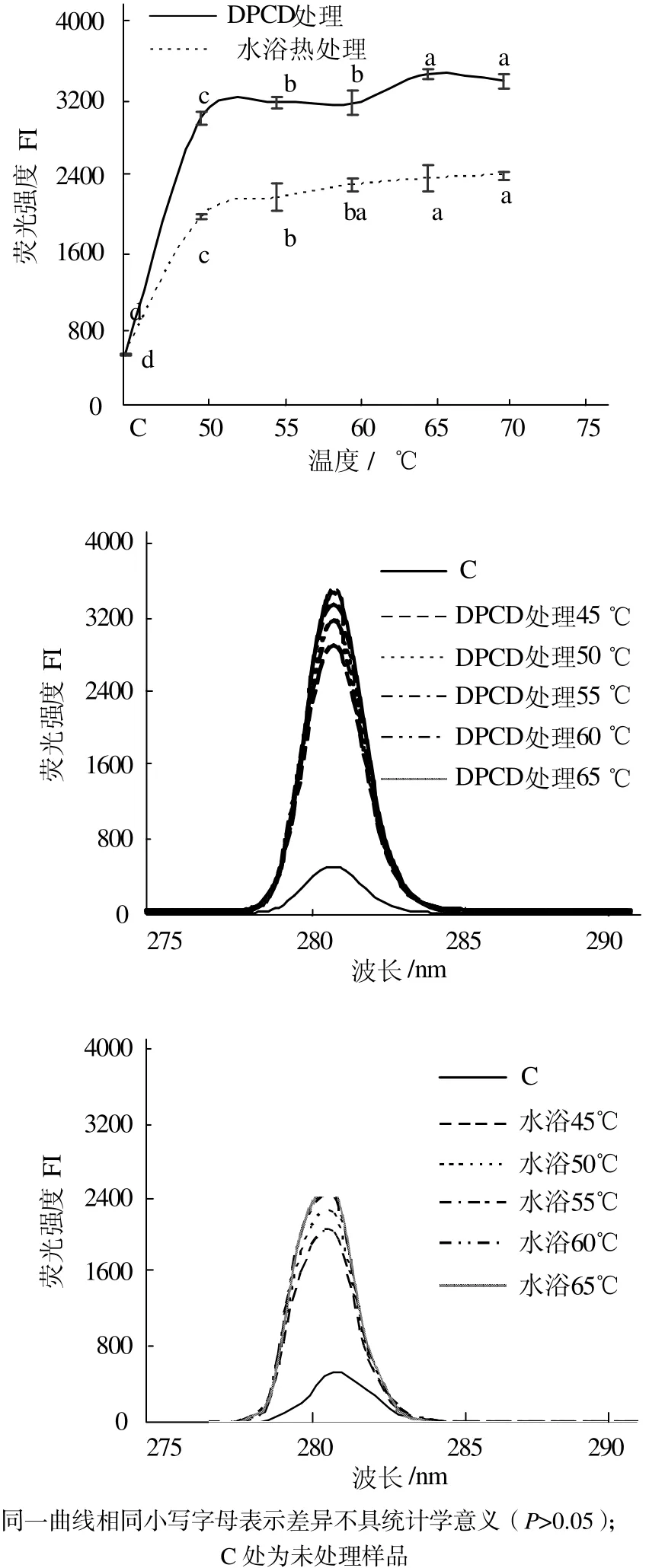
图4 温度对肌球蛋白酪氨酸内源荧光值的影响Fig.4 Effect of temperature on the intrinsic tyrosine fluorescence of myosin proteins
由图3和图4可知,在50~70 ℃范围内DPCD处理和水浴热处理都能使肌球蛋白发生变性,疏水基团暴露,但是DPCD处理组使肌球蛋白的变性程度更大,疏水基团暴露更多。这可能是因为在DPCD处理过程中除了热效应使肌球蛋白疏水基团暴露之外,还可能存在CO2的分子效应使肌球蛋白发生更大程度的变性,使其高级结构更加疏松。实验结果与刘海梅[18]和吴烨[19]等研究热处理对肌球蛋白表面疏水性影响的结果一致。在50~70 ℃范围内,无论是DPCD处理还是水浴热处理,肌球蛋白的表面疏水性和酪氨酸内源荧光值都随着温度升高而缓慢增加(P < 0.05),这可能是热效应的结果。因为在15 MPa、50~70 ℃范围内,CO2的理化性质变化比较小(例如从0.994 43 g/mL降到0.984 23 g/mL),所以肌球蛋白表面疏水性和酪氨酸内源荧光值的变化可能受热效应的影响比较大,而受CO2分子效应的影响较小。
2.3DPCD处理时间对肌球蛋白疏水性的影响
从图5可见,与未处理的肌球蛋白相比,DPCD处理和水浴热处理10 min后都可以使肌球蛋白分子的表面疏水性显著增加(P < 0.05);DPCD处理组在20~30 min内变化不显著,在40 min时又显著增高(P < 0.05),50~60 min变化不显著(P > 0.05);水浴组在20~40 min内变化不显著,直到加热到50 min时才显著增大(P < 0.05)。在相同处理时间下,DPCD处理的肌球蛋白分子的表面疏水性均显著高于水浴热处理组(P < 0.05)。
从图6可见,与未处理的肌球蛋白相比,DPCD处理和水浴热处理10 min后都可以使肌球蛋白分子的酪氨酸内源荧光值显著增加(P < 0.05);在10~50 min范围内肌球蛋白分子的酪氨酸内源荧光值都随处理时间增加而增加(P < 0.05);在相同处理时间下,DPCD处理的肌球蛋白分子的酪氨酸内源荧光值都显著高于水浴热处理组(P < 0.05)。

图5 处理时间对肌球蛋白表面疏水性指数的影响Fig.5 Effect of treatment time on the surface hydrophobicity of myosin proteins
由图5和图6可知,短时间的DPCD处理和水浴热处理都能快速使肌球蛋白疏水基团发生暴露,疏水性增加,结构变得疏松,说明肌球蛋白对热和DPCD都是比较敏感的。在固定温度(60 ℃)和压力(15 MPa)下,虽然CO2的理化性质是稳定的,但随着处理时间增加,CO2与肌球蛋白分子接触的机会更多,因此,肌球蛋白的疏水基团也会暴露增加,高级结构变得更加疏松。在相同处理时间下,与热处理相比,DPCD处理使肌球蛋白的疏水基团暴露更多,高级结构变得更加疏松,说明肌球蛋白对DPCD更加敏感。
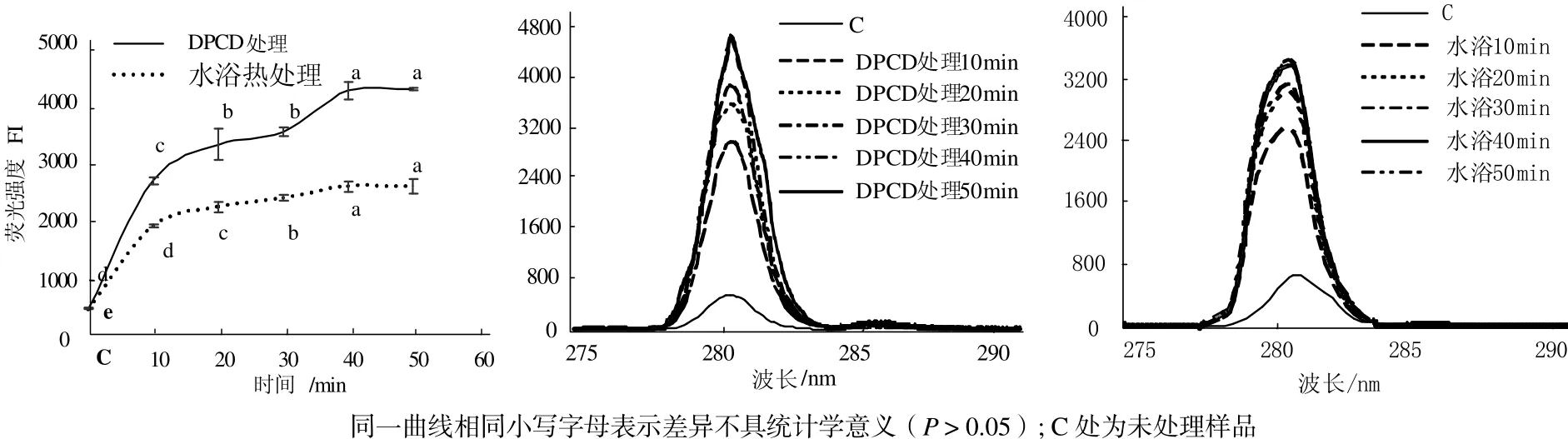
图6 处理时间对肌球蛋白酪氨酸内源荧光值的影响Fig.6 Effect of treatment time on the intrinsic tyrosine fluorescence of myosin proteins
肌球蛋白的疏水基团主要集中在头部,尾部含有7个疏水基团[20]。经过DPCD处理后,肌球蛋白的疏水性增加,这是因为:1)处理后的蛋白质结构变得松散,ANS分子更容易与蛋白质的疏水部位相互结合[21];2)巯基在转化成二硫键的过程中,形成了具有高密度的氨基酸残基的空间拓扑结构,被疏水氨基酸残基包围,形成局部疏水中心[22];3)肌球蛋白分子在受热过程中,蛋白分子尾部的双螺旋结构解开,更多的疏水性侧链和残基暴露出来,致使肌球蛋白分子表面疏水性增大[23];4)蛋白质在压力、温度和CO2的共同作用下构象发生了变化,形成一些芳香的疏水性氨基酸,从而使表面疏水性升高[14,24-25];(5)Leung,K等认为CO2是具有疏水性的,并认为疏水性是蛋白质与CO2相互作用的原因[26],但是Thomas R和Cundari Angela K等认为CO2被束缚在蛋白质内主要是靠酸性作用机制,酸性机制要大于疏水性作用[27]。
3 结论
DPCD处理能使凡纳滨对虾肌球蛋白疏水基团暴露,诱导肌球蛋白高级结构发生松散;与水浴热处理相比,DPCD处理能使肌球蛋白暴露出更多的疏水基团,高级结构更加松散;随着DPCD处理压力和温度的升高以及时间的延长,均能使肌球蛋白暴露出更多的疏水基团,高级结构更加松散。DPCD具有诱导凡纳滨对虾肌球蛋白变性和聚集形成凝胶的可能性。
参考文献
[1]周光宏.畜产品加工学[M].北京:中国农业出版社,2002.
[2]SAMEJIMA K,ISHIOROSHI M,YASUI T.Relative roles of the head and tail Portions of the molecule in heat-induced gelation of myosin[J].Journal of food science,1981,46(5):1412-1418.
[3] WANG W,NEMA S,TEAGARDEN D.Protein aggregation—Pathways and influencing factors[J].International journal of pharmaceutics,2010,390(2):89-99.
[4]KRISTINSSON H G,HULTIN H O.Changes in trout hemoglobin conformations and solubility after exposure to acid and alkali pH[J].Journal of agricultural and food chemistry,2004,52(11):3633-3643.
[5]TANG C H,JIANG Y.Modulation of mechanical and surface hydrophobic properties of food protein films by transglutaminase treatment[J].Food research international,2007,40(4):504-509.
[6]廖小军,胡小松.果蔬的“最少加工处理”及研究现状[J].食品与发酵工业,1998,24(6):39-41.
[7]曲亚琳.高密度CO2诱导羊肉糜凝胶的形成因素及机理初探[D].北京:中国农业科学院,2010.
[8]屈小娟,刘书成,吉宏武,等.高密度CO2诱导制备虾糜凝胶的特性[J].农业工程学报,2012,28(20):282-287.
[9]刘书成,张良,吉宏武,等.高密度CO2与热处理对凡纳滨对虾肉品质的影响[J].水产学报,2013,37(10):1542-1550.
[10]HWANG G,WATABE S,HASHIMOTO K.Changes in carp myosin ATPase induced by temperature acclimation [J].Journal of comparative physiology B,1990,160(3):233-239.
[11]常耀光,李兆杰,薛长湖,等.超高压处理对南美白对虾在冷藏过程中贮藏特性的影响[J].农业工程学报,2008,24(12):230-237.
[12]KATO A,NAKAI S.Hydrophobicity determined by a fluorescence probe method and its correlation with surface properties of proteins [J].Biochimica et biophysica acta(BBA)-Protein structure,1980,624(1):13-20.
[13]曾茂茂,王霄,陈洁.蛋白质疏水性测定方法的相关性及适用性[J].食品科学,2011,32(15):117-120.
[14]尹燕霞,向本琼,佟丽.荧光光谱法在蛋白质研究中的应用[J].实验技术与管理,2010,27(2):33-36,40.
[15]何轩辉.超高压对花生分离蛋白凝胶特性的影响及其机理研究[D].北京:中国农业科学院,2013.
[16]Standard Reference Data Act.Thermophysical properties of fluid systems[EB/OL].[2015-10-08].http://webbook.nist.gov/chemistry/fluid/.
[17] 曹莹莹,张亮,王鹏,等.超高压结合热处理对肌球蛋白凝胶特性及蛋白二级结构的影响[J].肉类研究,2013,27(1):1-7.
[18]刘海梅.鲢鱼糜凝胶及形成机理的研究[D].武汉:华中农业大学,2007.
[19]吴烨.兔肌球蛋白热诱导凝胶化学作用力与凝胶结构功能关系的研究[D].南京:南京农业大学,2010.
[20]MORITA J I,YASUI T.Involvement of hydrophobic residues in heat-induced gelation of myosin tail subfragments from rabbit skeletal muscle [J].Agricultural and biological chemistry,1991,55(2):597-599.
[21]HUPPERTZ T,FOX P F,KELLY A L.High pressure treatment of bovine milk:effects on casein micelles and whey proteins [J].Journal of dairy research,2004,71(1):97-106.
[22]田悦,杜军保.二硫键和巯基在蛋白质结构功能中的作用及分析方法[J].实用儿科临床杂志,2007,22(19):1499-1501.
[23]RELKIN P.Reversibility of heat-induced conformational changes and surface exposed hydrophobic clusters of β-lactoglobulin:their role in heat-induced sol—gel state transition [J].International journal of biological macromolecules,1998,22(1):59-66.
[24]VISESSANGUAN W,OGAWA M,NAKAI S,et al.Physicochemical changes and mechanism of heat-induced gelation of arrowtooth flounder myosin[J].Journal of agricultural and food chemistry,2000,48(4):1016-1023.
[25]BUCKOW R,WEISS U,KNORR D.Inactivation kinetics of apple polyphenol oxidase in different pressure—temperature domains[J].Innovative food science & emerging technologies,2009,10(4):441-448.
[26]LEUNG K,NIELSEN I M B,KURTZ I.Ab initio molecular dynamics study of carbon dioxide and bicarbonate hydration and the nucleophilic attack of hydroxide on CO2[J].The journal of physical chemistry B,2007,111(17):4453-4459.
[27]CUNDARI T R,WILSON A K,DRUMMOND M L,et al.CO2-formatics:How do proteins bind carbon dioxide?[J].Journal of chemical information and modeling,2009,49(9):2111-2115.
(责任编辑:陈庄)
Effect of Dense Phase Carbon Dioxide on Hydrophobicity of Myosin Proteins from Litopenaeus vannamei
GUO Ming-hui,DENG Qian-lin,LIU Shu-cheng,DENG Chu-jin,JI Hong-wu,LI Cheng-yong,GAO Jing
(College of Food Science and Technology,Guangdong Ocean University//Guangdong Provincial Key Laboratory of Aquatic Product Processing and Safety//Key Laboratory of Advanced Processing of Aquatic Product of Guangdong Higher Education Institution,Zhanjiang 524088,China)
Abstract:This study investigated the effect of dense phase carbon dioxide(DPCD)on myosin gel formation induced by measuring the surface hydrophobicity and tyrosine intrinsic fluorescence spectrum of myosin in different conditions(pressure 5~30 MPa,temperature 50~70 ℃,time 10~50 min)with ANS probe and fluorescence scanning,respectively.The results indicated that DPCD treatment increased the surface hydrophobicity and the intrinsic fluorescence value of tyrosine significantly(P<0.05).Under the same temperature,the surface hydrophobicity and the intrinsic fluorescence value of tyrosine of myosin treated by DPCD were significantly higher than those of water bath heat-treatment(P<0.05).DPCD significantly enhanced the surface hydrophobicity and the intrinsic fluorescence value of myosin tyrosine with the increased pressure and temperature and the extension of time(P<0.05).These findings showed that DPCD could expose the hydrophobic group of myosin,which could loose the tight advanced structure.
Key words:Dense phase carbon dioxide; myosin; surface hydrophobicity; tyrosine
通信作者:刘书成(1977—),男,博士,教授,研究方向为食品非热加工技术。
基金项目:国家自然科学基金资助项目(31371801);国家虾产业产业技术体系专项基金(CARS-47)
收稿日期:2015-11-04
doi:10.3969/j.issn.1673-9159.2016.01.013
中图分类号:TS254.4
文献标志码:A
文章编号:1673-9159(2015)06-0073-06
第一作者:郭明慧(1990—),女,在读硕士,研究方向为食品非热加工技术。

