GC-MS测定小鼠血浆中1,8-桉叶素含量及其体内药动学参数研究
卢 云,臧志和,廖昌军
(成都医学院药学院,四川成都610083)
GC-MS测定小鼠血浆中1,8-桉叶素含量及其体内药动学参数研究
卢云,臧志和,廖昌军
(成都医学院药学院,四川成都610083)
摘要:采用GC-MS法测定小鼠灌胃1,8-桉叶素后不同时间点血浆中药物浓度,利用药动学软件DAS3.0计算1,8-桉叶素在小鼠体内的药代动力学参数。结果显示:1,8-桉叶素在0.5~8mg/L范围内,浓度与峰面积比值呈良好的线性关系。血药浓度数据经药动学软件DAS3.0处理后,Cmax为17.46mg/L,tmax为10 min,t1/2为155.70min。GC-MS法测定1,8-桉叶素具有快速、准确和灵敏度高的特点,药代动力学参数可为1,8-桉叶素体内抗菌治疗作用研究提供理论依据。
关键词:GC-MS法;药代动力学:含量测定;1,8-桉叶素
0 引言
桉树是桃金娘科桉属植物的总称,是澳大利亚木本植物中最具代表性的树种。中国于1890年引入桉树,20世纪50~60年代,广东、广西、海南等地成为主要产区。目前,我国桉树生产已经成为世界第三位,多用于造纸[1]。桉叶油是从桃金娘科植物蓝桉或其同属其他植物的叶中提取而来的挥发油,主要用于医疗、香料、工业[2]。医用桉叶油中1,8-桉叶素(又名桉叶油醇)是主要成分,其他含量较高的成分有α-蒎烯,β-蒎烯,α-松油醇,4-萜品醇等萜类成分[3-4]。药理研究表明,桉叶油具有抗菌消炎、抗寄生虫和杀虫、抗癌、抗氧化、降压、促渗透、改善呼吸道功能等作用[5-10]。随着抗菌药物的广泛使用,出现了多药耐药菌、泛耐药菌[11-14],这为细菌感染治疗带来了极大的难题。桉叶油作为一种天然产物,具有体外抗菌作用,可为体内细菌感染治疗提供新方法。本文旨在建立GC-MS测定小鼠血浆中1,8-桉叶素含量的方法,并研究1,8-桉叶素在小鼠体内的药代动力学参数,为体内抗感染治疗作用研究提供理论依据。
1 仪器与材料
1.1仪器
电子天平(CPA225D,德国赛多利斯科学仪器有限公司公司);涡旋混合器(XW-80A,上海青浦泸西仪器厂);离心机(Heraeur Pico 17,ThermoFisher);气质联用仪(5973,安捷伦科技有限公司)。
1.2试剂
1,8-桉叶素对照品(批号:20140210,质量分数≥99.5%,国药集团化学试剂有限公司);乙酸丁酯(批号:20120605);环己烷(批号:2015051201),桉叶油(实验室水蒸气蒸馏法提取)。
1.3实验动物
昆明小鼠66只(雌雄各半),SPF级,由成都达硕实验动物有限公司提供,许可证号为scxk(川)2013-24。
2 方法
2.1色谱条件及质谱条件
色谱条件:毛细管柱HP-5MS(30 m×0.25 mm× 0.25 μm),载气为氦气,进样口温度250℃,分流比20∶1,柱流量1mL/min;升温程序:40℃保持3min,以20℃/min升温至250℃,保持2.5min。
质谱条件:离子源EI,离子源温度250℃,电子能量70eV,扫描范围30~300amu,扫描速度3.8scans/s,进样量1μL。
2.2样品处理
取小鼠血浆0.18mL,加入0.02mL乙酸丁酯储备液,涡旋振荡5min,加入环己烷0.4mL,涡旋振荡5min,离心(13300r/min)10min后取上清液待测。
2.3对照品溶液的配制
精密称取1,8-桉叶素对照品105.0mg于100mL容量瓶,环己烷定容,摇匀即得质量浓度为1.05 mg/mL 的1,8-桉叶素对照品储备液,冷藏于4℃冰箱备用。
2.4内标液配制
精密称取乙酸丁酯10 mg于10 mL容量瓶,环己烷定容,取上述溶液0.1mL于10mL容量瓶,环己烷定容,摇匀即得浓度为0.01mg/mL的内标储备液,冷藏于4℃冰箱备用。
3 结果
3.1方法专属性考察
取空白血浆、对照品添加空白血浆样品、含药血浆样品按照“2.1”项条件,分别进样1 μL,内标物乙酸丁酯的保留时间约为4.340min,1,8-桉叶素的保留时间约为6.988min,二者峰形良好且分离完全,血浆中内源性物质不干扰样品测定(见图1~图5)。
3.2标准曲线及线性范围

图1 空白血浆色谱图
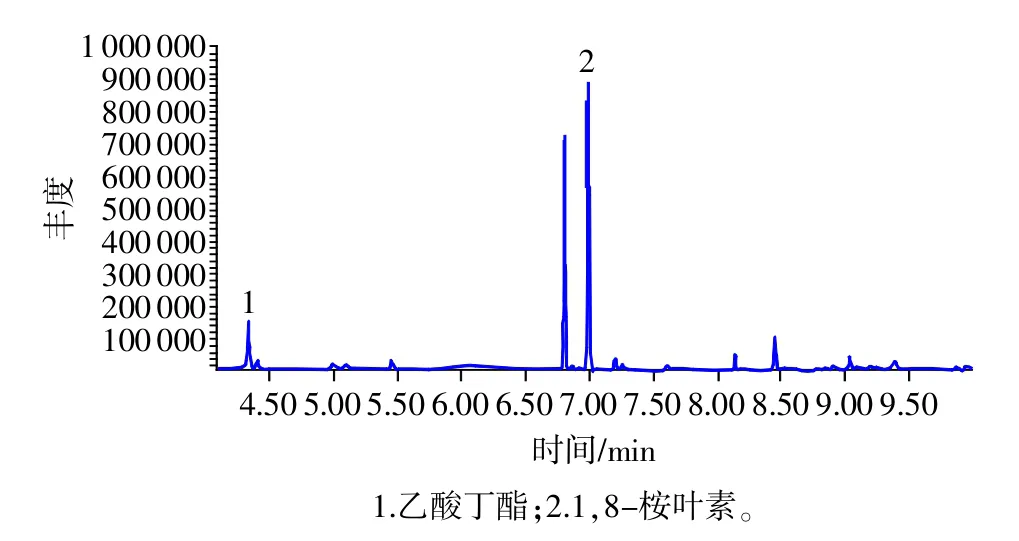
图2 对照品色谱图
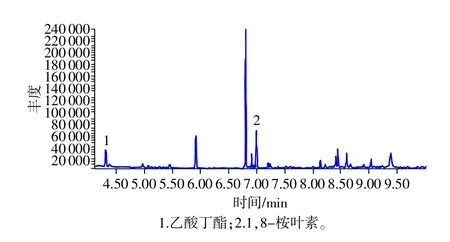
图3 血浆样品色谱图
分别取“2.3”项下1,8-桉叶素对照品储备液0.1,0.2,0.4,0.8,1.6 mL于5个10 mL容量瓶,环己烷定容,摇匀。取5份小鼠空白血浆,每份0.18mL,加入0.02mL乙酸丁酯储备液,依次加入上述1,8-桉叶素对照品储备液0.02 mL,涡旋振荡5 min,分别加入环己烷0.38mL,涡旋振荡5min,离心(13 300 r/min)10min,取上清液,得1,8-桉叶素质量浓度分别为0.5,1.0,2.0,4.0,8.0 mg/L的系列血浆对照液,分别进样1μL。记录1,8-桉叶素及乙酸丁酯内标峰面积。以1,8-桉叶素峰面积与乙酸丁酯峰面积的比值为纵坐标,以1,8-桉叶素质量浓度为横坐标,进行线性回归,得到1,8-桉叶素的标准曲线方程为:y=0.0998x-0.0327,r2=0.9991。结果表明:1,8-桉叶素在0.5~8mg/L范围内线性关系良好。

图4 乙酸丁酯质谱图

图5 1,8-桉叶素质谱图
3.3精密度试验
按照“3.2”项下方法配制质量浓度分别为0.5,1.0,4.0mg/L的标准血浆样品,连续进样5次,结果表明1,8-桉叶素标准血浆样品精密度良好(见表1)。
3.4加样回收率实验
取0.09 mL灌胃10 min后的小鼠血浆9份,加入乙酸丁酯储备液0.02mL,分别加入不同体积的1,8-桉叶素对照品溶液和环己烷,配制成低、中、高浓度的血浆样品,涡旋振荡5min,离心(13300r/min)10min后取上清进样。记录内标和样品峰面积,计算回收率,结果见表2。可以看出,低、中、高浓度药血浆样品的加样回收率分别为96.79%、100.96%和99.31%,且RSD%均<5%,符合要求。
3.5稳定性实验
日内稳定性:将处理好的血浆样品溶液,1d内每隔2h测1次,一共检测3次,计算得1,8-桉叶素峰面积比值的RSD为2.89%。

表1 1,8-桉叶素精密度(n=5)

表2 1,8-桉叶素加样回收率(n=3)
日间稳定性:将处理好的血浆样品溶液,1d测1次,连续测3d,计算得1,8-桉叶素峰面积比值的RSD为4.32%。
3.6含量测定
将66只小鼠(雌雄各半)随机分成6组,每组11只,禁食不禁水12 h,均灌以3.2 g/kg桉叶油,于给药前和给药5,10,15,20,25,30,45,60,90,120min后断头取血(取血量≥0.2 mL),按照“2.2”项下方法处理样品,进样1μL。不同时间点1,8-桉叶素的血药浓度见表3。
3.7药代动力学参数
将“3.6”项下6组血药浓度-时间数据代入DAS3.0药动学软件,经处理,1,8-桉叶素的平均药-时曲线见图6,药代动力学参数见表4。

表3 小鼠灌胃后不同时间点1,8-桉叶素的血药浓度(n=6)
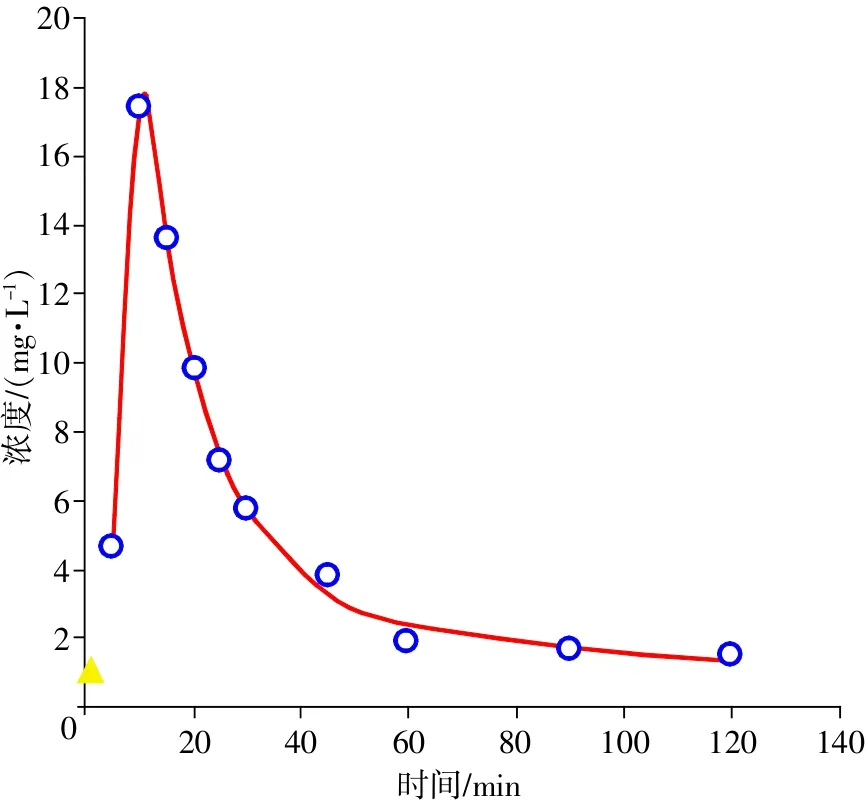
图6 1,8-桉叶素平均药-时曲线图(n=6)

表4 1,8-桉叶素主要药代动力学参数(n=6)
结果显示,口服给药后1,8-桉叶素在10min左右血药浓度达到高峰,平均达峰浓度约为17.46mg/L,消除半衰期约为155.70 min,表明1,8-桉叶素在小鼠体内口服吸收迅速,达峰时间较短,体内作用时间较长。
4 讨论
4.1内标物筛选
以1,8-桉叶素沸点为依据,选取N,N-二甲基甲酰胺、水杨酸甲酯和乙酸丁酯为内标进行考察,发现以N,N-二甲基甲酰胺、水杨酸甲酯作内标时峰形不理想,影响样品的测定。而以乙酸丁酯作内标,两者分离完全,且峰型好。
4.2血浆样品前处理
预实验阶段,曾以乙醇为溶剂处理血浆样品,溶解性好且可以沉淀蛋白,但乙醇用量较大,须浓缩上清液,样品回收率显著下降。而以环己烷为提取溶剂用量小,不须挥干,直接涡旋、离心后取上清液进样。样品测定无干扰,结果满意。
5 结束语
本文建立了GC-MS测定血浆样品中1,8-桉叶素含量的方法,该方法样品前处理简单,能够快速、准确地测定血浆样品中1,8-桉叶素含量。同时药代动力学参数表明该药物在小鼠体内口服吸收迅速,出峰时间较短,半衰期较长,可为进行体内抗菌治疗作用研究提供理论依据。
参考文献
[1]陶建文,覃丹.桉树人工林现状及其可持续发展[J].南方农业,2015,9(6):76.
[2]张克建.中国桉叶油的开发与利用[J].林业科技开发,1997 (4):20-21.
[3]南海军,潘利明,龚梦娟,等.气相色谱质谱法鉴定桉叶油中的挥发性成分[J].中国实用医学,2014,22(9):27-28.
[4] LILA HM,BOUDRIAA,KHODIRM,et al. Chemical composition, antibacterial and antioxidant activitives of essential oil of Eucalyptus globulus from Algeria[J]. Industrial Crops and Products,2015(78):148-153.
[5] QUAN V V,ANITA C C,DEEP J B,et al. Botanical,Phytochemical, and Anticancer Properties of the Eucalyptus Species[J]. Chemistry & Biodiversity,2015,12(6):907-924.
[6] AMEUR E A,KARIMA H S B,SAMIA M D,et al. Antibactererial activity and chemical compisition of 20 Eucalyptus species,essential oils [J]. Food Chemistry,2011(129):1427-1434.
[7] MACIEL M V,MORAIS S M,BEVILAQUA C M L,et al. Chemical compisition of Eucalyptus spp. essential oils and their insecticidal effects on Lut zomyia longipalpis[J]. Veterinary Parasitology,2010(167):1-7.
[8] CHO K H. 1,8-cineole protected human lipoproteins from modification by oxidation and glycation and exhibited serum lipid-lowering and anti-inflammatory activity in zebrafish[J]. BMB Rep,2012,45(10):565-750.
[9]张肖玲,邓红,张蜀,等.醋酸烯诺孕酮透皮贴剂的制备及不同促渗剂对其促渗作用考察[J].中国药房,2013,24 (17):1587-1590.
[10]李光友,徐建民,范菊香.桉叶油的药理作用及其临床研究进展[J].安徽农业科学,2014,42(13):3602-3603.
[11] BRADFORD P A. Extended-spectrum beta-lactamases in the 21st century: characterization,epidemiology,and detectionof this important resistance threat[J]. Clinical Microbiology Reviews,2001,14(4):933-951.
[12]向在永. 2013~2014年南阳市市区五家三级综合医院细菌耐药监测评价[J].中国医院药学杂志,2015,35(19):1783-1787.
[13]文怡,王颖,李珉,等. 2013年江苏地区12家医院细菌耐药监测结果评价[J].临床检验杂志,2014,32(11):841-845.
[14]李冬梅,李小云. 2013年我院多重耐药菌的分布及耐药性分析[J].药物流行病学杂志,2015,24(6):368-371.
(编辑:莫婕)
Determination of 1,8-cineole in mouse plasma by GC-MS and pharmacokinetic parameters study in vivo
LU Yun,ZANG Zhihe,LIAO Changjun
(The Chengdu Medical College School of Pharmacy,Chengdu 610083,China)
Abstract:This paper aims to determine the concentration of 1,8-cineole in mouse plasma at different time-points by GC-MS after a separate gavage with moderate dose of eucalyptus oil and to calculate the pharmacokinetic parameters in mouse plasma with pharmacokinetic software DAS3.0. After the study,the ratio of concentration and peak area shows a good linear relationship within the concentration range of 0.5-8 mg/L. After the concentration data was treated with DAS3.0,it reveals that Cmaxis 17.46mg/L,tmaxis 10min,t1/2is 155.70 min. This method is rapid,accurate and highly sensitive. The pharmacokinetic parameters can be used as theoretical support for in-vivo antibacterial treatment of 1,8-cineole.
Keywords:GC-MS;pharmacokinetic;content determination;1,8-cineole
通讯作者:臧志和(1955-),男,河北乐亭县人,教授,主要从事教学管理工作。
作者简介:卢云(1990-),女,湖北咸宁市人,硕士研究生,专业方向为天然药物化学与药代动力学研究。
基金项目:四川省卫生厅资助项目(120486)成都医学院科研资助项目(CYZ13-028)
收稿日期:2015-09-13;收到修改稿日期:2015-10-09
doi:10.11857/j.issn.1674-5124.2016.02.013
文献标志码:A
文章编号:1674-5124(2016)02-0059-04

