适合的才是最好的——关于苏教版(必修2)化学反应限度中实验的讨论
赵小生
(苏州市吴中区甪直高级中学 江苏苏州 215127)
适合的才是最好的——关于苏教版(必修2)化学反应限度中实验的讨论
赵小生
(苏州市吴中区甪直高级中学江苏苏州215127)
摘要:苏教版(必修2)化学反应限度知识点中演示实验的设置到现在的版本已经出现5种版本,对于第5次变动,无论是反应的选择、试剂的选择、还是试剂使用量的选择都进行了调整,细微之处显真知,适合的才是最好的。
关键词:适合的实验安排;试剂药品;试剂用量
江苏省08方案后,苏教版教材中针对化学反应限度的知识点教学所设计的演示实验,做了5次调整。由最初的两个演示实验改为一个实验,即改为FeC13溶液与KI溶液反应实验。笔者在最近的教学中发现这个实验今年又有新的小的变动。对于新版本的细微变化,做一些探讨。
这次变动主要是涉及到两个内容:
1. FeC13溶液的使用量由“5~6滴”改为“1mL”;
2.有机萃取剂由CC14溶液改为苯溶液。与之对应的是萃取次数增加。
与之对应的FeC13溶液与KI溶液反应的现象和结论记录表改变如下表:
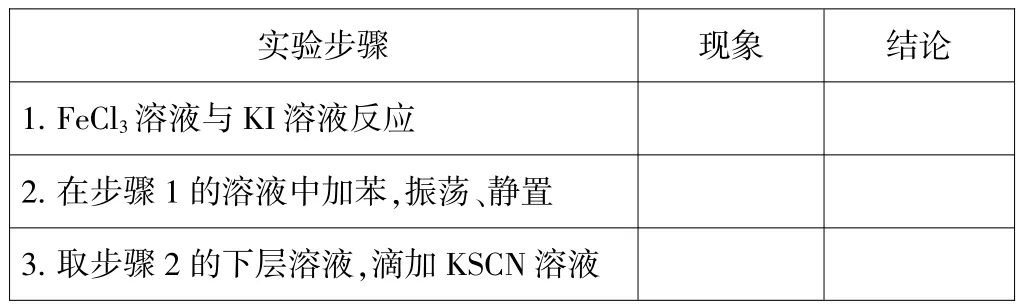
实验步骤 现象 结论1. FeC13溶液与KI溶液反应2.在步骤1的溶液中加苯,振荡、静置3.取步骤2的下层溶液,滴加KSCN溶液
一、适合的实验安排是掌握知识的保障
演示实验是课堂教学中为了使学生掌握某个知识点而设置的实验。所以实验试剂对象的选择很重要。化学反应限度本身是一个比较抽象的概念。必修2课本没有化学反应限度明确的定义,这个知识点设置的目的:一是为了说明可逆反应有一定的限度;二是为了选修课平衡常数的学习打下伏笔。对于抽象知识的理解,演示实验的选择尤为重要,适合的演示实验是掌握知识的保障。
苏教版化学必修2关于化学反应限度的演示实验,原来的2007年第1版设置的是两个实验,其中之一就是一直沿用到现在的实验,还有一个实验是这样的:
取一支洁净的试管,向试管中加入0.1mo1·L-1AgNO3溶液2mL,向AgNO3溶液中加入稍过量的铜粉,反应一段时间后,取上层清液于试管中,再向试管中滴加0.1mo1·L-1KI溶液,观察实验现象。
对于这个实验,有很多说法。主要围绕最后观察的黄色沉淀是什么展开的。一种认为就是AgI沉淀;另一种认为除了AgI沉淀以外还有其他的沉淀;还有一种说法是黄色沉淀有可能是白色沉淀和黄色溶液共同作用的结果。
究其原因如下:Cu粉和Ag+反应后溶液中Cu2+有一定氧化性,再向溶液中加入KI溶液,其中的I-会和Cu2+反应:2Cu2++4I-=2CuI↓+I2反应后CuI沉淀为白色沉淀,I2的水溶液为黄色,AgI沉淀也是黄色。三个物质混在一起的颜色会给人以错觉。
在之后的苏教版教材的重新修订中,我们放弃了这个演示实验。虽然也有人曾经把KI溶液改成KBr溶液,但也是质疑声不断。
二、适合的试剂药品是实验成功的前提
鞋穿在脚上舒不舒服只有脚知道,适合的才是最好的。本次调整中对于萃取剂做了细微改变,实验中有机萃取剂由CC14溶液改为苯(或CC14)溶液。虽然苯也可以做萃取剂,但从实验的操作难易度来看,还是CC14溶液做萃取剂较为适合。笔者也试着用两个试剂进行实验对比。
以下是两试剂的性质对比:
1.四氯化碳为无色澄清易流动的液体,有时因含杂质呈微黄色,具有芳香气味、易挥发、密度(20℃)1.595g/mL比水密度大、熔点-22.8℃、沸点76~77℃、有毒。常用作有机溶剂。
2.苯(C6H6)在常温下为一种无色、有甜味的透明液体,并具有强烈的芳香气味、易挥发、苯比水密度低(密度为0.88g/mL),熔点5.5℃、沸点80.1℃、常用作有机溶剂。对比两者可以发现两者都是很好的萃取剂。使用哪一个都是可以的。但是作为演示实验,我们的目的是用简单易操作的实验来传授知识。
使用萃取剂的目的是萃取反应产生的I2,同时也为了不影响到后面Fe3+的检验。如果使用CC14做萃取剂,有机层在下层,含有Fe3+的溶液在上层。检验Fe3+时,只需要用滴管取上层溶液于点滴板即可。不需要进行分液操作,操作简单易行。但是使用苯(C6H6)做萃取剂,萃取结束后有机层在上层,检验Fe3+之前必须先进行分液操作,操作复杂了,而且费时不简洁。笔者使用两个试剂分别操作两者耗时相差4分钟。对比两者,笔者以为,还是使用CC14做萃取剂较适合。
三、适合的试剂用量是实验成功的关键
化学反应中试剂量的把握很重要,是实验成功的关键。量少了可能没有现象,或者现象不明显;量多了可能也没有现象,或者有现象,但会造成试剂的浪费。
苏教版2014年6月第5版化学反应限度的实验改动如下:已知FeC13溶液与KI溶液能发生如下反
1.取5mL0.1mo1·L-1KI溶液,向其中加入0.1mo1·L-1FeC13溶液1mL,振荡,观察实验现象。
2.继续向上述溶液中加入2mL苯(或CC14),充分振荡后静置,观察实验现象。
3.重复上述萃取操作2~3次,将下层溶液分装在两支洁净试管中,向其中一支试管滴加5~6滴15% KSCN溶液,观察并比较实验现象。
和原来第4版相比除了萃取剂的选择有变化以外,最大的变化就是反应试剂的用量和萃取次数发生变化了。
针对反应试剂用量问题浙江宁波中学老师魏巍[1]对原实验做了这样的解释:
为0.364ppm。而检验Fe3+时,检出限量浓度为5ppm[2]。所以得出结论,无法用KSCN溶液检验出Fe3+的存在。
针对这一试剂使用量的变化,笔者也进行了一些对比试验,以下是对比试验的情况记载:
1.试验用品
仪器:15×150mm玻璃试管若干、滴管若干、点滴板。
药品:0.1mo1·L-1KI溶液、0.1mo1·L-1FeC13溶液、CC14溶液、15%KSCN溶液。
2.试验过程
(1)分别取5mL 0.1mo1·L-1KI溶液于4支洁净试管中,标号待用。
(2)在1~4号试管中分别滴加0.1mo1·L-1FeC13溶液6滴、1mL、1.5mL、2mL。观察实验现象。
(3)分别在反应后的1~4号试管中加入2mL CC14溶液,振荡、静置。观察实验现象。
(4)分别用4支滴管取(3)操作后上层溶液于点滴板,分别滴加2滴15%KSCN溶液。观察实验现象。
3.试验分析
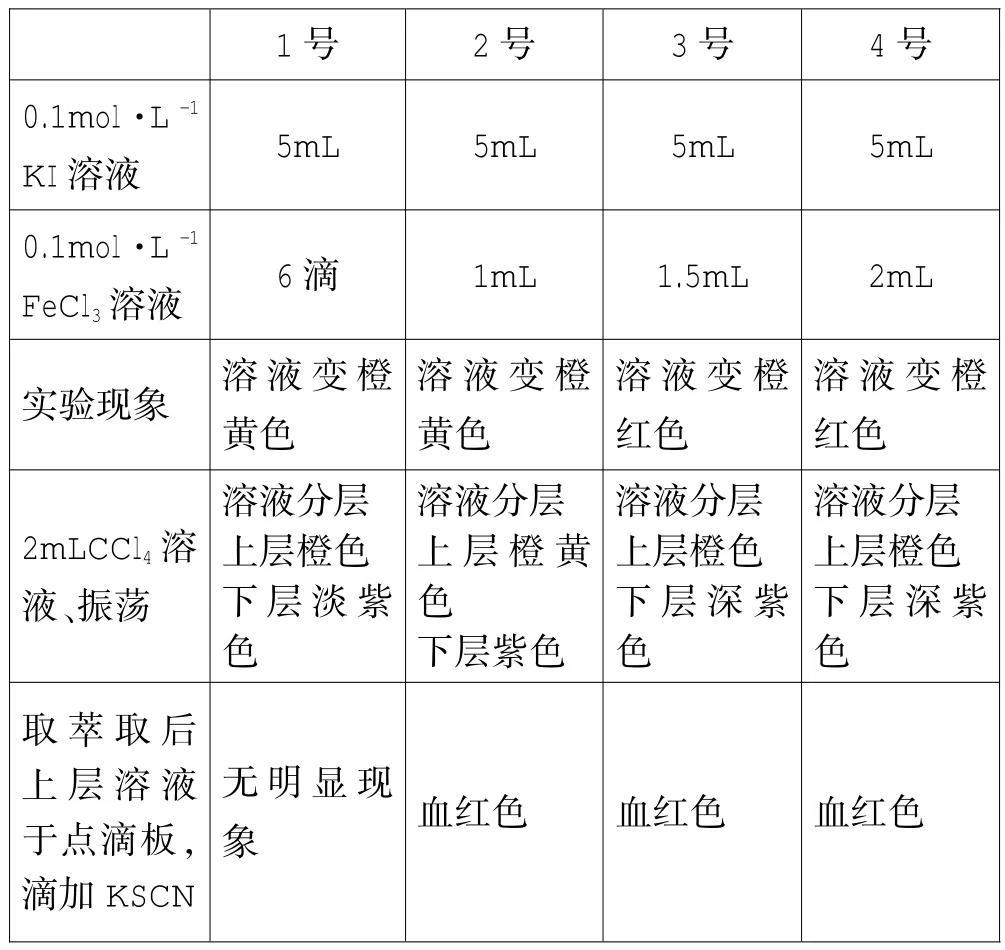
表1对比实验所得现象分析
根据实验现象,笔者发现按照书本上试剂用量,在5mL 0.1mo1·L-1KI溶液中滴加0.1mo1·L-1FeC13溶液1mL,现象比较明显了。但是使用2mL CC14溶液仅仅萃取一次后,溶液上层仍然橙黄色,笔者取上层溶液,再加入2mL CC14溶液进行萃取后,上层溶液明显变淡。再取上层溶液于点滴板,滴加KSCN溶液。溶液出现明显的血红色。萃取次数不得少于2次。
为了减少萃取次数,笔者试着改变试剂的用量,取3mL0.1mo1·L-1KI溶液中滴加0.1mo1·L-1FeC13溶液10滴,振荡。反应后使用2mLCC14溶液萃取,溶液上层淡黄色,取上层溶液于点滴板,滴加2滴KSCN溶液。溶液出现明显的血红色。
综上,笔者就这个演示实验的安排做以下调整,仅供参考:
1.取3mL0.1mo1·L-1KI溶液,向其中加入0.1mo1·L-1FeC13溶液10滴,振荡,观察实验现象。
2.继续向上述溶液中加入2mLCC14溶液,充分振荡后静置,观察实验现象。
3.用滴管取上层溶液于点滴板上,向其中滴加1~2滴15%KSCN溶液,观察实验现象。
主要变化为:适合的萃取剂,选择CC14溶液可以减少分液实验操作;适合的试剂使用量,不但实验现象依然明显,而且减少萃取操作的次数。这样的改变可以大大提高实验效率和效果。适合的才是最好的。
化学反应限度知识点设置到现在,演示实验的变动有5种版本,从备受质疑到不断完善、从实验设置的大幅删减,到实验细节的斟酌推敲。使得整个知识点和演示实验配备越来越完善、越来越合适。
参考文献
[1]魏巍.苏教版(必修2)化学反应限度中两个实验的讨论[J].化学教学,2008,(1):75-77
[2]武汉大学.分析化学(第二版)[M].北京:高等教育出版社,1982
doi:10.3969/j.issn.1008-0546.2016.02.028
文章编号:1008-0546(2016)02-0086-02
中图分类号:G633.8
文献标识码:B

