兔源IL—6基因启动子的克隆及转录调控
刘星++宋艳华+王芳++范志宇++胡波+++魏后军++仇汝龙++徐为中+++薛家宾


摘要:通过体内感染兔出血症病毒后发现白介素6(Interleukin-6,IL-6)基因表达水平明显升高。为体外研究IL-6启动子的转录调控机制,寻找该基因转录调控的基本转录原件,首先利用染色体步移技术扩增得到兔[WTBX][STBX]IL-6[WTBZ][STBZ]基因的启动子区序列,经测序全长为763 bp;经同源性分析,与人源[WTBX][STBX]IL-6[WTBZ][STBZ]基因的启动子高度同源;生物信息学分析发现,该启动子序列含有AP-1、CREB/NF-IL6、NF-κB和TATA-box等转录元件。随后将全长和一系列缺失体的IL-6启动子基因(-400/+58 bp、-250/+58 bp、-170/+58 bp、-100/+58 bp)定向亚克隆至荧光素酶表达载体pGL3-Basic中,构建了含有正确目的基因的报告基因重组体,然后瞬时转录RK-13细胞,利用荧光素酶报告基因检测试剂盒检测。结果显示,本试验所克隆的[WTBX][STBX]IL-6[WTBZ][STBZ]基因启动子区具有明显的活性,而且AP-1、CREB/NF-IL6和NF-κB在[WTBX][STBX]IL-6[WTBZ][STBZ]基因的转录调控中有着不可或缺的作用。以上结果为进一步研究兔[WTBX][STBX]IL-6[WTBZ][STBZ]基因的转录调控机制奠定了基础。
关键词:兔;[WTBX][STBX]IL-6[WTBZ][STBZ]基因;启动子;荧光素酶基因表达载体;转录调控
中图分类号: S858.291;Q785文献标志码: A
文章编号:1002-1302(2016)02-0031-04
收稿日期:2016-01-20
基金项目:江苏省自然科学基金(编号:BK20140740);现代农业产业技术体系建设专项(编号:CARS-44)。
作者简介:刘星(1988—),男,江苏南京人,博士研究生,助理研究员,主要从事家兔疾病防治与兽医生物技术研究。E-mail:iuxing88610@126.com。
通信作者:王芳,博士,研究员,主要从事家兔重要疫病致病机理及综合防控技术等方面的研究。E-mail:rwangfang@126.com。
真核生物基因转录调控包括DNA水平的调控、转录水平的调控、转录后加工、转运过程、翻译水平以及翻译后蛋白质的加工修饰等,而真核生物的基因表达调控多数发生在转录及以后的水平上,转录水平调控研究主要是启动子区上的基本转录单位[1]。白介素6(Interleukin-6,IL-6)主要由巨噬细胞、T细胞、B细胞等多种细胞产生。它可调节多种细胞的生长与分化,具有调节免疫应答、急性反应及造血功能,并在机体的抗感染免疫反应中起重要作用。同时,IL-6在多种疾病状况下有明显改变。IL-6表达失调可引起许多疾病,其临床表现主要为发病时IL-6水平增高。IL-6上升的水平与疾病的活动期、肿瘤的发展变化、排斥反应程度以及治疗效果都密切相关[2-3]。
兔体感染兔出血症病毒后能明显上调[WTBX][STBX]IL-6[WTBZ][STBZ]基因的表达水平,该基因水平的升高或许与其致病性相关[4]。为了研究兔源[WTBX][STBX]IL-6[WTBZ][STBZ]基因的表达调控,本试验以兔IL-6为试验对象,通过制备一系列[WTBX][STBX]IL-6[WTBZ][STBZ]基因启动子缺失突变体,利用荧光素酶报告基因系统确定其转录活性,以期寻求该基因启动子区的核心启动子区域,为启动子功能进一步研究奠定基础。同时,也为研究兔出血症病毒调控[WTBX][STBX]IL-6[WTBZ][STBZ]基因表达奠定基础。
1材料与方法
1.1试验兔
选用2~3月龄健康易感新西兰兔(未免疫兔出血症及相关疫苗)10只(由金陵种兔场提供)分为2组(攻毒组和对照组),每组5只。
1.2种毒
攻毒用毒种为兔出血症病毒皖阜株肝毒,由江苏省农业科学院兽医研究所保存[5]。病毒(含量105.5LD50/mL)攻毒剂量为1 mL;对照组选用PBS作为参照。
1.3肝脏病理变化分析和IL-6 mRNA水平的测定
攻毒后48 h,利用免疫组化法和苏木精-伊红染色法对攻毒组和对照组兔体肝脏组织进行病理变化分析,以及利用相对定量Real-time PCR对IL-6 mRNA表达水平进行测定,所用引物见表1。
1.4基因启动子的克隆
新西兰兔肝脏组织DNA采用苯酚-氯仿法提取[1],用紫外分光光度计(260nm)检测DNA 的完整性、纯度和浓度。通过对GenBank中已收录的人、鼠等物种的[WTBX][STBX]IL-6[WTBZ][STBZ]基因启动子进行同源性比对,采用Primer Premier 5.0软件设计兔[WTBX][STBX]IL-6[WTBZ][STBZ]基因启动子克隆引物(表1),包括:[WTBX][STBX]IL-6[WTBZ][STBZ]基因启动子克隆引物IL-6-Fwd与IL-6-Rev1、IL-6-Rev2、IL-6-Rev3;启动子缺失片段引物IL-6-Fwd-400、IL-6-Fwd-250、IL-6-Fwd-170和IL-6-Fwd-100。以兔基因组DNA 为模板,进行巢式PCR反应。反应体系:2×GC buffer(Mg2+)10 μL,dNTP(2.5 mmol/L)2 μL,LA Taq 酶(5 U/μL)0.2 μL,上下游引物(10 μmol/L)分别1 μL,DNA模板1 μL,ddH2O 4.8 μL。PCR程序为:95 ℃预变性4 min;94 ℃变性30 s,69 ℃退火30 s,72 ℃延伸2.5 min,34个循环;72 ℃再延伸 10 min;4 ℃保存。PCR产物用1%琼脂糖凝胶电泳检测并纯化回收,与PMD19-T载体16 ℃过夜连接,并转化TOP10感受态细胞。挑取白色菌落于液体LB培养基中过夜培养后,用质粒提取试剂盒提取质粒DNA,经质粒PCR初步筛选阳性克隆后,送TaKaRa公司测序。
1.5[WTBX][STBX]IL-6[WTBZ][STBZ]基因启动子的生物信息学分析
利用NCBI中的Blast对克隆所得的兔基因启动子片段和人基因启动子片段进行同源性比对;应用Promoter 2.0 Prediction 软件预测[WTBX][STBX]IL-6[WTBZ][STBZ]基因的启动子区域。
1.6[WTBX][STBX]IL-6[WTBZ][STBZ]基因启动子缺失片段报告基因重组体的构建
采用PCR方法从重组的[WTBX][STBX]IL-6[WTBZ][STBZ]基因启动子载体中克隆得到4个不同长度[WTBX][STBX]IL-6[WTBZ][STBZ]基因启动子缺失片段,上下游引物的5′端分别引入MluⅠ和BglⅡ酶切位点,引物见表1。扩增片段分别与 pMD19-T 载体进行连接,测序正确后进行 MluⅠ 和 BglⅡ双酶切,回收酶切片段并连接到同样酶切过的pGL3-Basic 载体的多克隆位点内,构建含[WTBX][STBX]IL-6[WTBZ][STBZ]基因5′调控序列的重组质粒。重组质粒经酶切和测序进一步鉴定。
1.7细胞培养及转染
用含10%胎牛血清、青霉素 100 IU/mL和链霉素100 IU/mL 的DMEM培养液于37 ℃、5% CO2、饱和湿度条件培养兔肾细胞RK-13。将RK-13在前1 d接种于24孔板,待细胞达80%~90%汇合度时进行转染[6]。
按照Roche 公司转染试剂 FuGENE HD操作说明配制转染混合物进行转染。24孔板每孔转染混合物:FuGENE HD 2 μL;DNA 0.5 μg(pGL3-IL-6 重组质粒与 PRL-TK内参照质粒的质量比为25 ∶[KG-*3]1)。同时设定 pGL3-Basic 载体转染组(阴性对照组),启动子不同片段的荧光素酶表达载体转染组(试验组),每组设置3个重复。转染48 h后收获细胞。
1.8荧光素酶报告基因活性检测
双荧光素酶活性检测按照双荧光素酶报告基因分析系统(Promega公司)操作说明进行。在转染48 h后,弃去培养液,用1×PBS液洗涤细胞2次。每孔加入100 μL 1×PLB细胞裂解液,室温孵育20 min充分裂解细胞。取20 μL裂解液加入96孔白板,然后加入LARⅡ100 μL,快速混匀后立即在BHP9504微孔板发光分析仪上检测pGL3荧光素酶活性(F值);再加入100 μL 1×Stop&Glo溶液检测pRL-TK荧光素酶活性(R值)。以pGL3 荧光素酶活性与pRL-TK 荧光素酶活性的比值即相对荧光强度(relative luciferase activity,RAL)表示各组转录活性。计算各组F/R值,即荧光素酶的相对活性RAL。RAL 的数值为3次重复试验的结果。
1.9数据分析
计量数据以“平均值±标准差”表示,运用SPSS 13.0统计学软件进行数据分析,统计学分析方法采用t检验(P≤0.05)。
2结果与分析
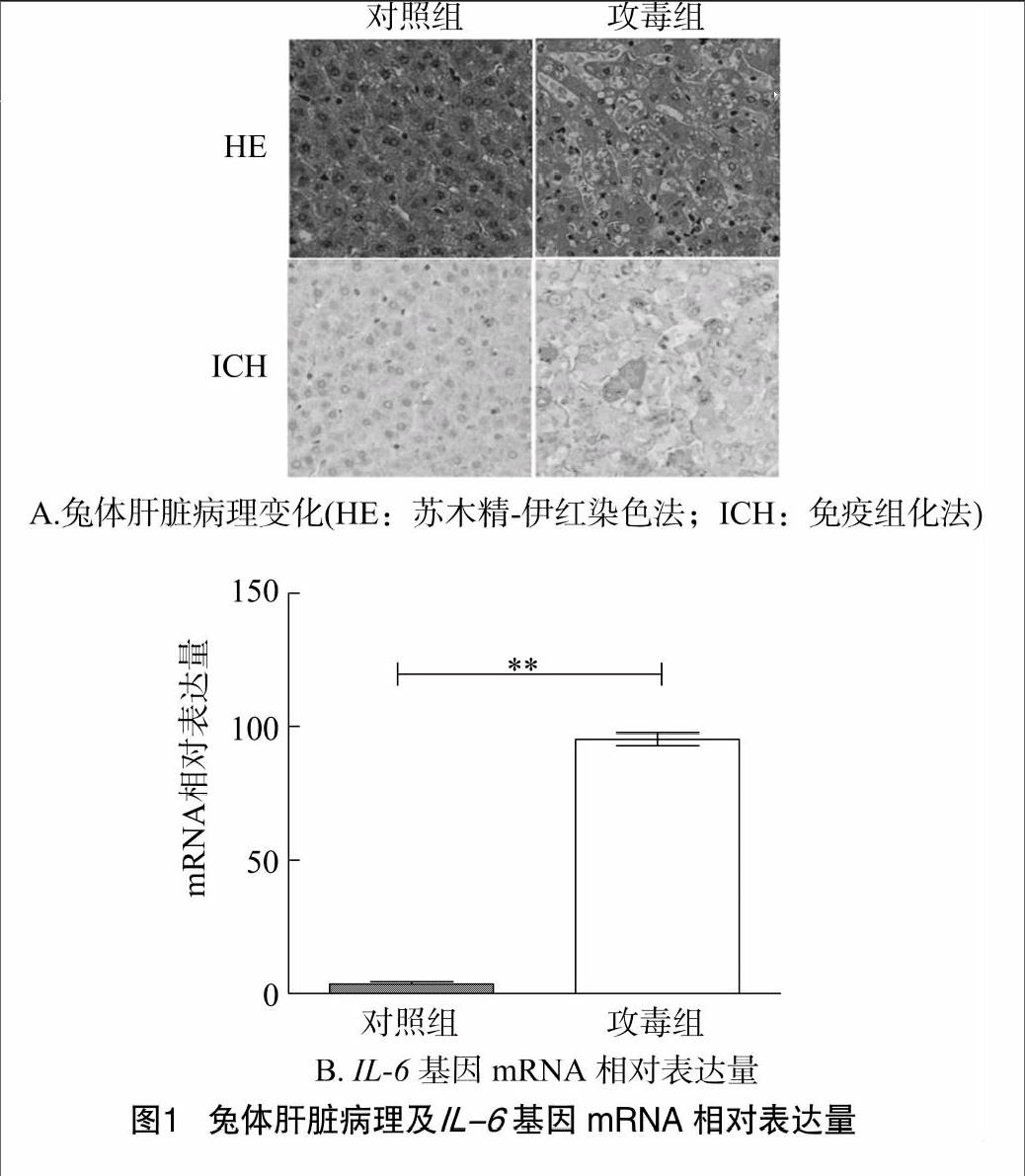
2.1肝脏组织病理变化及IL-6 mRNA表达水平测定
如图1-A所示,相比于对照组,兔出血症病毒感染兔体48 h以后,肝脏组织中能够检测到病毒,同时感染组会出现严重的肝损伤,如肝脏细胞的崩解等;同时利用Real-time PCR检测,发现IL-6 mRNA水平明显升高(图1-B)。
2.2基因启动子的克隆测序
以兔基因组DNA为模板,采用巢式PCR扩增,经3次PCR扩增出约750 bp的特异性片段(图2),将其基因启动子PCR扩增产物克隆至pMD19-T载体中,筛选阳性重组质粒,经酶切鉴定正确后进行测序。测序结果表明,兔[WTBX][STBX]IL-6[WTBZ][STBZ]基因启动子PCR扩增片段长度为763 bp(图3-A)。
[FK(W12][TPLX2.tif][FK)]
2.3[WTBX][STBX]IL-6[WTBZ][STBZ]基因启动子的生物信息学分析
经Blast序列比对发现,克隆得到的[WTBX][STBX]IL-6[WTBZ][STBZ]基因5′侧翼序列与GenBank公布的人[WTBX][STBX]IL-6[WTBZ][STBZ]基因启动子相似性达90%以上。此序列包括转录起始位点(+1)上游714 bp;在线预测软件分析表明,[WTBX][STBX]IL-6[WTBZ][STBZ]基因启动子具有典型的真核生物启动子元件,如AP-1、CREB/NF-IL6、NF-κB和TATA-box等(图3-B)。
2.4[WTBX][STBX]IL-6[WTBZ][STBZ]基因启动子缺失片段报告基因重组体的构建和活性分析
如图4-A所示,以含有[WTBX][STBX]IL-6[WTBZ][STBZ]基因启动子序列的PMD19-T载体为模板,克隆得到启动子的不同长度缺失片段[CM(25]。不同长度的启动子PCR产物经MluⅠ和 BglⅡ双酶切[CM)]
[FK(W39][TPLX3.tif][FK)]
后,与同样进行双酶切的pGL3-Basic载体进行连接,构建启动子报告基因重组体,经测序正确。
将构建好的[WTBX][STBX]IL-6[WTBZ][STBZ]基因启动子缺失片段重组质粒分别转染至RK-13细胞中,同时转入内参质粒pRL-TK,通过检测萤火虫荧光素酶与海参荧光素酶活性的比值,来反映不同启动子片段的活性。每次转染均设阴性对照组。启动子活性分析(图4)表明,与转染pGL3-Basic对照组相比,[WTBX][STBX]IL-6[WTBZ][STBZ]基因启动子报告基因重组质粒pGL3-IL-6启动子活性最高。pGL3-100活性最低。而pGL3-400、pGL3-250、pGL3-170和pGL3-100活性依次降低(图4-B)。以上结果表明,AP-1、CREB/NF-IL6和NF-κB几个转录元件在[WTBX][STBX]IL-6[WTBZ][STBZ]基因的转录调控中均有着重要作用。
[FK(W21][TPLX4.tif][FK)]
3讨论
白细胞介素-6(interleukelin-6,IL-6)是具有多种生物学活性的细胞因子,也是机体复杂的细胞因子网络中的关键因子,具有调节其他细胞因子的作用[1],在发生炎症、坏死或由于肿瘤细胞抗原刺激免疫细胞分泌IL-6增高等情况下,血清中IL-6增加,过量表达IL-6往往与某些疾病相关。在兔出血症病毒感染兔体后,会引起[WTBX][STBX]IL-6[WTBZ][STBZ]基因的表达量明显升高,这或许与兔出血症病毒的致病性有关[4,7]。
本研究主要利用基因步移技术克隆获得IL-6的启动子,为进一步分析[WTBX][STBX]IL-6[WTBZ][STBZ]基因的转录调控奠定基础。目前在研究真核生物启动子的结构与功能时,主要应用的是瞬时转染法,瞬时转染分析是将构建好的外源DNA与双报告基因的重组质粒通过脂质体导入(转染)到特定细胞并使之表达,通过检测报告基因的表达活性来确定所导入各片段的活性,从而确定目的基因转录起始所必需的核心启动子区。本研究克隆所得到兔[WTBX][STBX]IL-6[WTBZ][STBZ]基因启动子与人[WTBX][STBX]IL-6[WTBZ][STBZ]基因启动子高度保守,尤其是AP-1、CREB/NF-IL6和NF-κB等几个转录调控元件几乎一致,进一步证实了我们克隆得到的该基因序列的准确性[8]。经缺失体构建及启动子活性分析表明,兔IL-6启动子活性的调控与AP-1、CREB/NF-IL6和NF-κB有关[9-12]。AP-1和CREB/NF-IL6及NF-κB等元件已经报道在人IL-6启动子活性调控中也有着重要作用[13]。因此,该研究为深入了解IL-6调控机制,进一步探究兔出血症病毒致病机制奠定了基础。
[HS2][HT8.5H]参考文献:[HT8.SS]
[1][ZK(#]Liu X,Fan B,Bai J,et al. The N-N non-covalent domain of the nucleocapsid protein of type 2 porcine reproductive and respiratory syndrome virus enhances induction of IL-10 expression[J]. J Gen Virol 2015,96:1276-1286.
[2]Legerlotz K,Jones E R,Screen H R,et al. Increased expression of IL-6 family members in tendon pathology[J]. Rheumatology,2012,51:1161-1165.
[3]Murakami M,Arima Y,Hirano T. IL-6 signal transduction and its physiological roles[J]. Nihon Rinsho,2012,70(Suppl 8):192-206.
[4]Teixeira L,Marques R M,Aguas A P,et al.Regulatory T cells are decreased in acute RHDV lethal infection of adult rabbits[J]. Vet Immunol Immunopathol,2012,148:343-347.
[5]Song Y,Wang F,Fan Z,et al. Identification of novel rabbit haemorrhagic disease virus B-cell epitopes and their interaction with host histo-blood group antigens[J]. J Gen Virol,2016,97(2):356-365.
[6]Zhu J,Wang B,Miao Q,et al. Viral genome-linked protein (VPg) is essential for translation initiation of rabbit hemorrhagic disease virus (RHDV) [J]. PLoS One,2015,10:e0143467.
[7]Marques R M,Costa E S A,Aguas A P,et al. Early inflammatory response of young rabbits attending natural resistance to calicivirus (RHDV) infection[J]. Vet Immunol Immunopathol,2012,150:181-188.
[8]Meszaros E C,Dahoud W,Mesiano S,et al. Blockade of recombinant human IL-6 by tocilizumab suppresses matrix metalloproteinase-9 production in the C28/I2 immortalized human chondrocyte cell line[J]. Integr Mol Med,2015,2:304-310.
[9]Baris S,Akyurek O,Dursun A,et al. The impact of the [WTBX][STBX]IL-1β,IL-1Ra,IL-2,IL-6 and IL-10[WTBZ][STBZ] gene polymorphisms on the development of Behcets disease and their association with the phenotype[J]. Med Clin,2015.
[10][ZK(#]Kasperska-Zajac A,Grzanka A,Damasiewicz-Bodzek A. IL-6 transsignaling in patients with chronic spontaneous urticaria[J]. PLoS One,2015,10:e0145751.
[11]Mekuria S L,Debele T A,Chou H Y,et al. IL-6 antibody and RGD peptide conjugated poly(amidoamine) dendrimer for targeted drug delivery of hela cells[J]. J Phys Chem B,2016,120:123-130.
[12]Onuora S. Cytokines in disease:Genetic variation affects IL-6 response in synovial fibroblasts[J]. Nat Rev Rheumatol,2016,12:2-22.
[13]Zhu J,Jiang L,Liu Y,et al. MAPK and NF-kappaB pathways are involved in bisphenol A-induced TNF-alpha and IL-6 production in BV2 microglial cells[J]. Inflammation,2015,38:637-648.

