一种快速提取微藻完整叶绿体及其DNA的方法
潘远健++金刚++谢振华++代建国+++王妍++栾崇林++于化泓
摘要:利用高盐结合SDS裂解法,对杜氏盐藻、湛江叉鞭金藻、球等鞭金藻叶绿体及其DNA进行分离和提取。经超声波匀浆后差速离心,可获得比较完整的叶绿体,再经有机试剂萃取,可得到产率较高、纯度较好的叶绿体DNA,经PCR扩增得到清晰的条带。本试验方法快速简便,DNA质量可以满足后续分子生物学操作需要。
关键词:微藻;叶绿体;叶绿体DNA;提取方法
中图分类号: Q244;S917文献标志码: A文章编号:1002-1302(2016)02-0066-03
收稿日期:2015-01-15
基金项目:广东省深圳市科技项目(编号:JC201005280534A、JCY20130331151022276);广东省自然科学基金(编号:10151805501000007)。
作者简介:潘远健 (1987—),男,广西梧州人,硕士研究生,从事基因调控研究。E-mail:wenrenzhiying@163.com。
通信作者:金刚,博士,教授,主要从事水生生物学研究。E-mail:jingang@szpt.edu.cn。叶绿体是绿色植物进行光合作用的细胞器。20世纪初,学者根据植物叶片的花斑现象具有母性遗传的特性,推断在叶绿体上或许存在核外的遗传因子。20世纪60 年代初,随着电镜技术与分子生物学技术的发展,叶绿体基因组的存在由Gupta等证实[1]。目前,叶绿体DNA(cpDNA)被广泛应用于细胞质遗传、植物系统发育、植物雄性不育、亲缘关系、叶绿体转基因等研究中。微藻作为水体生态系统重要的初级生产者及潜在的外源基因表达载体,研究其叶绿体和cpDNA功能、结构特征,对于叶绿体表达体系构建具有重要作用。因此,快速、简便地获得质纯、量大cpDNA是许多工作的前提。目前,获得微藻完整叶绿体和纯度高、浓度大的微藻cpDNA存在一定困难,主要原因是微藻种类繁多,每种微藻有其生物学特点,缺乏通用方法;叶绿体DNA含量较少,在提取过程中存在诸多干扰因素 (核DNA、RNA、蛋白质等)。
提取植物cpDNA的传统方法有CsCl2梯度离心及DNaseⅠ结合蔗糖梯度离心等,这些方法操作较繁琐,不易同时获得理想的产率、纯度。20世纪80年代至今,在非藻类植物叶绿体提取、微藻叶绿体分离技术等方面研究成果较多[2-9]。本研究在前人研究的基础上作了一些改进(如离心时间和速度、藻体破碎方法、叶绿体破碎时间、DNA分离时的离心速度和时间等),提取杜氏盐藻(Dunaliella salina)、湛江叉鞭金藻(Dicrateria Zhanjiangensis)、球等鞭金藻(Isochrysis galbana)的完整叶绿体,结果较为满意。
1材料与方法
1.1材料
杜氏盐藻、湛江叉鞭金藻、球等鞭金藻由笔者所在实验室培养。
1.2试剂配制[7]
缓冲液A:400 mmol/L蔗糖、50 mmol/L Tris-HCl(pH值 8.0)、20 mmol/L EDTA-Na2、0.2% BSA、0.2%巯基乙醇(现用现加);缓冲液B:400 mmol/L蔗糖、50 mmol/L Tris-HCl (pH值 8.0)、0.1% BSA;缓冲液C:1.25 mol/L NaCl、50 mmol/L EDTA、50 mmol/L Tris-HCl(pH值 8.0);缓冲液D:100 mmol/L Tris-HCl(pH值 7.8)、50 mmol/L EDTA、100 mmol/L NaCl、0.2%巯基乙醇(现用现加)。试验所用试剂蛋白酶K、DNase Ⅰ、DNA Maker等购于宝生物工程(大连)有限公司。
1.3分离叶绿体和提取cpDNA[9]
把生长到对数期的微藻置于0~4 ℃暗处理24 h。将暗处理后的500 mL藻液分装到50 mL离心管中,4 ℃下 5 500 r/min 离心2 min收集藻细胞(沉淀),弃上清。往以上所得沉淀加入30 mL缓冲液A,冰上破碎1.5 min得藻体破碎液。将藻体破碎液用6层滤网(300目)过滤,滤液倒入离心管中,4 ℃ 1 000 r/min离心20 min,收集上清。将上清液在4 ℃ 4 000 r/min离心20 min,弃上清,将沉淀保存于4 ℃冰箱备用。DNA酶去核处理:往上一步所得沉淀中加入200 μL 缓冲液B、2.5 μL DNase-Ⅰ、40 μL 0.2 mol/L MgCl2,37 ℃静置15 min。加入200 μL 0.4 mol/L EDTA-Na2,再加入缓冲液C,4 ℃ 4 000 r/min离心20 min,弃上清。在上一步所得沉淀中加入600 μL 预冷的缓冲液D,30 μL 20% SDS(终浓度1%),2.5 μL 蛋白酶K(始浓度为1 mg/mL),60 ℃水浴2 h。冷却后加入等体积的酚 ∶氯仿 ∶异戊醇(25 ∶24 ∶1)混合液,4 ℃ 10 000~12 000 r/min离心10 min,取上清。上清液加入等体积的氯仿:异戊醇= 24 ∶1,4 ℃ 10 000~12 000 r/min离心10 min,取上清。上清加入1/5体积的3 mol/L NaAc及2倍体积预冷的无水乙醇,-80 ℃放置1 h,然后4 ℃下12 000 r/min离心10 min,弃上清。加入预冷的75% 乙醇,10 000 r/min离心10 min洗涤1~2次(此步骤要特别小心,重悬DNA时动作要轻缓。操作太剧烈会机械断裂cpDNA)。倒立EP管,自然晾干或置于超净台风干。加入30~40 μL 1×TE,-20 ℃保存。
1.4蔗糖密度梯度法分离球等边金藻、杜氏盐藻叶绿体DNA
参考曲京东的蔗糖梯度离心法[9]分离球等边金藻、杜氏盐藻叶绿体DNA,其中2个蔗糖梯度分别为40%、60%。采用紫外分光光度法检测cpDNA的浓度、纯度。
1.5叶绿体rps2基因、rbcL基因片段的扩增
为了验证所提取的cpDNA质量,参照NCBI上收录的杜氏盐藻rps2基因、球等鞭金藻rbcL基因序列设置2对引物:rps1:5′-AGCAAGACGAATACGAGT-3′,rps2:5′-TTTACGACAATTATACCG-3′;rbcL1:5′-AAGCCTCTAATGCAACAC-3′,rbcL2: 5′-CCACAAACTGAAACGAAA-3′。分别以所提取的杜氏盐藻、球等鞭金藻的cpDNA为模板,进行PCR扩增。反应体系如表1所示。
同时设置1个阴性对照,验证提取的cpDNA有无基因组DNA污染。利用盐藻基因组DNA的特异引物对:前:5′ -TGAGCCTGTGCGTGTTTC- 3′;后:5′ -GGTGTCTTGCGTGAGTG -3′,并以所提取的cpDNA、基因组DNA作为模板(表2)。
2结果与分析
2.1叶绿体显微观察
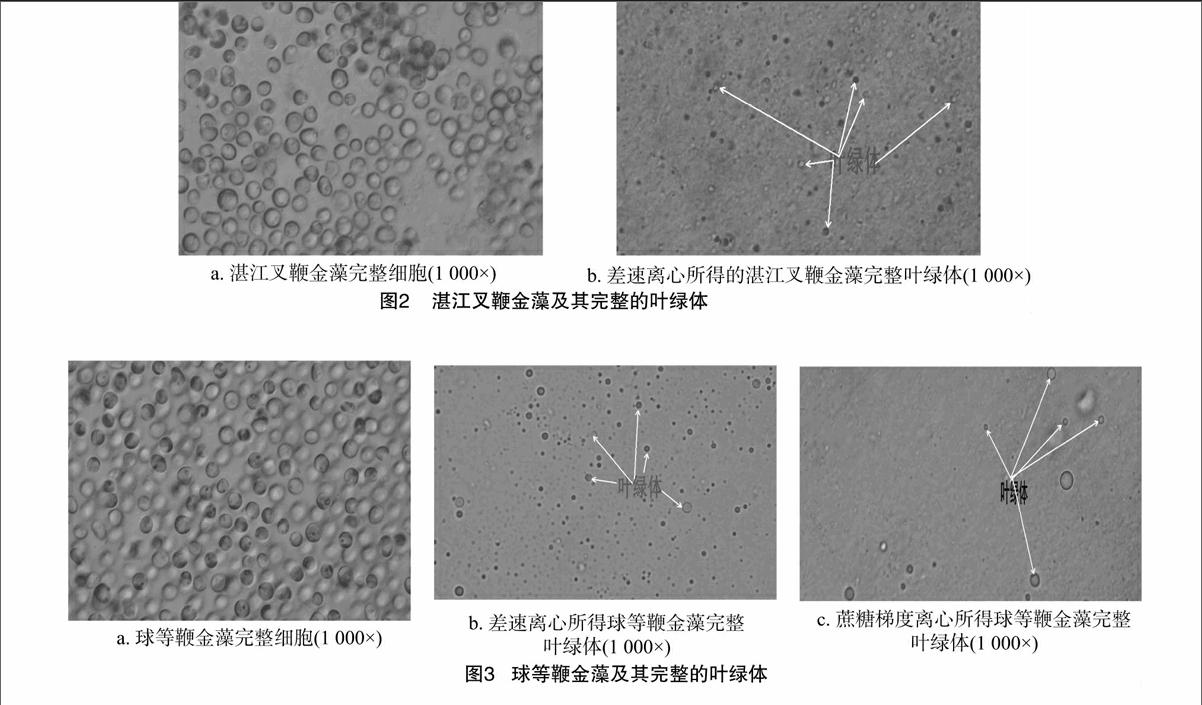
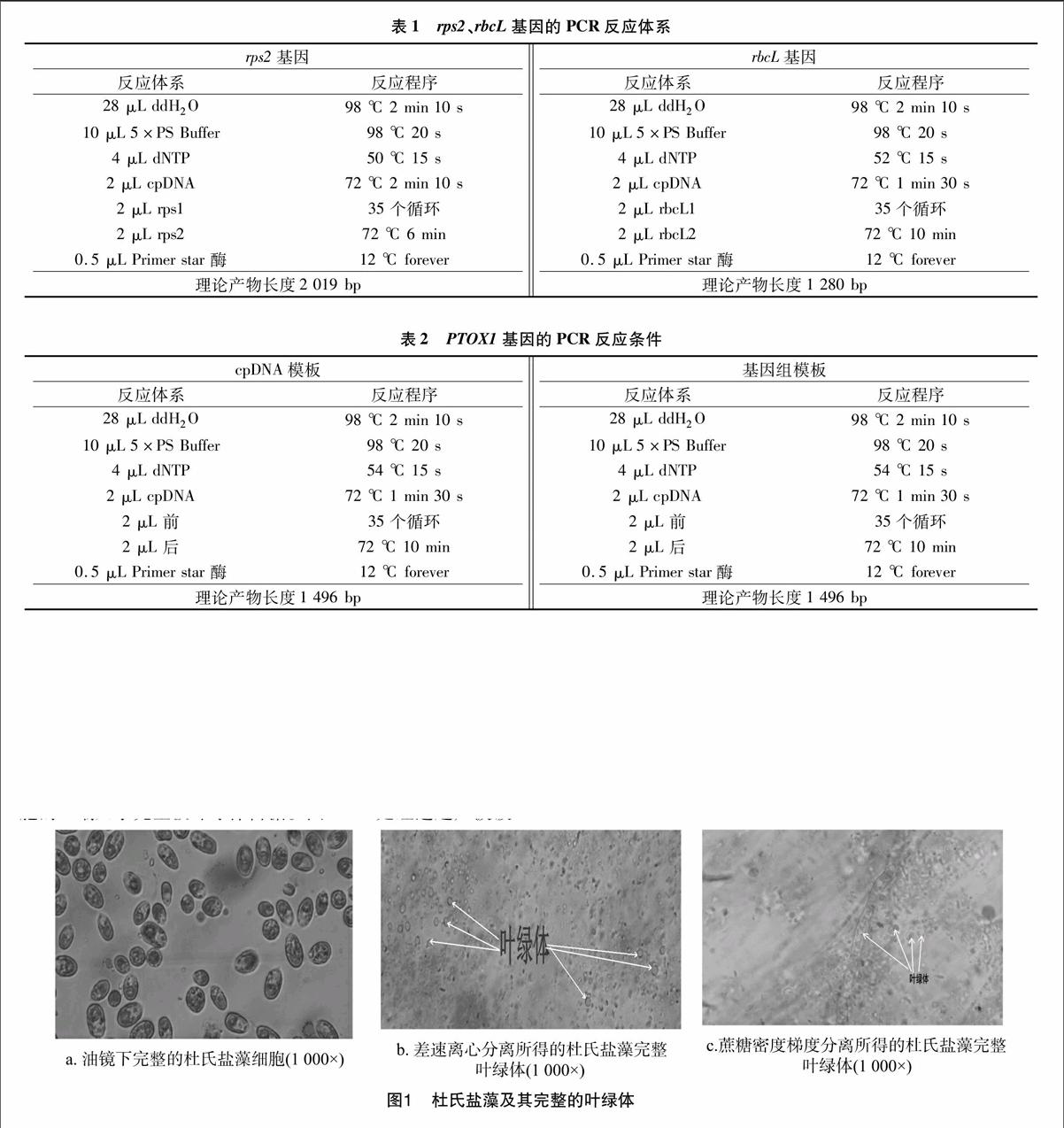
在叶绿体提取的不同阶段进行显微观察,以确定不同阶段叶绿体形态的变化。图1-a是光学显微镜下完整的杜氏盐藻细胞,其形态呈梭形或球形,随其运动的改变而改变,细胞的一端几乎完全被叶绿体占据。图1-b是经过超声波破碎和差速离心后分离得到的杜氏盐藻完整叶绿体,在叶绿体周围可以看到光晕,说明所得叶绿体比较完整,外膜没有被破坏。图1-c为蔗糖密度梯度离心所得叶绿体。图2-a为湛江叉鞭金藻完整细胞,图2-b是湛江叉鞭金藻完整的叶绿体。图3-a为球等鞭金藻完整细胞,图3-b、图3-c分别是球等鞭金藻完整叶绿体。
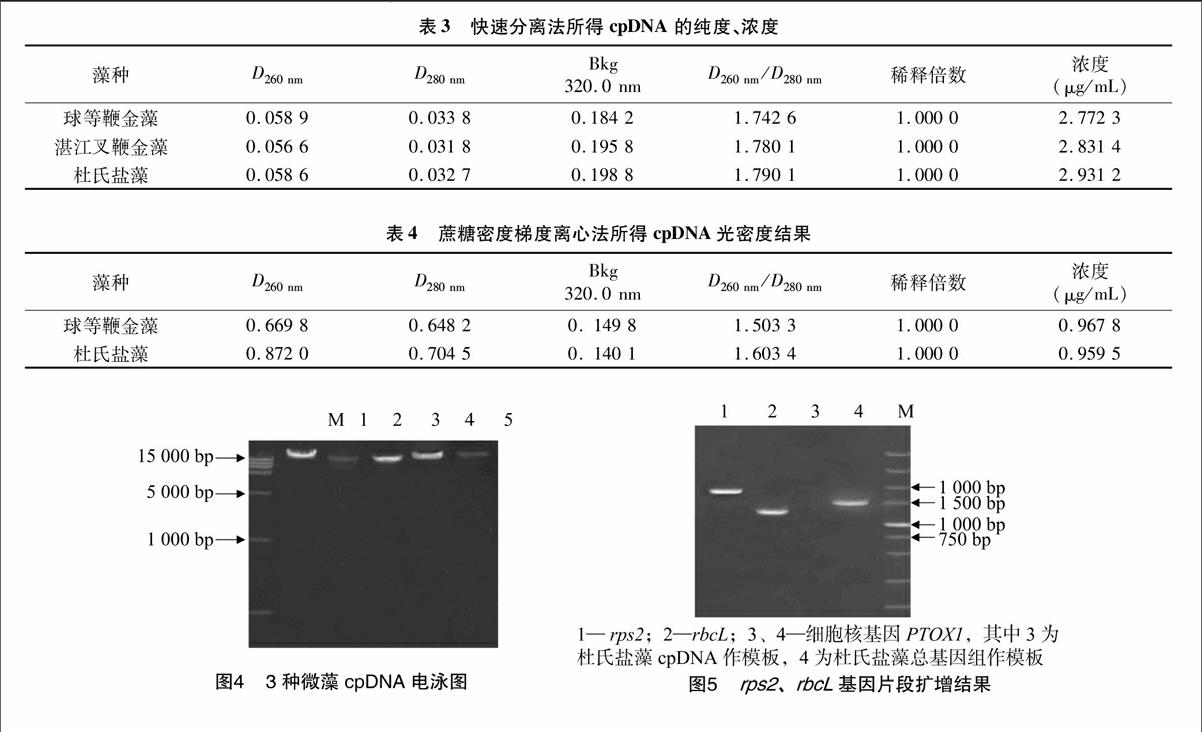
2.2cpDNA的电泳检测
将2种方法提取的3个不同海水藻提到的cpDNA进行0.7%琼脂糖凝胶电泳(110 V/mL,40 min,8 μL ),得到整齐干净的条带,如图4所示。M为maker;1、3、4分别为差速离
心所提取的杜氏盐藻cpDNA、球等鞭金藻cpDNA、湛江叉鞭金藻cpDNA;2、5分别为蔗糖梯度离心所得杜氏盐藻cpDNA、球等鞭金藻cpDNA。
2.3分光光度计检测cpDNA的浓度和纯度
表3为快速分离法所得cpDNA纯度、浓度,表4为蔗糖密度梯度离心法所得cpDNA光密度结果。由表3可知,快速差速离心抽提到的cpDNA浓度约2.80 μg/mL,D260 nm/D280 nm接近1.8,说明其含量及纯度都较为理想,可用于后续分子操作。由表4可知,蔗糖密度梯度离心法提取的cpDNA浓度约1.00 μg/mL,D260 nm/D280 nm约1.6,这可能跟含有色素杂质等有关。
2.4叶绿体rps2基因、rbcL基因片段的扩增
rps2、rbcL基因基因都在目的片段长度处显示出整齐干净的条带(图5),第3泳道没有明显的条带,与预期结果一致。3结论与讨论
开始分离叶绿体之前,把藻液在黑暗下低温静置24 h,可以降低叶绿体中淀粉的含量,减少淀粉核对叶绿体膜的破坏性,有利于分离得到完整的叶绿体[9]。经差速离心以后分离到的叶绿体样品纯度虽然相对很高,但是仍有来自细胞核的污染。因此,本试验在保持叶绿体不破碎的前提下(低温下完整叶绿体比较稳定),在叶绿体样品中加入DNase Ⅰ并于37 ℃静置15 min以去除来自核DNA的潜在污染。在裂解叶绿体时先充分重悬,再加入SDS,可提高叶绿体破碎效果,提高cpDNA得率。本研究结果表明,蔗糖梯度密度分离的叶绿体及其cpDNA浓度都比较低,此外,还存在着2个不同浓度的蔗糖缓冲液混合时间过长就会相溶在一起,提取的叶绿体层面比较窄,叶绿体得率低的弊端。PTOX1基因在以cpDNA为模板时没有明显的条带,说明所得DNA纯度比较高。
参考文献:
[1]Gupta R,Golding G B. The origin of the eukaryotic cells[J]. Trends in Biochemical Sciences,1996,21(5):166-171.
[2]Bookjans G,Stummann B M,Henningsen. Preparation of chloroplast DNA from pea plastids isolated in a medium of high ionic strength[J]. Anal Biochem,1984,141:244-247.
[3]高洁,孔繁瑞,李继耕. 油菜细胞质雄性不育系叶绿体DNA特异片段的分子克隆[J]. 遗传学报,1987,14(5):337-343.
[4]赵衍,翁醒华,邹勤,等. 水稻叶绿体基因文库的构建和精细限制图谱的制作[J]. 遗传学报,1991.18(2):149-160.
[5]龚小松,阎隆飞. 高等植物叶绿体DNA提纯方法的改进[J]. 科学通报,1991,36(6):467-469.
[6]崔彬彬,李云,冯大领,等. 杨树叶绿体分离及叶绿体DNA提取方法的研究[J]. 保定师范专科学校学报,2006,19(2):25-27.
[7]袁进成,贾树利,刘颖慧. 一种快速提取谷子叶绿体DNA的方法[J]. 河北北方学院学报:自然科学版,2008,24(5):22-24.
[8]Rowan B A,Bendich A J. Isolation,quantification,and analysis of chloroplast DNA[J]. Methods Mol Biol,2011,774:151-170.
[9]曲京东. 杜氏盐藻完整叶绿体的分离和叶绿体转化体系的构建[D]. 郑州:郑州大学,2007.翟立红,周兰庭,韩鹏,等. 玉米穗行数基因的QTL定位与分析[J]. 江苏农业科学,2016,44(2):69-72.

