葡萄糖对水稻幼苗根系生长和生长素组织细胞分布的影响
陈豆豆++杨飞+++蔡凤香+++郑欣++张思韬+++赵凤云

摘要:利用DR5-GUS转基因水稻(Oryza sativa L.)中花 11 号为材料,分析了 0~5% 的葡萄糖和甘露醇处理 4~10 d 对水稻幼苗根系生长和生长素组织细胞分布的影响。结果表明,3%的葡萄糖有利于水稻根系生长,缺糖在幼苗生长后期显著抑制了根系的生长,5%葡萄糖显著延迟侧根的形成和生长。通过根尖横切片发现,生长素在组织细胞间的基本分布规律,即根冠和分生区细胞中生长素多且分布比较均匀,从伸长区到成熟区逐渐呈现梯度分布,成熟区中生长素主要分布在近表皮的皮层细胞和表皮细胞。不同浓度葡萄糖对生长素在根尖各区组织细胞间的梯度分布规律没有明显影响,但随葡萄糖浓度升高根尖各区生长素含量逐渐升高。相同浓度条件下,甘露醇明显抑制根系的生长并引起生长素的过量积累。试验结果表明,葡萄糖对水稻根系生长的调节与其信号作用有关而非渗透作用引起的,且这种信号作用与其调节生长素的合成和分布有一定关系。
关键词:葡萄糖;生长素分布;水稻根系
中图分类号: S511.01文献标志码: A文章编号:1002-1302(2016)02-0101-04
收稿日期:2015-01-28
基金项目:山东省自然科学基金(编号:ZR2014DM010、ZR2015CL009);山东省淄博市科技发展计划(编号:111089、113106)。
作者简介:陈豆豆(1992—),男,湖南衡阳人,主要从事分子生物学研究。
通信作者:赵凤云,博士,教授,主要从事分子生物学研究。E-mail:zfy1226@126.com。根系是作物吸收水分和营养物质的重要器官。水稻的根系属于须根系,包括初生根 (种子根)、不定根及其侧根。根系的生长发育状况是由其内部遗传因子和外界环境因子共同调控的[1]。土壤和植物本身的营养条件在植物根系的生长发育过程中具有决定性的作用。糖是植物体内重要的营养物质、能源物质和调节分子,在植物的生命活动过程中具有重要作用[2]。它参与植物营养器官和繁殖器官生长发育、代谢及胁迫应答等众多过程的调节[3]。葡萄糖(glucose,G)是植物体内主要的糖源之一。近年来,就 G 在植物生长发育中的信号作用进行了研究,如不同浓度的 G 对根的形成和生长发育的调节存在差异,缺糖导致根系生长停滞、引起代谢和基因表达的变化,当 G 浓度高于5% 时则抑制根系的生长[4]。还有研究发现,高糖使叶片增大和增厚并且促进不定根的形成[5]。在水稻中发现一种短根突变体(srt5),该突变体在种子萌发期间根的伸长受到抑制,当添加外源 G 后能解除这种抑制作用,但用外源甘露醇处理则无作用,说明水稻根的生长与糖有关[6]。生长素是植物体内调控植物生长发育的关键激素之一,是调节不定根与侧根形成和发育的重要信号分子。在植物生长发育过程中生长素的极性运输和局部积累形成的时空梯度对器官的形成和生长至关重要[7]。研究表明,在植物根系生长发育过程中 G 和生长素信号存在交互作用[8],G 通过依赖于HXK1 代谢途径与生长素相互作用调控植物的生长发育[3]。利用拟南芥研究发现 G 通过影响生长素合成、运输及应答基因家族基因的表达与生长素信号发生相互作用,进而调节其根系的生长发育。G 浓度调节生长素极性运输,缺糖使生长素极性运输和积累减少,导致植物生长缓慢以致停滞[4]。G 调节生长素的合成与代谢,从而影响生长素的积累[9]。对玉米的研究也发现,G 调节其生长素合成基因ZmYUCCA的表达,说明 G 和生长素之间有密切关系[10]。笔者在前期报道了 G 在锌诱导根系生长中的作用[11]。目前,关于 G 在水稻幼苗根系发育过程中作用研究较少。本试验旨在通过分析 G 对水稻根系生长发育和生长素分布的影响,在生理水平上明确 G 与生长素信号在调节根系生长过程中的相互关系。1材料与方法
1.1材料与处理
以DR5-GUS 转基因水稻(Oryza sativa L.)中花 11 号 为材料,挑选籽粒饱满的种子去壳后消毒:75% 乙醇(30 s)、0.1% 氯化汞(15 min)、2% 次氯酸钠(20 min),用无菌水洗净。将种子分别植入含0、3%、5% 葡萄糖(glucose,G)和3%、5% 甘露醇 (mannitol,M)的MS 培养基上,置于培养箱内(光周期为14 h光照,光照强度为 200 μmol/(m2·s),温度 26 ℃,夜间10 h,温度 20 ℃;相对湿度为 50%~60%) 培养4~10 d后进行数据统计与分析。
G与生长素合成和运输对初生根生长的影响:在含0、3%、5% G 的MS培养基上分别添加10-8 mol IBA、10-6 mol TIBA,在上述同样条件下处理8 d。以上每种处理至少做3次重复,每次设置3个平行处理,每个重复用50株幼苗。
1.2根系生长统计
对根系生长的指标进行统计,包括初生根的长度及其侧根的数量和长度;不定根的数量、长度及其侧根的长度和数量。每个指标共统计60株(每个重复20株)。
1.3生长素时空分布的测定
通过GUS 活性测定对根系生长素的分布和积累进行分析,参照Petersson 等的方法[7]。根尖各区组织细胞生长素分布的测定,待GUS染色后取根尖连续切片,切片厚约 0.5 mm。
1. 4数据处理
用SPSS软件对试验数据进行处理,求出3次重复试验的平均值和标准误差。利用单因子方差分析不同处理之间的差异。
2结果与分析
2.1不同浓度葡萄糖对水稻根系生长的影响
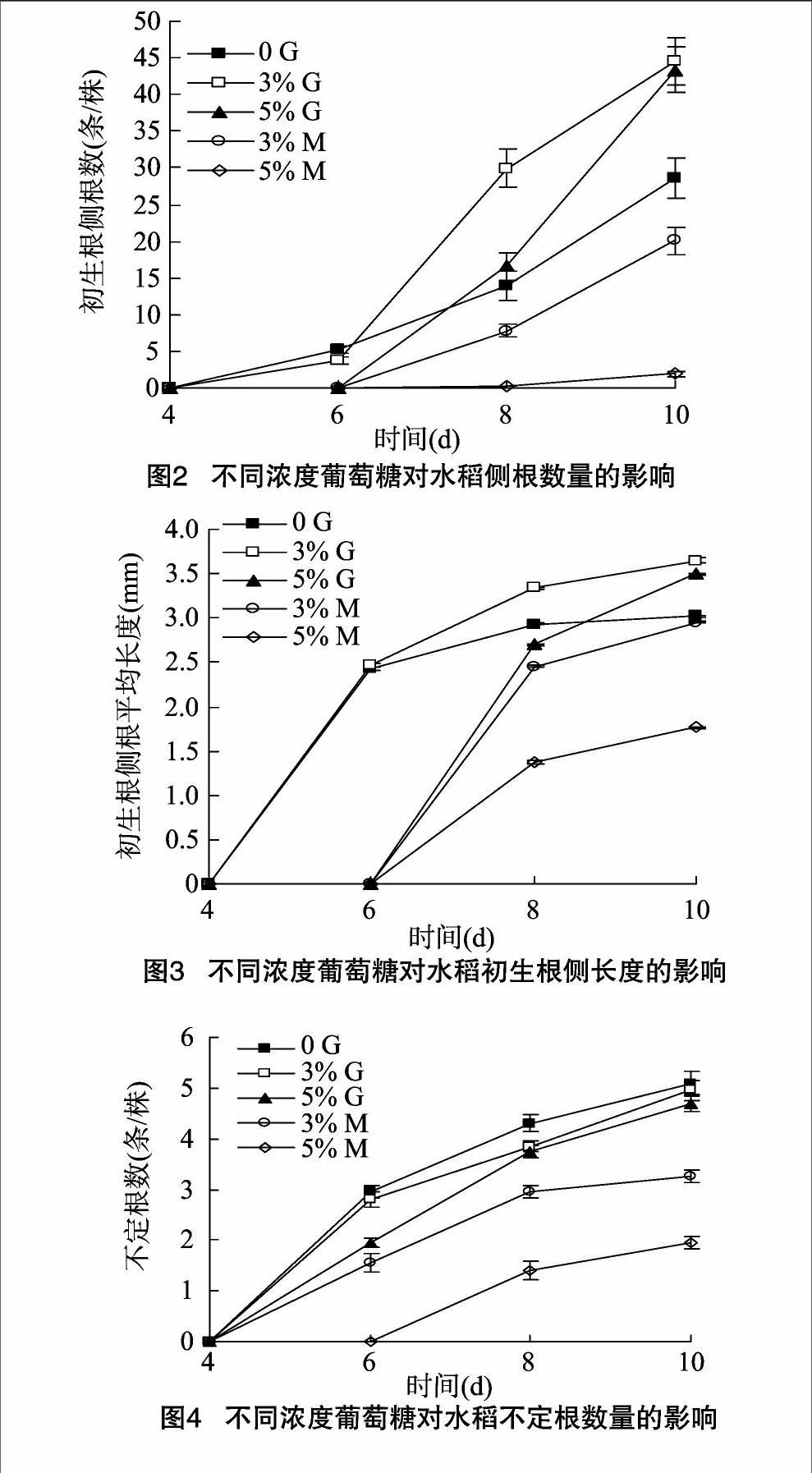
2.1.1不同浓度葡萄糖对水稻初生根长度的影响从图1可以看出,3%葡萄糖处理8 d后的幼苗初生根长度极显著大于0 G处理,但与5% 的G处理间差异不显著。0 G处理8 d后初生根的伸长生长基本停止。相同浓度条件下甘露醇 (M)处理明显抑制初生根的生长。
2.1.2不同浓度葡萄糖对水稻侧根数量的影响3% G处理8 d后的初生根侧根数目明显比0 G处理的多,而与5% G处理的相比,则差异不显著。相同浓度M处理的水稻的初生根侧根数目显著比G处理的少。M处理与5% G处理延迟初生根上侧根的形成 (图2)。
2.1.3不同浓度葡萄糖对水稻初生根侧根长度的影响从图3可以看出,0 G和 3% G处理的幼苗初生根上的侧根在4 d后快速生长,但8 d后基本停止。其他处理的侧根在6 d后快速生长,后期生长速度减缓。处理10 d时,3% G处理的幼苗初生根上的侧根的长度比0 G处理的显著增长。相同浓度处理下,M显著抑制初生根上侧根的生长。
2.1.4不同浓度葡萄糖对水稻不定根数量的影响不同浓度G处理条件下不定根的数目无显著差异。与G处理相比,5% M处理极显著减少了水稻不定根的数目(图4)。
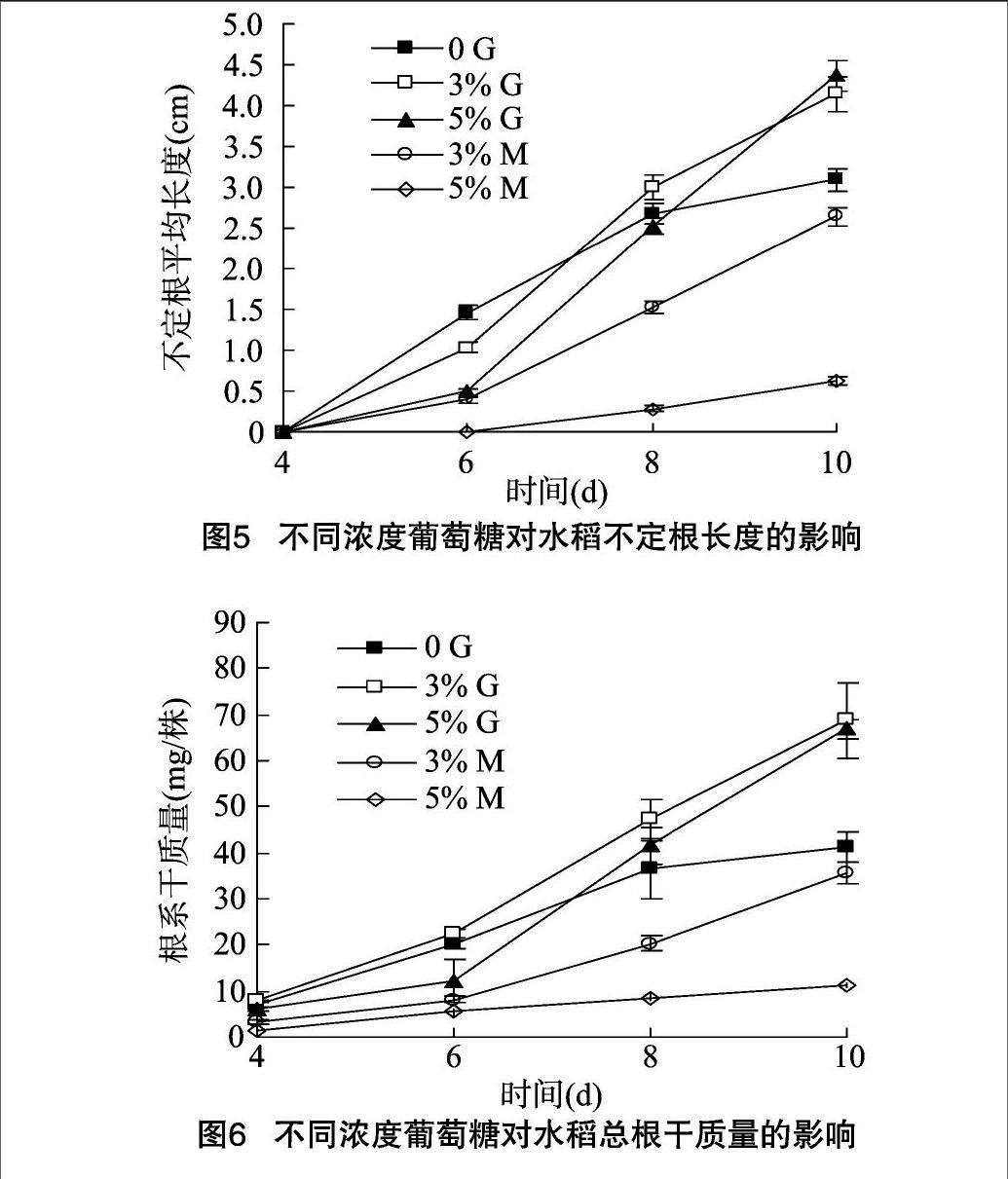
2.1.5不同浓度葡萄糖对水稻不定根长度的影响水稻幼苗用 3% G处理10 d后其不定根的长度显著大于 0 G处理的(图5),而与5% G处理的无显著差异。与其他处理相比,5% M处理极显著抑制了不定根的生长。
2.1.6不同浓度葡萄糖对水稻总根干质量的影响就根系总干质量而言,水稻幼苗处理10 d后,3% G和5% G处理的水稻根系干质量类似(图6),这2种处理的根系干质量极显著高于其他3种处理。
2.1.7不同浓度葡萄糖对水稻不定根上侧根数量和长度的影响本试验中只有 0 G和3% G在处理8~10 d时不定根
上有侧根,与0 G相比,3% G显著促进了水稻不定根侧根数目的增多,但就侧根长度来说二者之间差异不显著。其他处理在试验期间无可见侧根。表明M和5% G抑制不定根上侧根的生长和发育。
2.2葡萄糖对水稻根尖生长素积累和分布的影响
2.2.1不同处理时间对水稻初生根根尖生长素积累和分布的影响从图7可以看出,处理 4 d 时整个根尖生长素含量比处理 6 d 的高,且二者之间生长素分布存在差异,处理4 d生长素集中在整个分生区和伸长区,处理6 d生长素主要集中在分生区和伸长区的后端。不同浓度 G 处理条件下生长素的分布方式类似,但生长素的含量随糖浓度的升高而增加,缺糖导致伸长区和成熟区生长素减少。相同浓度条件下,M 处理的幼苗生长素显著高于 G 处理,处理6 d 后分生区和伸长区的生长素逐渐减少,但是生长素的分布方式在不同处理间无明显差异。相同处理条件下不定根中生长素的变化规律与初生根的类似,但是在变化时间上较初生根的晚。
2.2.2不同处理对水稻根尖各区生长素组织细胞分布规律的影响为进一步了解生长素在根尖各区组织细胞的分布特点,取初生根根尖连续切片观察,以3% G处理4 d为例(图8),根尖各区组织细胞间生长素分布的变化规律为根冠和分生区细胞中生长素的含量高且在各细胞间分布均匀。伸长区前端中柱部分生长素相对少,周缘(皮层)细胞生长素多。伸长区和成熟区皮层细胞内的生长素由前向后逐渐减少,呈现梯度分布。在成熟区中维管柱内的生长素从前往后含量也逐渐降低,生长素主要分布在近表皮的皮层细胞和表皮细胞中。生长素在根尖各区总体变化规律是从分生区到成熟区生长素含量由多变少,由均匀分布到梯度分布。在本试验中不同处理条件下,生长素在各区的分布规律类似,但是在伸长区和成熟区生长素随着糖浓度的升高而增加,M处理使生长素在相应部位显著增加。
2.2.3IBA 和 TIBA 对不同浓度葡萄糖处理水稻幼苗初生根生长的影响从图7、图8可以看出,不同浓度 G 处理的幼苗生长素在根尖各区的分布方式类似,但是生长素积累量存在差异。结果表明,生长素的局部积累是其合成和运输共同作用的结果。为进一步分析 G 对根系生长的调节是否与生长素合成和运输有关,分析了在 G 处理的基础上添加 IBA 和 TIBA 对初生根生长的影响,处理时间 8 d。结果表明,在缺糖(0 G)条件下添加 IBA 促进了初生根的生长;相反在高浓度糖(5% G)条件下添加 IBA 则抑制了初生根的生长,而 3% G+IBA 处理与3% G 处理的无明显差异。在 0 G~5% G 处理条件下,添加生长素运输抑制剂 TIBA 均抑制初生根的生长(图9)。结果表明,G 对根生长的影响与其调节生长素的合成和运输有一定关系。
3讨论
G是调节根系生长的重要信号分子之一,不同浓度G处理后对根的形成和生长发育的调节存在差异[4-5]。本试验中3% G 处理的幼苗根系生长最好,0 G 处理的幼苗根系在处理后6 d前其生长与 3% G 处理的没有明显差异,但是在 6 d后显著抑制了根系的生长,而 5% G 处理延迟了幼苗侧根的形成和生长,但是对初生根和不定根生长的影响较小。与相同浓度的G相比,M 处理显著抑制了幼苗根系的生长。结果表明,G对根系生长的调节不是由渗透势引起的而是糖信号本身的作用。在植物生长发育过程中由生长素的极性运输和局部积累形成的时空梯度对器官的形成和生长至关重要[7]。生长素的局部积累是其极性运输、合成、代谢共同作用的结果[12]。G浓度调节生长素极性运输、合成与代谢,从而影响生长素的积累[9]。本试验条件下,0 G 处理的幼苗根系组织细胞特别是伸长区细胞中的生长素明显少于3% G 和5% G 处理,表明缺糖导致根系生长缓慢以致停滞,这与减少生长素的积累有关。进一步研究发现,在 0 G 处理的基础上添加生长素 IBA 时根系的生长有所增强,但是生长素运输抑制剂 TIBA 则显著抑制了根系的生长。结果表明,G对生长素积累的调节可能与生长素合成和运输有密切关系,相关分子机制有待于进一步研究。G是调节水稻幼苗根系生长发育的重要信号分子,这种信号作用与其调节生长素的积累和分布有关。
参考文献:
[1]Malamy J E,Ryan K S. Environmental regulation of lateral root initiation in Arabidopsis[J]. Plant Physiology,2001,27:899-909.
[2]Bolouri-Moghaddam M R,Roy K L,Xiang L,et al. Sugar signalling and antioxidant network connections in plant cells[J]. FEBS Journal,2010,277:2022-2037.
[3]Rolland F B,Sheen J. Sugar sensing and signaling in plants:conserved and novel mechanisms[J]. Annual Review of Plant Biology,2006,57:675-709.
[4]Mishra B S,Singh M,Aggrawal P A. Glucose and auxin signaling interaction in controlling Arabidopsis thaliana seedlings root growth and development[J]. PLoS One,2009,4(2):0004502.
[5]Gibson S I. Control of plant development and gene expression by sugar signaling[J]. Current Opinion in Plant Biology,2005,8:93-102.
[6]Yao S G,Mushika J,Taketa S,et al. The short-root mutation srt5 defines a sugar-mediated root growth in rice(Oryza sativa L.)[J]. Plant Science,2004,167:49-54.
[7]Petersson S V,Johansson A I,Kowalczyk M,et al. An auxin gradient and maximum in the Arabidopsis root apex shown by high-resolution cell-specific analysis of IAA distribution and synthesis[J]. Plant Cell,2009,21(6):1659-1668.
[8]Eveland A L,Jackson D P. Sugars,signalling,and plant development[J]. Journal of Experimental Botany,2012,63(9):3367-3377.
[9]Sairanen I,Novák O,Pěncˇík A,et al. Soluble carbohydrates regulate auxin biosynthesis via PIF proteins in Arabidopsis[J]. Plant Cell,2012,24:4907-4916.
[10]Leclere S S E,Chourey P S. Sugar levels regulate tryptophan-dependent auxin biosynthesis in developing maize kernels[J]. Plant Physiology,2010,153:306-318.
[11]Chen Z H,Feng T T,Liu L Y,et al. Effect of glucose on zinc-induced growth of root system in rice[J]. Agricultural Science and Technology,2011,12(9):1334-1337.
[12]Tromas A,Perrot-Rechenmann C. Recent progress in auxin biology[J]. Comptes Rendus Biologies,2010,333(4):297-306.崔雪梅,郭海如,方嫱,等. 基于主成分分析的油菜盐害生理反应规律[J]. 江苏农业科学,2016,44(2):105-108.

