1种创新单孢子分离及霉菌生长形态观察方法
李贵正++刘纪臣+++李新柱++武磊
摘要:以淡紫拟青霉为例,介绍了1种简易的单孢子分离及霉菌生长形态观察方法。单孢子分离时,通过whatman滤纸过滤获得孢子悬液,使用玻璃点样毛细管点样于凹玻片凹槽中央,普通光学显微镜下观察获得单孢子;生长形态观察时,凹槽中分离的单孢子覆盖融化的固体培养基,经湿室培养后,单菌落用棉兰染色后观察,加盖盖玻片可用油镜观察。该方法能快速、准确分离到单孢子,并很容易观察不同生长期霉菌、放线菌的自然生长状态。
关键词:单孢子分离;霉菌形态;观察
中图分类号: S432.4文献标志码: A文章编号:1002-1302(2016)02-0390-02
收稿日期:2015-03-11
基金项目:山东省工业提质增效升级专项基金[编号:鲁财企指(2014)61号]。
作者简介:李贵正(1976—),男,山东临沂人,硕士,工程师,主要从事微生物发酵研究。Tel:(0539)7198660;E-mail:liguizheng@kingenta.com。真菌、放线菌的纯培养经常需要获得单孢子,单孢子分离也是植物病理研究中的一项基本技术。单孢子分离的方法很多,目前常用方法有琼脂平板稀释纯化法、微量注射器分离法[1]、单孢直接挑取分离法[2]、连续变倍体视显微镜分离法[3]、实体解剖镜单孢分离法[4]、孢子震落水洋菜平板法[5]等,但这些方法操作繁琐,且需要一些不常见的精密仪器,如微量注射器、实体解剖镜、连续变倍体视显微镜等,制约了上述方法在普通实验室的应用。沈萍等的简易单孢子分离法,须要点样于培养皿内壁方格内,然后将皿盖小心、快速翻转,然后放于低倍镜下观察[6],此方法工作量较大,且观察不方便。传统的霉菌、放线菌形态观察方法有直接制片观察法、载玻片培养观察法、插片法、玻璃纸观察法、琼脂槽培养法、仪器设备自动制片法等,这些方法只能观察到真菌、放线菌某阶段的形态特征,不能观察菌丝体的自然生长状态,且以上方法在获得菌丝显微特征的同时,均不能获得菌落层次上的形态特征[7]。本研究提出了1种简易的单孢子分离及霉菌生长形态观察方法,该方法操作简便易行,能很容易观察到菌落不同层次上的形态特征,且能随意观察不同生长期霉菌、放线菌的自然生长状态,以期为实验室单孢子分离和霉菌生长形态观察提供参考。
1材料与方法
1.1材料
1.1.1菌种淡紫拟青霉(Paecilomyces lilacinus)购于中国农业微生物菌种保藏中心。
1.1.2培养基马铃薯琼脂培养基(原配方以无菌水进行 3 ∶1稀释,以调整其硬度和降低营养物浓度):马铃薯200 g,葡萄糖20 g,琼脂20 g,补足蒸馏水至1 L。
1.1.3主要试剂和仪器“U”形玻璃棒,whatman 滤纸(孔径10 μm,英国),凹玻片,盖玻片,玻璃点样毛细管(长度100 mm;内径0.3 mm,华西医科大学),玻璃涂布器,直径9 cm 漏斗,乳酸石碳酸棉兰染色液,漩涡振荡器,擦镜纸(湿热灭菌后烘干备用),20% 灭菌甘油,0.05% Tween-80 无菌水,Nikon- ECLIPSE -50i 光学拍照显微镜(日本)。
1.2方法
1.2.1单孢子分离方法准备工作:用75%乙醇溶液擦拭漩涡振荡器、光学显微镜等,超净工作台内紫外杀菌30 min。拟青霉培养7 d,加5 mL无菌水于培养皿中,用涂布器刮下平板表面菌落。用孔径10 μm的 whatman 滤纸过滤 2 次得孢子悬液。加入95 mL 0.05% Tween-80无菌水和 20个直径5 mm的玻璃珠,放在漩涡振荡器充分振荡10 min[8]。孢子溶液用0.05% Tween-80无菌水梯度稀释至浓度约为10万~30万个/mL(血细胞计数板每大格约1 个孢子)。将毛细管放于三角瓶中,待液面升至毛细管3/4时,拿出轻轻点样于凹玻片的凹槽中央,然后加盖盖玻片。用低倍镜观察,只保留单孢子液滴的凹玻片,其余的用擦镜纸擦去后重新点样。
1.2.2单菌落获取和生长形态观察方法准备湿室:培养皿内铺1张圆形滤纸,然后放置 “U”形玻璃棒,棒上面放置1块凹玻片(凹面向上),盖上皿盖,外用纸包扎,121 ℃湿热灭菌30 min,然后置于100 ℃烘箱中烘干。冷却后每皿加入 5~7 mL 20%的灭菌甘油保湿。融化培养基:将试管中稀释好的PDA固体培养基加热融化后放于55 ℃水浴锅中保温、待用。覆盖培养基:吸取100 μL 55 ℃的培养基,迅速滴入已分离到单孢子的凹槽中,快速转动使其平整。培养:28 ℃恒温培养。观察:既定时间拿出,乳酸石碳酸棉兰染色液染色,光学显微镜下拍照观察,必要时可加盖玻片后用油镜观察。
2结果与分析
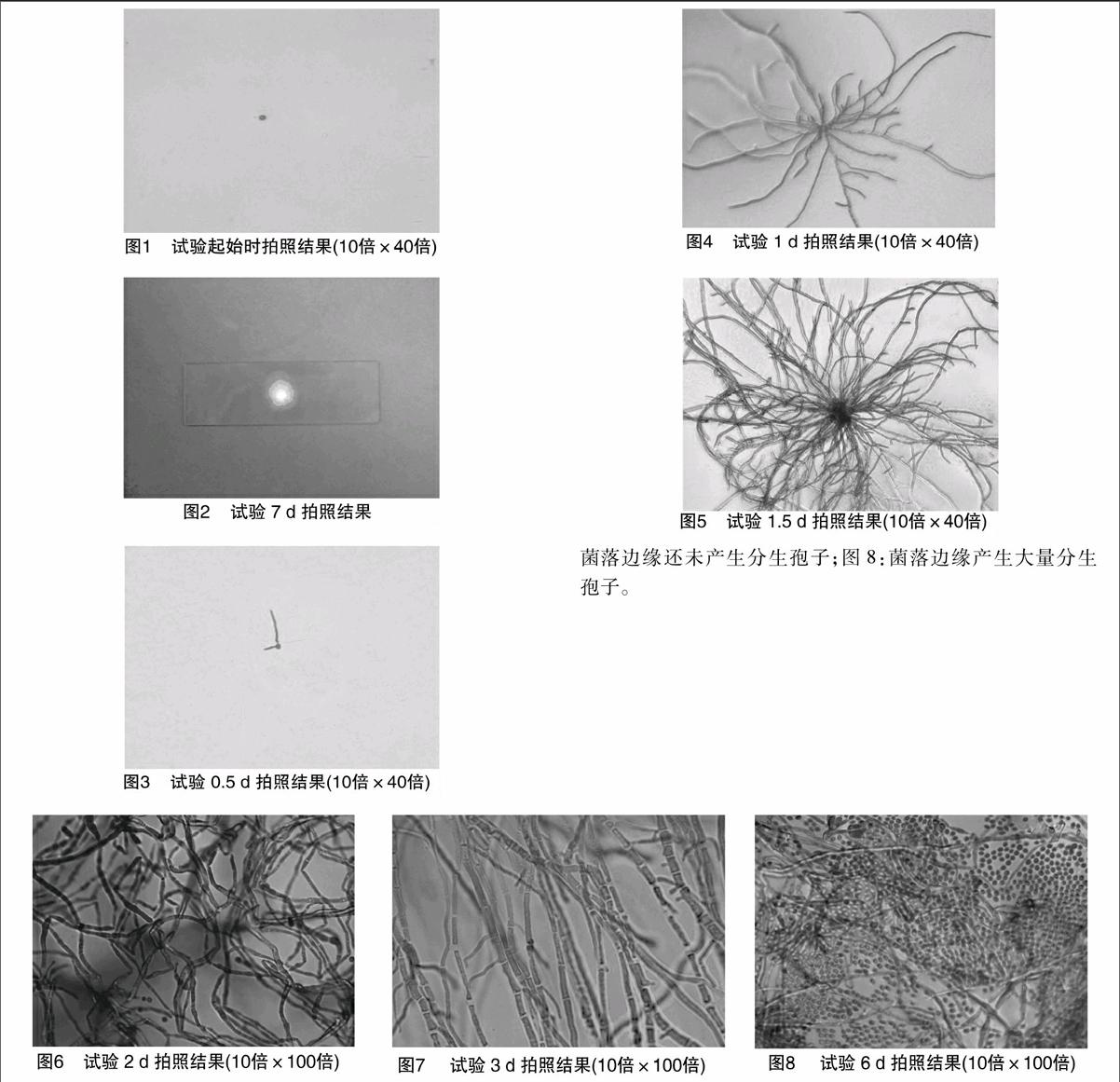
单孢子分离结果见图1。
单菌落获取结果见图2。
每隔一定时间从培养箱中拿出凹玻片,放于显微镜下拍照。图3:萌发的分生孢子;图4:分生孢子长出菌丝体;图5:形成密集的菌丝体;图6:菌落中心开始产生分生孢子;图7:
菌落边缘还未产生分生孢子;图8:菌落边缘产生大量分生孢子。
3结论和讨论
单纯自然形态观察时,可省去单孢子分离的步骤,毛细管点样后直接覆盖培养基即可;此法对产生孢子的放线菌同样适用;如孢子直径较小,应使用40倍的物镜观察分离;梯度稀释后,显微镜下如有多个孢子,可用灭菌的针或牙签挑去多余孢子;若没有whatman滤纸,可用4层擦镜纸替代。
本方法的创新之处:仅用凹玻片和常规的光学显微镜就能很容易分离到单孢子;不须要制备专门的毛细滴管,使用市售的玻璃点样毛细管即可;加盖盖玻片可有效防止液滴干燥,使操作时间延长到3 min以上;通过孔径10 μm的whatman滤纸过滤,可得纯净的孢子悬液,几乎无菌丝体残留;凹玻片的凹槽加入适量培养基不会外漏,且加入的培养基较薄,便于观察;用20%甘油保湿,效果明显优于水琼脂;能随时观察真菌、放线菌的自然生长状态。
该单孢子分离方法不需要特殊分离仪器,一般实验室均能采用,很易观察到不同生长期霉菌、放线菌不同层次上的自然生长状态,可在实验室中推广使用。
参考文献:
[1]高薇薇. 介绍一种简便的真菌单孢子分离方法[J]. 中国中药杂志,1992,17(3):148.
[2]柴荣耀,金敏忠. 介绍一种单孢直接挑取获得单孢菌株的方法[J]. 植物保护,1991(5):53.
[3]张书建,何月秋. 介绍一种简单的真菌单孢子分离法[J]. 云南农业大学学报,2003,18(3):315-316.
[4]孙广宇,张天宇. 一种简易单孢子分离技术[J]. 植物检疫,1996,10(1):40-41.
[5]姜开梅,范静华,朱有勇. 玉米大斑病的分离、培养和产孢方法的研究[J]. 云南农业大学学报,2004,19(3):272-274.
[6]沈萍,范秀荣,李广武. 微生物学实验[M]. 北京:人民教育出版社,1980:72-74.
[7]孙建广,周欣,肖佳雷,等. 一种便于丝状真菌显微观察的培养方法[J]. 植物生理学报,2014,50(2):229-232.
[8]汪军,杨腊英,毛超,等. 淡紫拟青霉E7菌株固体放大发酵产孢培养基和工艺条件研究[J]. 热带作物学报,2013,34(10):2038-2045.朱灵峰,郝丹迪,耿悦,等. 硅藻土基多孔陶粒的制备及其对染料废水的吸附降解[J]. 江苏农业科学,2016,44(2):392-394.

