绿竹生态系统植硅体碳积累与分布特征
杨 杰,项婷婷,姜培坤,2,吴家森,2,柯和佳(.浙江农林大学环境与资源学院,浙江临安00;2.浙江农林大学浙江省森林生态系统碳循环与固碳减排重点实验室,浙江临安00;.浙江省苍南县林业局,浙江苍南25800)
绿竹生态系统植硅体碳积累与分布特征
杨杰1,项婷婷1,姜培坤1,2,吴家森1,2,柯和佳3
(1.浙江农林大学环境与资源学院,浙江临安311300;2.浙江农林大学浙江省森林生态系统碳循环与固碳减排重点实验室,浙江临安311300;3.浙江省苍南县林业局,浙江苍南325800)
摘要:植硅体封存的有机碳(phytolith-occluded organic carbon, PhytOC)已被证明在生物地球化学碳硅循环中具有重要的作用。为了解绿竹Dendrocalamopsis oldhami生态系统中植硅体碳的分布与积累特征,于2014年12月在中心产区浙江省苍南县利用标准地调查方法,采集了不同年龄(1~3年生)、不同器官(叶、枝、秆)、凋落物和土壤样品,分析了硅、植硅体、植硅体碳质量分数。结果表明:绿竹地上部分硅、植硅体、植硅体碳质量分数大小表现均表现为凋落物>叶>枝>秆,其中植硅体碳的质量分数分别为4.28,3.16,0.28,0.04 g·kg(-1),植硅体碳总积累量为22.64 kg·hm(-2),大小顺序为叶(13.22 kg·hm(-2))>凋落物(5.74 kg·hm(-2))>枝(2.71 kg·hm(-2))>秆(0.96 kg·hm(-2));林地土壤硅、植硅体、植硅体碳质量分数均随着土层厚度的增加而呈降低的趋势,0~100 cm土壤中植硅体碳储量为1 302.60 kg·hm(-2)。绿竹植株体内植硅体质量分数与硅、植硅体碳质量分数之间的相关性达极显著(P<0.01)或显著(P<0.05)水平,土壤植硅体碳质量分数与总有机碳质量分数之间也具有极显著(P<0.01)相关性。图4表3参33关键词:森林生态学;绿竹;植硅体;植硅体碳;分布特征
森林是陆地生态系统的主体,全球通过森林固定的二氧化碳达700×109t·a-1[1],同时有高达2.4 g· m-2的碳经凋落物分解后以有机质的形式进入土壤[2],土壤有机碳总量相当于植物碳库的3倍[3-4]。由于土地利用方式的不确定性以及碳存储机制的复杂性和不断变化的环境条件,绝大部分进入土壤的有机碳都不能够长期稳定存在[5]。3 a后,当初以有机质的形式进入土壤的碳将有80%以上再次回到大气中[6]。植硅体碳是一种在植硅体形成过程中被无定型二氧化硅包裹着的稳定型有机碳,随着植物体的凋落、腐烂而进入土壤中[7],由于受到外层具有高度抗风化能力的硅的保护,能长期(数千年至万年)封存于土壤中,被称为陆地土壤长期固碳的重要机制之一[8]。已有研究表明:竹林植硅体碳平均封存量远远高于黍Panicum miliaceum,草原,湿地植物,水稻Oryza sativa及小麦Triticum aestivum[9-13]。绿竹Dendrocalamopsis oldhami属竹亚科Bambusoideae丛生竹种,主要分布于浙江、福建、台湾,面积达2.0×104hm2,是优良的笋材两用竹种[14-15]。前人对竹林植硅体碳的研究主要集中于通过叶片估测竹林的植硅体碳汇能力[16-17],很少涉及枝、秆、凋落物、土壤等整个生态系统。本研究以绿竹群落为对象,对其地上部分叶、枝、秆、凋落物及土壤植硅体碳的测定,以揭示了绿竹林植硅体碳的分布与积累规律,为竹林植硅体碳汇研究与管理提供参考。
1 材料与方法
1.1实验地概况
实验地位于浙江省温州市苍南县,是绿竹的中心产区,中心地理位置27°30′N,120°23′E,属中亚热带海洋性季风气候区,年平均气温为18.0℃,年均降水量1 670.1 mm,无霜期208.0 d。海拔为150~200 m,土壤为发育于凝灰岩的红壤土类,土壤基本理化性质如表1所示。经营的主要措施是4-5月施肥[m(氮肥)∶m(磷肥)∶m(钾肥)= 15∶15∶15, 0.75 t·hm-2],秋季砍去4年生老竹,林分密度1.3万株·hm-2,平均胸径5.0 cm,平均株高7.7 m。

表1 试验地土壤基本理化性质Table 1 Basic physicochemical properties of soil in the experiment
1.2试验设计与样品采集
2014年12月,根据当地森林经营档案并在全面踏查的基础上,分别在后珜村、池头村、望鹤村和南山边村选择林分类型、组成、结构、生长状况和立地条件等具有代表性的绿竹林分4块,各建立面积为20 m×20 m的标准地,调查并采集样品。
对每块标准地内的竹子按不同年龄进行每株检尺,计算出不同年龄竹子的平均胸径,选取与平均胸径一致的竹子作为标准株,砍伐不同年龄标准株各1株,并测量其株高。将不同标准株分叶、枝、秆,野外称出各器官鲜质量。枝、秆分上、中、下3个部位取样组成混合样品,并各取500~1 000 g(准确称量)于样品袋中,带回实验室分析[18]。竹林地上部分生物量按林分中标准株生物量和各林分株数计算[19]。
在每个标准样地四角及中心处位置分别选择1 m×1 m的样方5个,采集凋落物,混合后称量,取样500~1 000 g(准确称量)于样品袋中。
在标准地中选择有代表性地块3个,挖取土壤剖面,分别取0~10,10~30,30~60和60~100 cm土层土壤样品,分别混合3个剖面中不同土层样品作为该标准地不同土层的混合样1 000 g于样品袋中,同时采集不同土层容重样。
1.3分析方法
1.3.1植物样品的分析将野外采集的植物样品用去离子水洗净后,在105℃下杀青20 min,再在70~80℃下烘至恒量。将所有烘干后样品,用高速粉碎机磨细后,装袋保存备用。植硅体的提取采用微波消解法[20],之后用0.800 0 mol·L-1的重铬酸钾溶液对植硅体进行检验,确保表面有机物质完全被去除,提取后的植硅体于65℃的烘箱中烘干48 h,称量。植硅体碳的测定采用碱溶分光光度法[21],在样品测定的同时加入土壤标准样(GBW07405)及植物标准样(GBW07602)对测定的准确性进行检验,每个样品重复3次。
1.3.2土壤样品的分析土壤总硅的测定采用偏硼酸锂熔融-比色法[22],土壤植硅体的提取先采用微波消解法,再用比重为2.35,1.60 g·cm-3的溴化锌重液除去残余的土壤及杂质[23]。土壤植硅体碳测定的方法与植物相同。土壤总有机碳采用重铬酸钾-硫酸外加热法;pH值用酸度计法[m(水)∶m(土)=2.5∶1.0][24]。
1.4数据分析
数据处理使用SPSS 18.0系统进行统计分析,用Duncan新复极差法比较不同数据组间的差异,显著性水平设定为α= 0.05。
2 结果与分析
2.1绿竹地上部硅、植硅体、植硅体中有机碳和植硅体碳含量
从表2可知:绿竹各部分中的硅质量分数大小为凋落物(76.92 g·kg-1)>叶(62.23 g·kg-1)>枝(26.07 g·kg-1)>秆(5.57 g·kg-1),植硅体的质量分数的大小顺序也是凋落物(188.34 g·kg-1)>叶(156.21 g·kg-1)>枝(61.80 g·kg-1)>秆(5.22 g·kg-1),它们之间的差异均达到显著。硅和植硅体的质量分数在不同年龄叶、枝中的差异不大,而秆中则以1年生为最低,而2年生达最高。
植硅体中有机碳质量分数大小总体变化趋势为:秆(11.08%)>枝(2.88%)>凋落物(2.00%)>叶(1.96%),其中秆显著高于其他3个部分。植硅体碳质量分数大小表现为凋落物(4.28 g·kg-1)>叶(3.16 g·kg-1)>枝(0.28 g·kg-1)>秆(0.04 g·kg-1),其中凋落物、叶片中植硅体碳质量分数与枝、秆之间的差异达显著(P<0.05)水平(表2)。
绿竹林地上部植硅体碳总储量为22.64 kg·hm-2,大小顺序为叶(13.22 kg·hm-2)>凋落物(5.74 kg· hm-2)>枝(2.71 kg·hm-2)>秆(0.96 kg·hm-2),植硅体碳主要储存于叶片中(表2)。

表2 不同竹龄绿竹生物量、硅、植硅体、植硅体碳质量分数及植硅体碳储量Table 2 Biomass,concentrations of silicon, phytolith, PhytOC, and PhytOC stock in different aged Dendrocalamopsis oldhami stands
2.2土壤中硅、植硅体、植硅体中有机碳和植硅体碳质量分数
随着土层深度的增加,绿竹林地土壤硅质量分数逐渐减少(427.32~446.35 g·kg-1),但它们之间的差异并不显著;土壤中植硅体质量分数也随之降低,其中0~10 cm土层中植硅体质量分数最高,显著高于其他土层,其他土层之间没有显著性(P>0.05)差异(表3)。
随着土层深度的增加,植硅体中有机碳质量分数随之增加,其中0~10 cm土层植硅体中有机碳质量分数显著(P<0.05)低于30~100 cm土层;而植硅体碳质量分数则呈现降低的趋势,0~10 cm土层中植硅体碳质量分数最高(0.18 g·kg-1),显著(P<0.05)高于30~100 cm土层(表3)。
植硅体碳占总有机碳的比例为0.89%~1.19%,在不同土层间不具有显著性差异(P>0.05);绿竹林0 ~100 cm土壤中植硅体碳储量为1 302.60 kg·hm-2,在土壤剖面中的分布比较均匀(表3)。
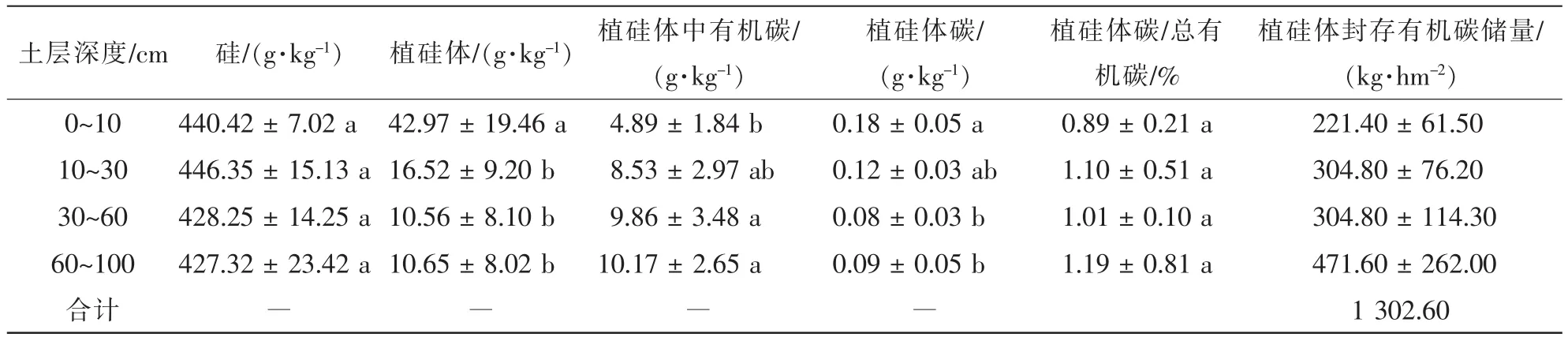
表3 绿竹林不同土层中植硅体、植硅体碳质量分数及植硅体碳储量Table 3 Distribution of phytolith and PhytOC in different soil depths of Dendrocalamopsis oldhami forest
3 讨论
3.1绿竹不同器官及凋落物中硅及植硅体的分布
植硅体是在植物细胞内形成的一种无定型硅包碳颗粒,主要形成于富集能力较强的禾本科Gramineae植物体内[25-27],由于植硅体的形成受到蒸腾作用的影响[28],所以在植物的不同器官内植硅体的含量会有明显的差异。芦苇Phragmites communis不同器官中植硅体的分布趋势为叶>鞘>根>茎,并且植硅体的分布趋势与植物体中硅的分布具有高度的一致性[12]。本研究对绿竹叶、枝、秆及地面现存凋落物中硅及植硅体的质量分数进行分析,发现绿竹不同器官中硅及植硅体的分布同样具有高度的一致性,两者之间的相关性达极显著水平(R2= 0.96,P<0.01,图1)。绿竹不同器官硅及植硅体的质量分数均呈现出叶>枝>秆,且具有显著的差异性(P<0.05,表2)。由于绿竹主要生长于中国南方水热条件较好的区域,且植株高大,蒸腾作用强烈,而蒸腾作用主要发生在叶片表面[29],进而增加了绿竹叶片中硅及植硅体的积累。
绿竹经营过程中,每年砍伐老竹留新竹,地面现存凋落物为每年叶片凋落积累的所形成,凋落物中硅及植硅体的质量分数远高于新鲜叶片中的质量分数,两者之间存在显著差异性(P<0.05,表2)。这有可能是由于叶片凋落在地面以后受到腐蚀及分解作用[12],大部分的有机物质会在短时间内被土壤中的小型动物及微生物的消耗。在这一过程中,植硅体由于具有很强的抗腐蚀能力而保存了下来[9],导致凋落物中植硅体的含量不断升高。
3.2绿竹生态系统植硅体碳的产生与影响因素
植物在吸收硅产生植硅体的过程中,有一小部分有机物质被封存于植硅体内。由于植硅体较强的抗分解能力[30],在植物体死亡、腐烂、降解之后,这部分有机物质最终可以很稳定地保存于土壤和沉积物中[9]。因此,植物产生的植硅体及其封存有机碳在全球碳硅生物地球化学循环中具有重要的作用[12]。绿竹叶片中较高的植硅体质量分数,直接导致植硅体碳质量分数远高于枝和秆,并且具有显著的差异性(P<0.05,表2)。植物体中植硅体碳的质量分数不仅与植硅体之间存在关系,也受到植硅体中有机碳质量分数的影响[27]。进一步对植硅体碳和植硅体及植硅体中有机碳的质量分数之间进行相关分析发现,植硅体碳质量分数与植硅体质量分数之间具有显著相关关系(R2= 0.62,P<0.05,图2),而与植硅体中有机碳含量之间无显著相关关系(R2= 0.2,P>0.05,图3),说明植物体内植硅体碳含量的高低主要受植硅体含量高低的控制。
由于植硅体碳主要存在于植物的叶片中[31],很多研究在涉及到植物生态系统植硅体碳储量估算时均对枝、秆做忽略处理[32-33]。本研究结果表明:枝、秆中植硅体碳储量是叶片储量的27.80%,虽然枝、秆中的植硅体质量分数较低,但却有巨大的生物量。因此今后对植硅体碳汇估算时,需增加对植物枝、秆中的植硅体碳的监测。
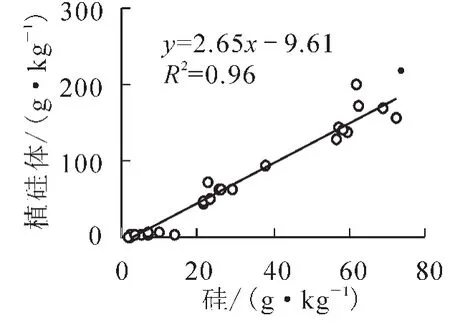
图1 绿竹器官中硅与植硅体质量分数之间的相关关系Figure 1 Correlation between Si and phytolith contents in Dendrocalamopsis oldhami organs
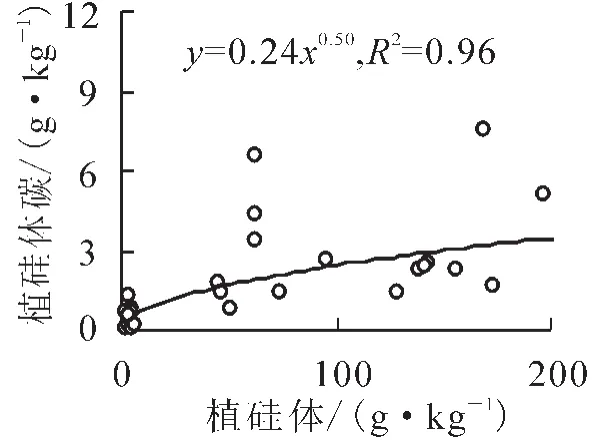
图2 绿竹器官中植硅体与植硅体碳质量分数的相关关系Figure 2 Correlation between Si and phytolith contents in Dendrocalamopsis oldhami organs
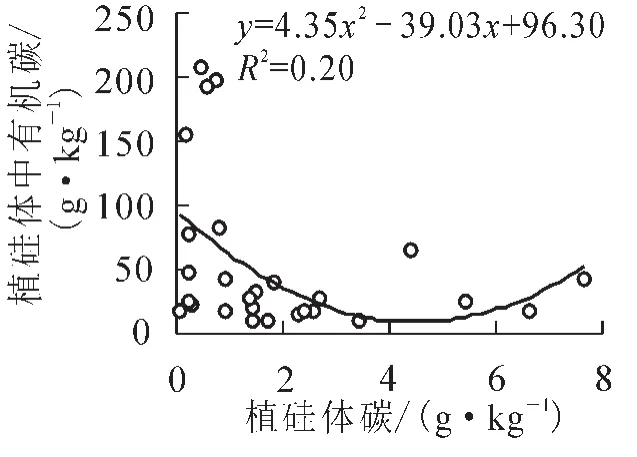
图3 绿竹器官中植硅体碳与植硅体中有机碳质量分数的相关关系Figure 3 Correlation between PhytOC content and carbon content in phytolith in Dendrocalamopsis oldhami organs
3.3绿竹生态系统土壤中植硅体碳的积累及影响因素
已有研究表明:地球表面植被植硅体碳库是植物碳库重要的一部分[2],包括竹林、草原、湿地植物等五大植硅体碳库。无论植硅体碳形成于哪种地表植被中,随着植物体的死亡、降解等过程最终都将回归于土壤中[26]。
土壤中大部分的植硅体均由植物凋落物降解沉淀而来,未完全降解的有机物质包裹着植硅体最初沉积在土壤表面(0~10 cm)。与前人研究结果相同[12],绿竹林地表层土壤植硅体及植硅体碳的质量分数远高于其他土层,差异达显著水平(P<0.05,表3)。土壤中植硅体分布变化与自然界中碳硅自然归还有关,因为土壤中的植硅体均来自于植物体,在植硅体进入土壤的同时必定会伴随着一部分有机物质一同进入土壤[12],这就使得土壤总有机碳的质量分数与植硅体碳质量分数之间具有很好的相关性(R2= 0.80,P<0.01,图4)。同时随着土壤剖面深度的增加,土壤总有机碳质量分数出现了明显的减少,但植硅体碳占总有机碳的比例明显增加,说明在土壤总有机碳降解的过程中,由于受到植硅体碳的保护,植硅体碳仍能够保持稳定地积累于土壤中[27]。
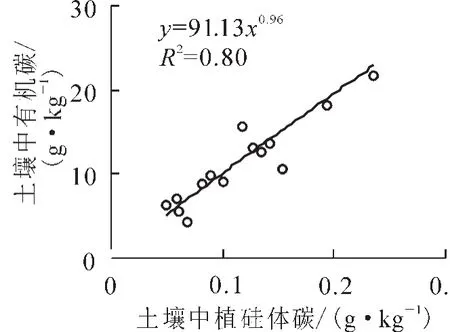
图4 绿竹林下土壤中植硅体碳与土壤总有机碳质量分数的相关关系Figure 4 Correlation between PhytOC and TOC contents in soils of Dendrocalamopsis oldhami forest
由于绿竹林为笋材两用竹竹林,植硅体碳的归还仅通过叶片凋落物及根鞭的形式进行,而叶片中植硅体碳储量仅为13.22 kg·hm-2,假如每年绿竹生长的叶片全部凋落降解、归还于土壤中,那么在不受外界环境因素影响、不发生植硅体迁移的情况下,土壤中植硅体碳的积累通量也是很小的。
4 结论
绿竹地上部分硅、植硅体、植硅体碳质量分数大小表现均表现为凋落物>叶>枝>秆,其中植硅体碳的质量分数分别为4.28,3.16,0.28,0.04 g·kg-1,植硅体碳总积累量为22.64 kg·hm-2,大小顺序叶(13.22 kg·hm-2)>凋落物(5.74 kg·hm-2)>枝(2.71 kg·hm-2)>秆(0.96 kg·hm-2);植硅体中有机碳质量分数大小总体变化趋势为:秆(11.08%)>枝(2.88%)>凋落物(2.00%)>叶(1.96%)。
林地土壤硅、植硅体、植硅体碳质量分数均随着土层厚度的增加而呈降低的趋势,0~100 cm土壤中植硅体碳储量为1 302.60 kg·hm-2;而植硅体中有机碳质量则随着土层厚度的加深而增加,0~10 cm土层植硅体中有机碳质量最低。
绿竹植株体内植硅体质量分数与硅、植硅体碳质量分数之间的相关性达极显著或显著水平(P<0.01 或P<0.05),植硅体碳质量分数与植硅体中有机碳质量分数之间的相关性不显著(P>0.05);土壤植硅体碳质量分数与总有机碳质量分数之间也具有极显著相关性(P<0.01)。
5 参考文献
[1]LAL R.Soil management and restoration for C sequestration to mitigate the accelerated greenhouse effect[J].Prog Environ Sci, 1999, 1(4): 307 - 326.
[2]孟赐福,姜培坤,徐秋芳,等.植物生态系统中的植硅体闭蓄有机碳及其在全球土壤碳汇中的重要作用[J].浙江农林大学学报, 2013, 30(6): 921 - 929.MENG Cifu, JIANG Peikun, XU Qiufang, et al.PhytOC in plant ecological system and its important roles in the global soil carbon sink[J].J Zhejiang A & F Univ, 2013, 30(6): 921 - 929.
[3]LAL R.Soil carbon sequestration to mitigate climate change[J].Geoderma, 2004, 123(1): 1 - 22.
[4]CHAN K Y, HEENAN D P, OATES A.Soil carbon fractions and relationship to soil quality under different tillage and stubble management[J].Soil Till Res, 2002, 63(3/4): 133 - 139.
[5]LAL R.Soil erosion and the global carbon budget[J].Environ Int, 2003, 29(4): 437 - 450.
[6]WATSON R T.Land Use, Land-use Change, and Forestry: A Special Report of the Intergovernmental Panel on Climate Change[M].Cambridge: Cambridge University Press, 2000.
[7]PARR J F, SULLIVAN L A.Soil carbon sequestration in phytoliths[J].Soil Biol Biochem, 2005, 37(1): 117 - 124.
[8]FISHKIS O, INGWERSEN J, STRECK T.Phytolith transport in sandy sediment experiments and modeling[J].Geoderma, 2009, 151(3): 168 - 178.
[9]PARR J, SULLIVAN L, CHEN Bihua, et al.Carbon bio-sequestration within the phytoliths of economic bamboo species[J].Global Change Biol, 2010, 16(10): 2661 - 2667.
[10]PARR J F, SULLIVAN L A phytolith occluded carbon and silica variability in wheat cultivars[J].Plant Soil, 2011, 342(1/2): 165 - 171.
[11]SONG Zhaoliang, LIU Hongyan, SI Yong, et al.The production of phytoliths in China’s grasslands: implications to the biogeochemical sequestration of atmospheric CO2[J].Global Change Biol, 2012, 18(12): 3647 - 3653.
[12]LI Zimin, SONG Zhaoliang, LI Beilei.The production and accumulation of phytolith-occluded carbon in Baiyangdian reed wetland of China[J].Appl Geochem, 2013, 37(10): 117 - 124.
[13]LI Zimin, SONG Zhaoliang, PARR J F, et al.Occluded C in rice phytoliths implications to biogeochemical carbon sequestration[J].Plant Soil, 2013, 370(1/2): 615 - 623.
[14]张自斌,周光益,林亲众.我国丛生竹研究进展与问题探讨[J].热带林业, 2007, 35(2): 12 - 14.ZHANG Zibin, ZHOU Guangyi, LIN Qinzong.Research progress and some problems on cluster bamboo in China[J].Trop For, 2007, 35(2): 12 - 14.
[15]吴擢溪.绿竹笋期叶片生理生化特性研究[J].林业科学, 2003, 39(专刊1):174 - 178.WU Zhuoxi.Studies on the physiological and biochemical characteristics of leaves of Dendrocalamopsis oldhami during shoot growing[J].Sci Silv Sin, 2003, 39(supp 1): 174 - 178.
[16]SONG Zhaoliang, LIU Hongyan, LI Beilei, et al.The production of phytolith-occluded carbon in China’s forests implications to biogeochemical carbon sequestration[J].Global Change Biol, 2013, 19(9): 2907 - 2915.
[17]LI Beilei, SONG Zhaoliang, LI Zimin, et al.Phylogenetic variation of phytolith carbon sequestration in bamboos[J].Sci Rep, 2014, 4(4): 4710.doi:10.1038/srep04710.
[18]王刚,周本智,李晓靖,等.吊丝单竹林生态系统碳储量及其垂直空间分配特征[J].热带亚热带植物学报,2012,20(1): 72 - 77.WANG Gang, ZHOU Benzhi, LI Xiaojing, et al.Carbon storage and vertical spatial distribution of Dendrocalamopsis vario-striata ecosystem[J].J Trop Subtrop Bot, 2012, 20(1): 72 - 77.
[19]张学元.青海黄土丘陵区退耕还林地沙棘林生物量研究[J].林业调查规划,2011,36(4): 25 - 27.ZHANG Xueyuan.Biomass of Hippophae rhamnoides forest on converted land in Loess Hilly Plateau of Qinghai Province[J].For Invent Plann, 2011, 36(4): 25 - 27.
[20]PARR J F, DOLIC V, LANCASTER G, et al.A microwave digestion method for the extraction of phytoliths from herbarium specimens[J].Rev Palaeobot Palynol, 2001, 116(3/4): 203 - 212.
[21]杨杰,李永夫,黄张婷,等.碱溶分光光度法测定植硅体碳含量[J].分析化学, 2014, 42(9): 1389 - 1390.YANG Jie, LI Yongfu, HUANG Zhangting, et al.Determination of phytolith-occluded carbon(PhytOC)content using alkali dissolution-spectrophotometry[J].Chin J Anal Chem, 2014, 42(9): 1389 - 1390.
[22]PAN Genxing, LI Lianqing, ZHANG Xuhui, et al.Soil organic carbon storage of China and the sequestration dynamics in agricultural lands[J].Adv Earth Sci, 2003, 18(4): 609 - 618.
[23]PARR J F.A comparison of heavy liquid floatation and microwave digestion techniques for the extraction of fossil phytoliths from sediments[J].Rev Palaeobot Palynol, 2002, 120(3/4): 315 - 336.
[24]鲁如坤.土壤农业化学分析方法[M].北京:中国农业科技出版社,2000: 146 - 226.
[25]LI Zimin, SONG Zhaoliang, JIANG Peikun.Biogeochemical sequestration of carbon within phytoliths of wetland plants: A case study of Xixi wetland, China[J].Chin Sci Bull, 2013, 58(20): 2480 - 2487.
[26]HUANG Zhangting, LI Yongfu, JIANG Peikun, et al.Long-term intensive management increased carbon occluded in phytolith(PhytOC)in bamboo forest soils[J].Sci Rep, 2014, 4: 3602.doi:10.1038/srep03602.
[27]ZUO Xinxin, LU Houyuan, GU Zhaoyan.Distribution of soil phytolith-occluded carbon in the Chinese Loess Plateau and its implications for silica-carbon cycles[J].Plant Soil, 2014, 374(1/2): 223 - 232.
[28]徐德克,李泉,吕厚远.棕榈科植硅体形态分析及其环境意义[J].第四纪研究, 2005, 25(6): 777 - 783.XU Deke, LI Quan, LÜ Houyuan.Morphological analysis of phytoliths in palmae and its environmental significance [J].Quate Sci, 2005, 25(6): 777 - 783.
[29]李仁成.竹叶及其植硅体类脂物的分类学意义及其季节性变化[D].武汉:中国地质大学, 2010.LI Rencheng.Taxonomic Significance and Seasonal Variations of Lipid from Bamboo Leaf and Its Phytolith[D].Wuhan: China University of Geosciences, 2010.
[30]FISHKIS O, INGWERSEN J, LAMERS M, et al.Phytolith transport in soi: a field study usingfl uorescent labelling [J].Geoderma, 2010, 157(1): 27 - 36.
[31]LI Beilei, SONG Zhaoliang, WANG Hailong, et al.Lithological control on phytolith carbon sequestration in moso bamboo forests[J].Sci Rep, 2014, 4: 5262.doi: 10.1038/srep05262.
[32]SONG Zhaoliang, WANG Hailong, STRONG P J, et al.Phytolith carbon sequestration in China’s croplands[J].Eur J Agron, 2014, 53: 10 - 15.
[33]SONG Zhaoliang, PARR J F, GUO Fengshan.Potential of global cropland phytolith carbon sink from optimization of cropping system and fertilization[J].PloS One, 2013, 8(9): e747.doi: 10.1371/journal.pone.0073747.
Phytolith-occluded organic carbon accumulation and distribution in a Dendrocalamopsis oldhami bamboo stand ecosystem
YANG Jie1, XIANG Tingting1, JIANG Peikun1,2, WU Jiasen1,2, KE Hejia3
(1.School of Environmental and Resource Sciences, Zhejiang A & F University, Lin’an 311300, Zhejiang, China; 2.Zhejiang Provincial Key Laboratory of Carbon Cycling in Forest Ecosystems and Carbon Sequestration, Zhejiang A & F University, Lin’an 311300, Zhejiang, China; 3.Forest Enterprise of Cangnan County, Cangnan 325800, Zhejiang, China)
Abstract:Phytolith-occluded organic carbon(PhytOC)has been shown to have an important role in carbonsilicon biogeochemical cycling.To understand the characteristics of PhytOC accumulation, different organs (leaf, branch, and culm), litter, and soil samples were collected in different age stands of 1-3 year old Dendrocalamopsis oldhami bamboo ecosystems from Cangnan County, Zhejiang Province in December 2014.Then, silicon, phytoliths, and PhytOC were analyzed with a correlation analysis.Results of silicon, phytoliths, and PhytOC mass fraction showed that PhytOC content(in g·kg(-1))of aboveground litter was(4.28)>leaf(3.16)>branch(0.28)>stalk(0.04).The total accumulation of PhytOC was 22.64 kg·hm(-2)with an order(in kg·hm(-2))of leaf(13.22)>litter(5.74)>branch(2.71)>stalk(0.96).Also, reserve stocks of PhytOC were 1 302.60 kg·hm(-2)in the 0-100 cm soil depth.A highly significant correlation(P<0.01, R2=0.96)was found between silicon and phytolith concentration; a significant correlation(P<0.05, R2= 0.62)was revealed for phytolith and PhytOC concentration in plants; and a highly significant correlation(P<0.01, R2= 0.80)was shown with Phy-book=226,ebook=47tOC and total organic carbon in soils.This results shows that the content of PhytOC depend on silicon and phytolith in plants, and related to total organic carbon in soils.[Ch, 4 fig.3 tab.33 ref.]
Key words:forest ecology; Dendrocalamopsis oldhami; phytolith; PhytOC; distribution
作者简介:杨杰,从事森林土壤质量与环境学研究。E-mail: jiey179@163.com。通信作者:吴家森,教授级高级工程师,博士,从事土壤质量及植物营养研究。E-mail: jswu@zafu.edu.cn。姜培坤,教授,博士生导师,从事土壤与环境学等研究。E-mail: jiangpeikun@zafu.edu.cn
基金项目:浙江省自然科学基金资助项目(LY13C160010);国家自然科学基金资助项目(41471197);浙江农林大学科研发展基金资助项目(2014FR052)
收稿日期:2015-04-09;修回日期:2015-05-26
doi:10.11833/j.issn.2095-0756.2016.02.006
中图分类号:S718.5
文献标志码:A
文章编号:2095-0756(2016)02-0225-07

