巴西野牡丹花粉活力与花粉管生长特性研究
陈燕琼+陈俊晖+林夏斌+漆子钰+江鸣涛+彭东辉

摘要: 以巴西野牡丹(Tibouchina semidecandra)花粉为材料,筛选花粉活力测定的最佳方法,同时探讨了光照对花粉萌发的影响;通过荧光显微观察不同授粉时长的花柱。结果表明:本试验中最适宜巴西野牡丹花粉生活力测定的染色方法为联苯胺染色法;与染色法相比,离体培养基法测定花粉生活力更可靠;适合的最佳萌发培养基为:蔗糖200 g/L+硼酸200 mg/L+CaCl2 50 mg/L。光照对花粉萌发影响显著。荧光显微观察授粉3 h后花粉就已萌发,授粉12 h就有少数花粉管(<20根)达到花柱底部,授粉48 h大部分的花粉管(>80%)达到花柱底部。花粉管生长过程存在胼胝质阻挡、花粉管尖端膨大、花粉管缠绕等异常现象,从而不能通过柱头完成受精作用,表现出典型的配子体型自交不亲和性。
关键词: 巴西野牡丹;花粉;萌发;染色法;自交不亲和性
中图分类号: S685.110.3 文献标志码: A 文章编号:1002-1302(2016)03-0230-04
巴西野牡丹(Tibouchina semidecandra)是野牡丹科(Melastomaceae)蒂姆花属(Tibouchina)植物,株高0.5~1.5 m,原产于巴西低海拔山区及平地,在无霜地区均能生长良好,并且一年四季开花不断。巴西野牡丹性喜高温,极耐旱和耐寒,花期长,在广州地区,盛花期为10月份到次年的6月份[1]。巴西野牡丹植株株型紧凑美观,花开为少见的浓艳紫色,极为美观,可作为优良的灌木及盆花植物[2]。从引进至今园林应用日渐广泛,深受人们的喜爱。将巴西野牡丹花期长、花大色艳的优良性状与本地野牡丹科植物性状相结合,是选育新品种的新思路。而花粉生活力的大小直接影响授粉的成败,本试验比较了4种花粉生活力测定方法间的差异,以期选择适合巴西野牡丹花粉生活力快速测定的方法。对其花粉活力的测定可为相关的野牡丹科植物的杂交育种工作提供理论依据。并采用荧光测定法开展了不同时段花粉在柱头上萌发特性的研究,旨在了解其花粉活力以及导致其结实率低的原因,为今后开展花粉活力测定以及克服授粉成功率低的问题提供基础资料。
1 材料与方法
1.1 试验材料
巴西野牡丹花粉于2014年11月14日采自福建农林大学中华名特优植物园。随机选取3株长势健壮的巴西野牡丹实生苗,在花朵开放前1 d对花朵进行套袋,第2天将刚开放套袋的花朵剪下取回实验室,用解剖针小心将雄蕊解剖并挤出花粉,然后将花粉均匀混合并收集在离心管中保存。
1.2 试验方法
1.2.1 3种花粉生活力测定染色法的比较 花粉生活力测定采用染色法:(1)醋酸洋红染色法[3]。被染成红色为有活力的花粉,无颜色的为无活力的花粉。(2)联苯胺染色法[4]。被染成红色的为有活力的花粉,无颜色的为无活力的花粉。(3)亚甲基蓝染色法[5]。被染成蓝色的为有活力的花粉,无颜色的为无活力的花粉。染色结果以离体培养法为参照。计算公式:花粉生活力=被染红的花粉数量/观察花粉数量×100%。
1.2.2 离体培养法 采用液体培养基[6]进行巴西野牡丹花粉的离体萌发试验,采用L9(34)正交表,研究蔗糖、硼酸和CaCl2不同水平对巴西野牡丹花粉萌发的影响,按表1配制9种培养液。用解剖针挑取少量花粉撒入装有培养液的离心管中摇匀,使花粉与培养液充分混合,培养条件为(30±2) ℃,全光照培养。每组观察5个视野,每个视野统计大于100粒花粉。花粉管长度大于花粉直径的花粉视为已萌发花粉。计算公式:花粉萌发率=已萌发花粉数/观察花粉总数×100%。
1.2.3 光照对花粉萌发的影响 采用正交设计第5组的培养液,用解剖针挑取少量花粉撒入装有培养液的离心管中摇匀,使花粉与培养液充分混合,分别在黑暗或全光照、温度均为(30±2)℃条件下培养花粉2 h,计算花粉萌发率。操作步骤及统计方法同“1.2.2”节。
1.2.4 自交授粉后花粉管生长状况观察 对巴西野牡丹进行自交,授粉方法为于开花前1 d对巴西野牡丹花朵进行去雄套袋,待柱头分泌大量黏液时选择于当天09:00—12:00进行常规人工授粉。试验前观察记录巴西野牡丹单花花期,花开放至第10天花柱才脱落。因此依次采集授粉后3 h、6 h、12 h、24 h、48 h、6 d、10 d的柱头,每次采集3朵。在Ureshino等的方法[7]上进行改良,将采集后的柱头用FAA固定液固定24 h,取出后用蒸馏水冲洗3次,转移至装有70%乙醇的离心管4 ℃条件保存待用,染色前将柱头取出,蒸馏水冲洗后,用3 mol/L的NaOH溶液45 ℃水浴解离3 h,蒸馏水冲洗5次,再用0.1%的苯胺蓝(0.1 mol/L K3PO4·7H2O 缓冲液)50 ℃水浴染色3 h,压片后使用CI-L型荧光显微镜(尼康中国股份有限公司)在紫外光源下观察柱头内部花粉管生长情况。
1.3 数据处理
数据使用SPSS 19.0软件进行分析。
2 结果与分析
2.1 花粉生活力测定方法比较
由表2可知,醋酸洋红染色值最高,染色效果明显,易区分。联苯胺染色法的染色效果最明显,被染色的花粉整体为红色,而无活力的花粉呈浅黄色近无色。亚甲基蓝染色效果明显,但是不易区分(图1)。经过单因素方差分析得不同染色方法对巴西野牡丹花粉萌发影响显著[F=13.311>F0.05(1,8)=532]。
2.2 离体培养法
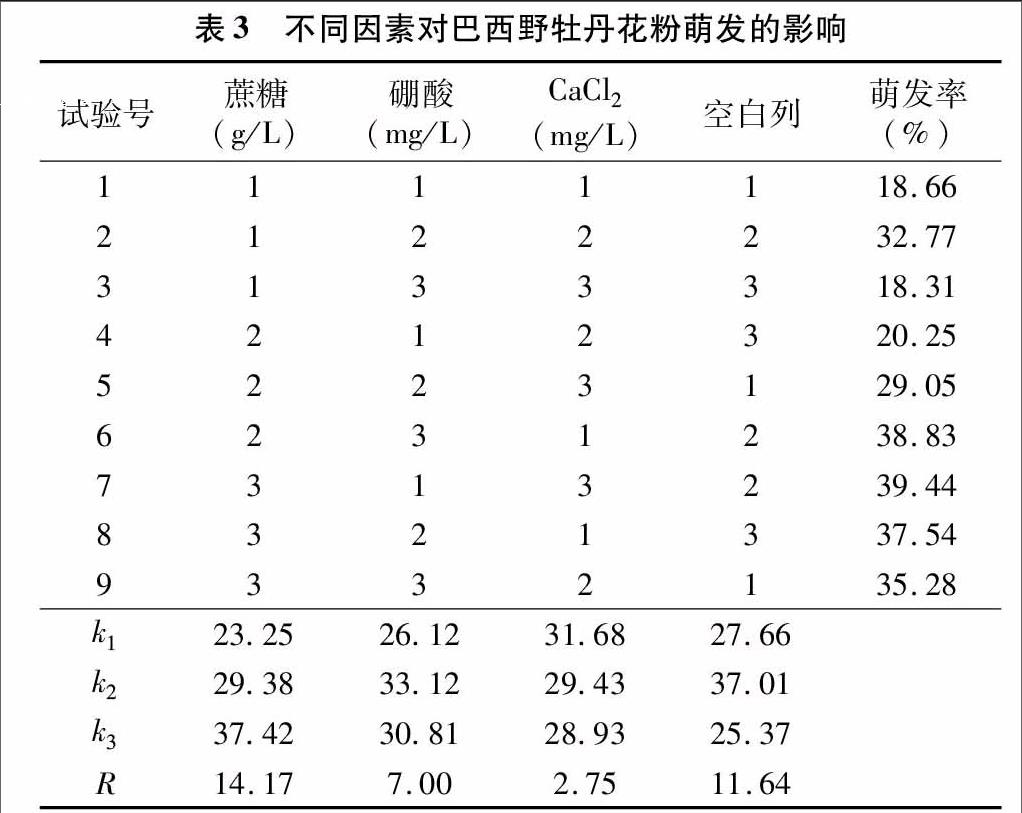
在不同培养条件下,巴西野牡丹花粉的处理7萌发率最高,平均39.44%,处理3萌发率最低,平均18.31%(表3)。极差分析结果表明,蔗糖是影响花粉萌发率的主要因素,在一定范围内,蔗糖的浓度越高花粉萌发率也就越高。其次是硼酸。最适宜巴西野牡丹花粉萌发的组合为蔗糖200 g/L+硼酸200 mg/L+CaCl2 50 mg/L。
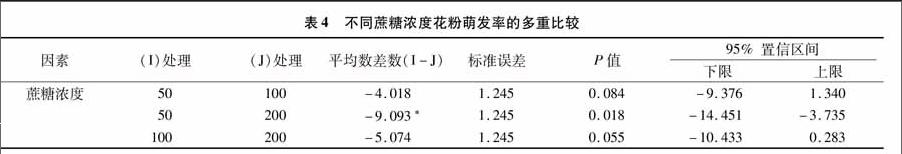
方差分析结果表明:蔗糖对巴西野牡丹花粉萌发影响显著[F蔗糖=26.782>F0.05(2,8)=19.0]。进一步对不同处理进行多重比较结果(表4)表明,巴西野牡丹花粉随着蔗糖浓度的增加,花粉萌发率也相应提高。200 g/L 的蔗糖浓度与50 g/L有显著性差异,50 g/L和100 g/L差异不显著,因此蔗糖浓度的提高有利于花粉萌发。
2.3 光照对花粉萌发率的影响
在黑暗条件下巴西野牡丹花粉的萌发率为20.79%,光照条件下为29.05%。经过单因素方差分析结果表明,在光照和黑暗条件下培养对巴西野牡丹花粉萌发影响差异显著[F=7.163>F0.05(1,8)=5.32],光照有利于巴西野牡丹花粉的萌发。
2.4 自交授粉后花粉管生长状况观察
巴西野牡丹自交不同授粉时长花粉管生长情况见图2。3 h后即有大量花粉开始萌发并伸入柱头;6 h后柱头上的花粉伸入柱头达柱头总长的1/6处,柱头顶部开始出现大量胼胝质,花柱内未见明显胼胝质产生;12 h后柱头顶部仍有较明显的胼胝质沉淀,大部分的花粉管达到花柱的1/4处,极少数(< 20根)达到花柱的底部,发现底部有大量胼胝质出现,发出明亮光点;24 h后花柱顶部胼胝质较不明显,大部分花粉管达到花柱1/2处,花粉管间断产生胼胝质沉淀;48 h后柱头顶部花粉管缠绕成束状,同时花粉管达到巴西野牡丹花柱底部。观察授粉后6、10 d 的花粉管在柱头内的生长状况,巴西野牡丹的花粉能在花柱内正常生长,但是随着花粉管的伸长,由于出现胼胝质、花粉尖端膨大以及花粉管缠绕等现象(图3),观察到穿过柱头底部进入子房的花粉管数量均为0。
3 讨论与结论
3.1 花粉生活力测定
王钦丽等[8]提出用不同的表述方法表述花粉生活力,而本次试验做的只是花粉可染性的试验,并不能反映花粉本身的可育性和受精力。醋酸洋红染色法与联苯胺染色法的基本原理都是依靠花粉中特定的酶与染料发生作用而染色;但是即使花粉失去活力,2种酶的活性仍然存在,所以最终的测定结果偏高。亚甲基蓝染色法的原理是根据花粉粒的胞质存在的有无判断花粉生活力,但这种方法亦能使衰老和死亡的花粉着色,使花粉生活力的测定值偏高,并且有胞质的花粉并不一定具有受精的能力[9]。3种染色方法的测定值均偏高,但是联苯胺染色法的染色时间最短,效果最明显,也容易区分,在本试验中是最适宜巴西野牡丹花粉生活力测定的染色方法。花粉生活力测定的方法还有许多,比如TTC染色法、MTT染色法等,要找到更为适宜的测定方法还需要做进一步的试验研究。
本试验中对于巴西野牡丹花粉生活力的测定,最佳的染色方法为联苯胺染色法;相较于染色法,离体培养基法测定的花粉生活力更可靠,最佳萌发培养基为:蔗糖200 g/L+硼酸200 mg/L+CaCl2 50 mg/L。
3.2 光照对巴西野牡丹花粉萌发的影响
光照对不同种类植物的花粉萌发影响结果不同。有研究表明,黑暗条件会抑制紫荆的花粉萌发[10]。马尾松花粉在黑暗下的萌发率大于光照下的萌发率,但是差异并未达到显著水平[11]。野牡丹科的另一种植物野牡丹的紫红色雄蕊中的花粉在光照条件下的萌发率大于黑暗条件下,黄色雄蕊中的花粉则相反,但两者均未达到显著差异,表明遮光处理对野牡丹花粉萌发无明显影响[12]。本试验中巴西野牡丹光照条件下萌发率大于黑暗条件下,且达到显著差异,表明光照对巴西野牡丹花粉萌发影响显著。这或许与巴西野牡丹的喜光的生态习性有关。
3.3 自交授粉后花粉管生长状况
被子植物的有性繁殖成功与否有赖于传粉(pollination)与受精(fertilization)过程中一系列过程的正常完成:从花粉粒的附着(adhesion)、水合(hydration)、花粉管的萌发(germination)、生长到完成双受精(double fertilization),再到合子、胚乳的发育及种子的成熟等[13]。而在这样的一个过程中一般依据能否完成正常的双受精作用并发育成杂合子,而将生殖障碍划分为合子前障碍(pre-zygotic barrier,也称受精前障碍)和合子后障碍(post-zygotic barrier),后者也称受精后障碍(post-fertilization barrier)[14]。巴西野牡丹的花粉可在柱头上正常萌发,且花粉管可伸入柱头达到深处,这一过程与百合属植物类似。自交不亲和植物百合属为配子体不亲和型,柱头对不亲和花粉没有抑制作用,识别和拒绝的过程都发生在花柱中,使得花粉管未能达到花柱最底部伸入子房,完成受精作用。依据巴西野牡丹花粉管生长特性,认为它是一个自交不亲和性种类,其自交不亲和性表现为花粉萌发后穿过柱头,在花柱的底部附近花粉管被抑制而停止生长。初步推断巴西野牡丹授粉存在受精前障碍,且属于配子体型自交不亲和性植物。
参考文献:
[1]李 欣. 繁花似锦的巴西野牡丹[N]. 中国花卉报,2012-06-14.
[2]林秋金,林秀香,苏金强,等. 16种野牡丹科植物观赏性及适应性综合评价[J]. 西南林学院学报,2010,30(5):33-37.
[3]刘绚霞. 醋酸洋红染色法测定油菜花粉的生活力[J]. 山西农业科学,1998(1):23-24.
[4]左丹丹,明 君,刘 春,等.植物花粉生活力检测技术进展[J]. 安徽农业科学,2007,35(16):4742-4745.
[5]杨发君,张 妍,张 建,等.防风花粉活力测定方法的比较及柱头可授性的研究[J]. 人参研究,2010(2):22-25.
[6]胡适宜.植物学实验方法(一):花粉生活力的测定[J]. 植物学通报,1993,10(2):60-62.
[7] Ureshino K,Kawai M,Miyazima I. Factors of inter-sectional unilateral cross incompatibility between several evergreen azalea species and Rhododendron japonicum f. flavum [J]. Journal of the Japanese Society for Horticulture Science,2000,36:261-265.
[8]王钦丽,卢龙斗,吴小琴,等.花粉的保存及其生活力测定 [J]. 植物学通报,2002,19(3):365-373.
[9]张 妍,杨发君,田义新. 穿龙薯蓣花粉活力及柱头可授性测定方法研究[J]. 安徽农业科学,2010,38(5):2344-2346.
[10]徐 华,聂丹,曹利民,等. H2O2在光/暗调节的花粉萌发中的作用[J]. 赣南师范学院学报,2008(6):61-63.
[11]徐 进,陈天华,王章荣. 不同贮藏方法及光照对马尾松花粉活力的影响[J]. 南京林业大学学报,1998,22(3):71-74.
[12]江鸣涛,吴沙沙,卓孝康,等. 野牡丹花粉生活力与贮藏特性研究[J]. 广东农业科学,2014(17):42-46.
[13]McClure B A,Franklin-Tong V. Gametophytic self-incompatibility:understanding the cellular mechanisms involved in “self” pollen tube inhibition[J]. Planta,2006,224(2):233-245.
[14]Wilcock C,Neiland R. Pollination failure in plants:why it happens and when it matters[J]. Trends in Plant Science,2002,7(6):270-277.

