武汉地区西部食蚊鱼的生长、死亡系数及种群补充模式
张登成,熊 文,陶 捐,陈毅峰,*
1中国科学院水生生物研究所,生物入侵与适应性进化实验室,武汉 4300722中国科学院大学,北京 100049
武汉地区西部食蚊鱼的生长、死亡系数及种群补充模式
张登成1,2,熊文1,陶捐1,2,陈毅峰1,*
1中国科学院水生生物研究所,生物入侵与适应性进化实验室,武汉430072
2中国科学院大学,北京100049
摘要:基于2012年4月—2013年3月在武汉地区两样点调查的西部食蚊鱼数据,运用FAO开发的长度频率数据分析软件FiSAT II对西部食蚊鱼的生长、死亡系数以及种群补充模式进行了估算。西部食蚊鱼全长范围为8.30—44.86 mm,其中优势全长为16—26 mm,占总数的69.17%;雌雄性别为2.63∶1,与1∶1存在显著性差异;鳞片观察发现仅存在0+、1+两个年龄组;雌雄样本全长与体重的关系式分别为W=4.686×10(-6)L(3.299)(R2=0.953),W=1.008×10(-5)L(2.989)(R2=0.903); von Bertalanffy生长方程各参数为:雌性样本极限全长L(∞)=45.20 mm,生长系数k=0.52 a(-1),起始生长年龄t0=-0.47 a,雄性样本极限全长L(∞)=33.60 mm,生长系数k=0.53 a(-1),起始生长年龄t0=-0.50 a;雌性样本和雄性样本的自然死亡系数M分别为1.64 a(-1)、1.81 a(-1),而总死亡系数Z分别为2.29 a(-1)、2.37 a(-1);种群补充模式表明,每年4—9月份为西部食蚊鱼的主要补充期。西部食蚊野生种群表现出了寿命短、生长速度快、自然死亡率高、种群补充时间长等特征,表明该物种是一种典型的r对策物种。据此我们提出了针对性的防控措施:阻止其引入,尽早发现并根除该物种。
关键词:西部食蚊鱼;生长系数;死亡系数;种群补充;生物入侵
张登成,熊文,陶捐,陈毅峰.武汉地区西部食蚊鱼的生长、死亡系数及种群补充模式.生态学报,2016,36(2): 508-517.
Zhang D C,Xiong W,Tao J,Chen Y F.Growth,mortality and recruitment pattern of western mosquitofish(Gambusia affinis Baird&Girard,1853)in lentic wetlands of Wuhan,China.Acta Ecologica Sinica,2016,36(2): 508-517.
外来种入侵所造成的生物同质化与土著物种的濒危是威胁生物多样性与生态系统功能的主要因素之一[1-3],近年来人类活动的加剧使许多物种成功越过其自然分布屏障而扩散到入侵地区,有意或无意地促进了外来物种入侵[4-5]。目前对生物入侵的研究逐渐成为国内外关注的热点,但大多数研究集中在植物、陆生动物和鸟类等种类上,而有关鱼类生物入侵的研究报道较少[6],而我国是世界上鱼类引种最多的国家之一[7],因此,开展对我国外来鱼类的研究工作具有十分重要的意义。
西部食蚊鱼(Gambusia affinis Baird&Girard,1853)隶属于硬骨鱼纲(Osteichthyes)的鳉形目(Cyprinodontiformes)胎鳉科(Poecillidae)食蚊鱼属(Gambusia)。西部食蚊鱼原产于中北美洲的美国和墨西哥,出于控制蚊子的繁衍及疟疾传播的目的,目前已被引种到了50多个国家[8-9]。西部食蚊鱼很可能是目前世界上分布最为广泛的淡水鱼类之一[9],它不仅可以通过竞争、捕食等种间关系影响当地的无脊椎动物、鱼类和两栖类等,造成土著物种种群数量的下降,甚至引起这些土著物种的濒危和灭绝,还可以通过食物链和食物网对水生态系统造成影响,破坏原有生态系统的结构和功能[9-11]。西部食蚊鱼已被世界自然保护联盟(World Conservation Union)纳入全球最具威胁的100种外来入侵种名单[12]。西部食蚊鱼分别于1911年和1924年被引入到中国的台湾和上海[13],目前其已经对中国本地的青鳉鱼类(Oryzias spp.)和小型濒危鲤科鱼类唐鱼(Tanichthys albonubes Lin,1932)造成了严重的负面影响[14-15]。
种群参数(如极限全长、生长系数及死亡系数等)的研究是有效控制和管理外来鱼类的基础[16]。目前有关淡水和海洋鱼类种群参数的估算有许多研究工具,其中FiSAT II(FAO-ICLARM Stock Assessment Tools)软件是最为广泛使用的,它特别适用于年龄组成较为简单的鱼类群体,其主要原因是它仅仅需要长度数据就可以估算出群体的种群参数[17-18]。
到目前为止,中国对西部食蚊鱼的研究较少,有关西部食蚊鱼在中国淡水生态系统中种群参数的研究未见报道[19]。本研究利用分析软件FiSAT II对武汉地区西部食蚊鱼的种群参数进行估算,以期为西部食蚊鱼的有效控制和管理提供有价值的基础资料。
1材料与方法
1.1野外采样及室内处理
通过前期野外调查,发现武汉地区西部食蚊鱼主要分布在池塘和湖泊等静水水体中,本研究选取了中南财经政法大学希贤岭水塘(30°28'48.42″N,114°23'12.85″E,池塘生境)和东湖落雁路附近水域(30°34'16.85″N,114°24'44.54″E,湖泊生境)作为该物种分布的代表性水体,于2012年4月—2013年3月对两个水体进行了周年逐月采样。采用电鱼器(工作电压为300 V)和手抄网(网头直径为50 mm,网目尺寸为1 mm)采集西部食蚊鱼,利用水质分析仪记录样点水温、溶解氧、电导率和pH值。共采集标本1489尾。野外采集的西部食蚊鱼保存于10%的福尔马林溶液,立即带回实验室使用游标卡尺(精度0.01 mm)测量标本的全长,电子天平(精度0.005 g)称量标本的体重。性别判定结合生殖足的有无和对性腺的直接观察两方面,存在明显生殖足的判定为成熟雄性样本,而对于没有明显生殖足的样本则通过解剖观察性腺,如果性腺中存在处于发育阶段的卵或胚胎则判定为成熟雌性样本,如果性腺较小且呈半透明状则判定为未成熟的幼鱼[20-21]。以鳞片作为年龄鉴定的材料。鳞片取自背鳍前下方与侧线之间,鱼体左右两侧各取6—8枚鳞片,于1%氢氧化钠溶液中浸泡24 h用以洗净鳞片,然后在显微镜下观察并拍照。年龄的计数方法为:鳞片上无年轮形成的计0+,鳞片上有1个年轮的计1+,以此类推[22]。许多小型鱼类在一年之中其生长、发育和繁殖等都会存在差异,分析周年12个月的样本数据得出的种群参数反应了西部食蚊鱼种群的整体情况。分别对两水体的西部食蚊鱼种群进行研究,发现两者的种群参数(极限全长、生长系数、总死亡系数等)无显著性差异,故将两个水体的样本数据混合一并分析。
1.2计算方法
1.2.1全长-体重关系
全长-体重关系通过Ricker[23]幂函数进行拟合:

式中,W为体重(g),L为全长(mm)。为了揭示b值与3之间是否存在显著性差异,利用Sokal和Rohlf[24]方程中的t检验进行分析:

式中,b是方程(1)的幂指数,Sb是斜率b的标准误。获得的t值与临界值进行比较用以判定生长类型。当b 与3无显著性差异时,表明西部食蚊鱼是匀速生长类型,当b与3存在显著性差异时,表明西部食蚊鱼是异速生长类型(且b>3时为正异速生长类型,b<3时为负异速生长类型)。
1.2.2生长参数
根据Shepherd方法对西部食蚊鱼的生长参数渐进全长L∞和生长系数k进行估算,理论生长起点年龄t0根据Pauly[25]公式计算:
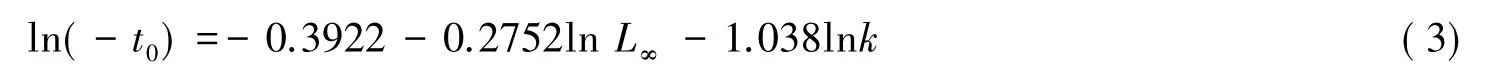
式中,t0为理论生长起点年龄; L∞为渐进全长; k为生长系数。
根据Gayanilo和Pauly[26]公式求得生长指数φ:

1.2.3总死亡系数
总死亡系数Z的估算采用变换全长渔获曲线法(length-converted catch curve)。方程(5)为渔获曲线方程。

式中,N为各全长组的尾数占总渔获尾数的百分比,dt为全长组的下限生长到上限所需要的时间,t为各全长组中值对应的年龄。总死亡系数Z为下降部分的点作线性回归所得斜率的负值,即Z=-b。
1.2.4自然死亡系数
通过Pauly[27]公式估算:
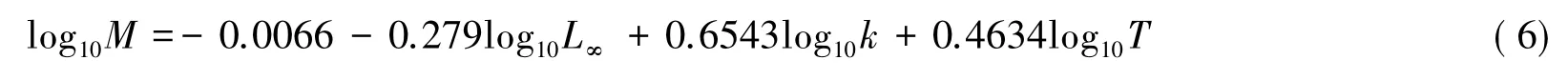
式中,M为自然死亡系数,T是年平均水温,本调查中实测年平均水温为18.9℃,获得了2012年4月—2013 年3月期间武汉市的平均气温为17℃,根据东湖水温与气温回归方程(TW=0.9761TA+2.134,TW为水温,TA为气温)[28],推算出该时期武汉市的平均水温为18.7℃,这与实测平均水温较为接近,本研究采用实测平均水温计算自然死亡系数。
1.2.5种群补充模式
种群补充模式依据全长数据,利用FiSATⅡ软件进行计算,输入参数L∞、k,重构西部食蚊鱼每年的种群补充期。
2结果与分析
2.1种群结构
本次调查共采集西部食蚊鱼标本1489尾,其中雌性1069尾(71.79%),雄性406尾(27.27%),幼鱼14尾(0.94%)。全长范围8.30—44.86 mm,其中优势全长16—26 mm,占个体总数的69.17%(表1,图1)。种群性比(雌性∶雄性)= 2.63∶1,这与1∶1存在显著性差异(X2=297.11,P<0.05),且雌雄性比存在月度差异,月度雌雄性比的范围为1.11—3.58,除2012年10、12月和2013年1月外,种群中雌性显著多于雄性(表2)。通过观察西部食蚊鱼鳞片发现雄性仅存在0+个体,雌性存在0+、1+个体,且以0+为主(图2)。
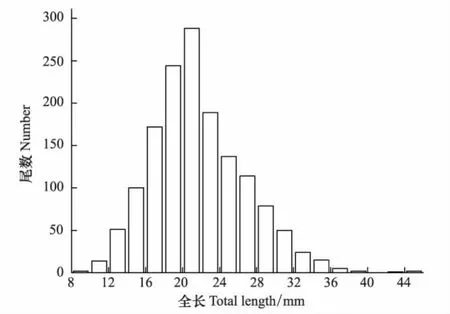
图1 武汉地区西部食蚊鱼的全长分布Fig.1 Distribution of total length of western mosquitofish(Gambusia affinis)in Wuhan between April 2012 and March 2013
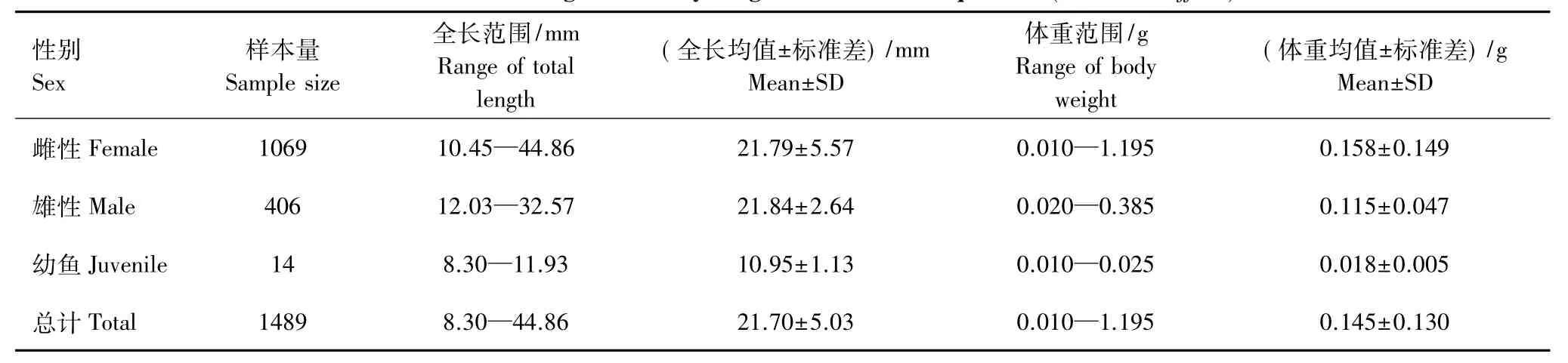
表1 武汉地区西部食蚊鱼的全长体重分布Table 1 Distribution of total length and body weight of western mosquitofish(Gambusia affinis)in Wuhan
2.2全长-体重关系
将西部食蚊鱼全长L(mm)和体重W(g)的关系进行拟合,结果表明西部食蚊鱼的全长与体重符合幂函数关系。雌性和雄性样本幂函数方程中b值分别为3.299、2.989,经t检验表明:雌性样本b值显著大于3(t= 13.60,P<0.05),表现为正异速生长,而雄性样本b值与3无显著性差异(t= 0.22,P>0.05),表现为匀速生长(表3)。西部食蚊鱼雌雄样本全长-体重最优回归方程分别为: W=4.686×10-6L3.299(R2=0.953,N=1069),W= 1.008×10-5L2.989(R2=0.903,N=406)(图3)。
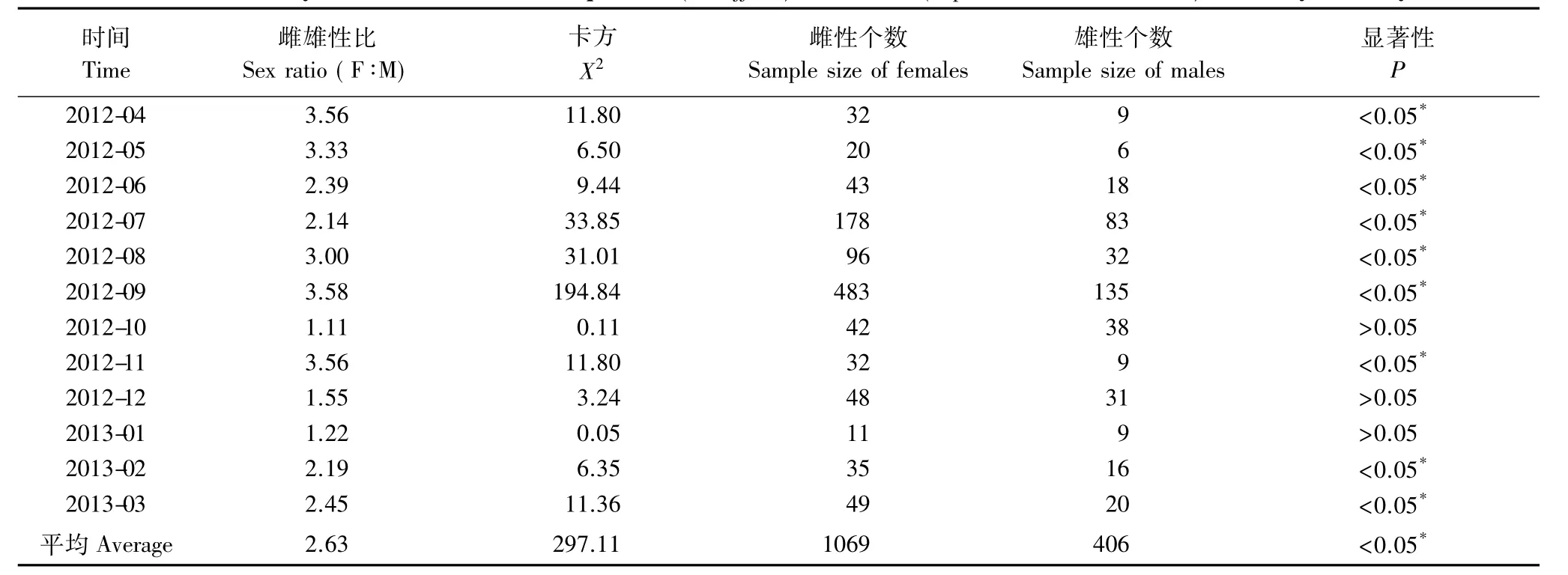
表2 武汉地区(2012年4月—2013年3月)西部食蚊鱼雌雄性比月度变化Table 2 Monthly sex ratio of western mosquitofish(G.affinis)in Wuhan(April 2012 to March 2013)tested by X2analysis

图2 西部食蚊鱼鳞片照片Fig.2 Photographs of scales of western mosquitofish aged 0+and 1+years old黑色箭头示年轮
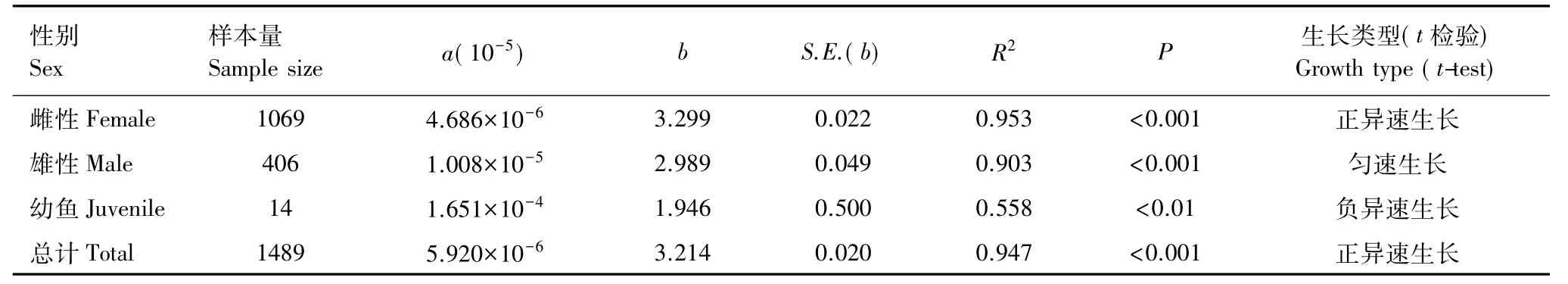
表3 武汉地区西部食蚊鱼的全长体重关系Table 3 Total length-body weight relationship(LWR)of western mosquitofish(G.affinis)in Wuhan
2.3生长参数
西部食蚊鱼雌性样本和雄性样本的极限全长L∞、生长系数k、起始生长年龄t0及生长指数φ如表4所示。
2.4死亡系数
根据转换全长渔获量曲线法(length-converted catch curve),计算得到雌性样本的总死亡系数Z=2.29 a-1,Z的95%置信区间为2.07—2.51 a-1,雄性样本的总死亡系数Z=2.37 a-1,Z的95%置信区间为1.89—2.86 a-1(表4,图4)。通过Pauly[27]公式估算雌性样本的自然死亡系数M=1.64 a-1,而雄性样本的自然死亡系数M= 1.81 a-1(表4)。
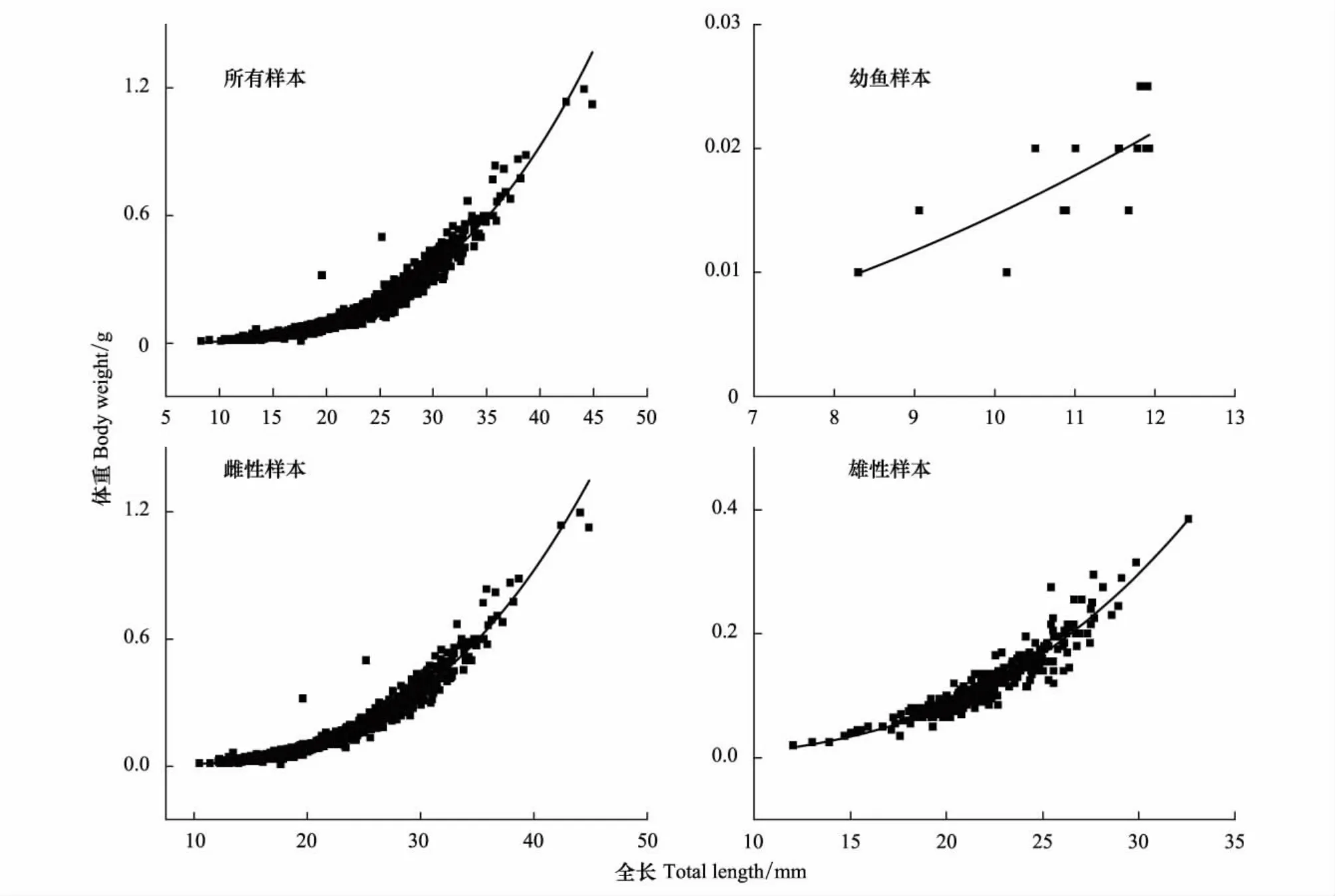
图3 武汉地区西部食蚊鱼的全长-体重关系Fig.3 Total length-body weight relationship of western mosquitofish(G.affinis)in Wuhan between April 2012 and March 2013

表4 武汉地区西部食蚊鱼的生长和死亡系数Table 4 Growth and mortality parameters of western mosquitofish(G.affinis)in Wuhan
2.5种群补充
种群补充模式表明:西部食蚊鱼的种群补充是连续的,种群补充中4—9月份为主要补充期,占全年补充量的81.91%;种群补充量最高的月份是8月份,其种群补充量占全年补充量的17.79%。种群补充如图5所示。本次调查同时发现西部食蚊鱼为连续繁殖,繁殖时期为3—9月份。
3 讨论
3.1种群结构
本研究中武汉地区西部食蚊鱼种群仅包含0+、1+两个年龄组,这与前人关于西部食蚊鱼年龄的研究结果较为一致[29-33]。但是也有研究报道西部食蚊鱼在水族箱中可存活4—5a,这可能是由于西部食蚊鱼野生群体与室内饲养群体生存环境差异等原因所致[34]。
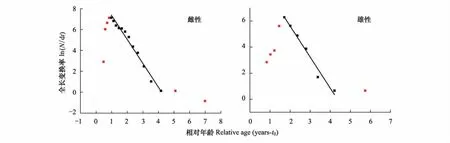
图4 武汉地区西部食蚊鱼的转换全长渔获量曲线Fig.4 Length-converted catch curve of western mosquitofish(G.affinis)in Wuhan
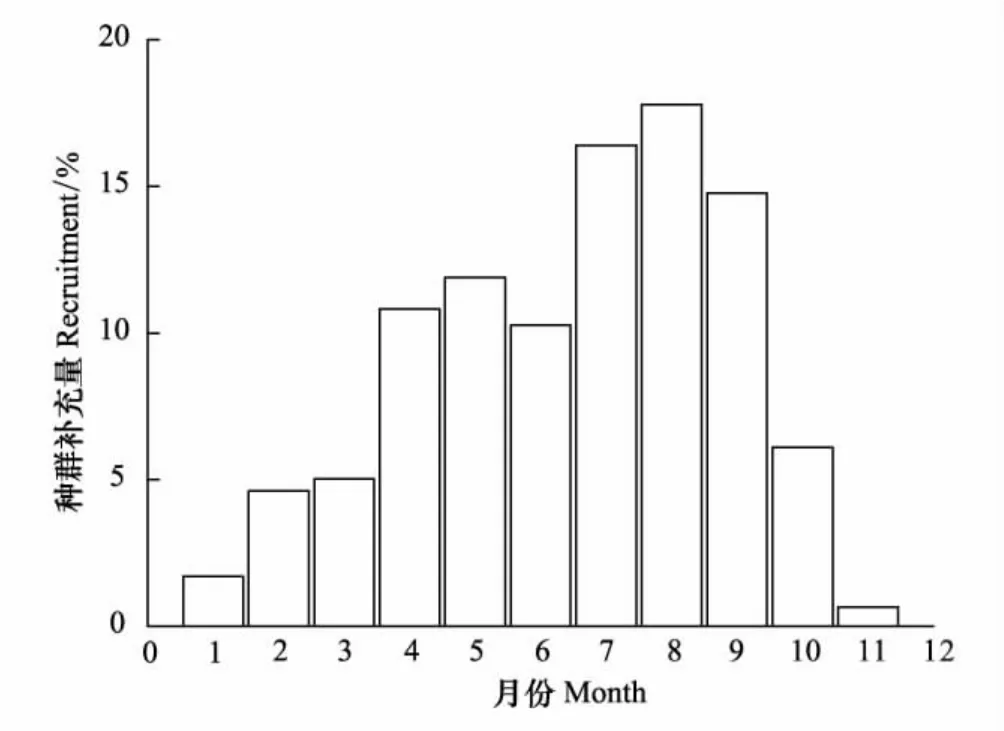
图5 武汉地区西部食蚊鱼的种群补充模式Fig.5 Recruitment pattern of western mosquitofish(G.affinis)in Wuhan
本研究中西部食蚊鱼雌雄性比为2.63∶1,显示出武汉地区西部食蚊鱼野生种群中雌性样本占优势,这与前人大多数的研究结果较为一致[31,33]。西部食蚊鱼出生时雌雄性比为1∶1[34],大部分研究中雌性样本占优势的原因是雄性样本的寿命更短[31,34]、选择性死亡以及不同性别样本表现出不同的栖息地偏好等[31,35-36]。同时,有研究表明西部食蚊鱼雄性样本对生活环境的变化,特别是对恶劣环境的适应能力要比雌性样本弱得多;同时,雄性样本在饥饿状态下存在相互残咬的现象,雌性样本也有咬死雄性样本和幼鱼的现象,特别在繁殖季节,雄性样本相残的现象更为突出[37]。因此,本研究中雌性样本占优势可能是由于雌性样本的寿命更长,同时其对恶劣环境的耐受能力更强及雄性样本存在相残现象等原因所致。
3.2全长-体重关系
全长体重关系中参数b代表了各个鱼类物种的内在属性,通常参数b的范围在2.5—3.5之间[38]。本研究中西部食蚊鱼雌雄样本的参数b分别为3.299、2.989,其中雌性样本参数b与3存在显著性差异,而雄性样本无显著性差异,这表明雌性样本是正异速生长类型,而雄性样本是匀速生长类型。西部食蚊鱼的生长在不同地区表现出不同的生长类型,比如土耳其Fethiye-Akgol地区雌性样本也表现出正异速生长,而雄性样本表现出匀速生长[33];但是也有研究报道土耳其Seyhan Dam Lake地区雌性和雄性样本均表现出负异速生长[39]。同种鱼类不同地理种群表现出不同的生长类型,可能是由样本大小、成熟程度、生长阶段、季节等多种因素造成[40-41]。
3.3生长参数与死亡系数
鱼类的种群参数研究通常有如下3种方法:一是研究鱼体硬组织(如鳞片、耳石、鳍条等)上的轮纹结构,二是通过标记重捕实验,三是分析体长频率数据[42]。通常情况下,前两种方法相对而言费时费力,而体长频率数据分析法(如利用FAO开发的FiSAT II软件)简便易操作,特别对于短寿命鱼类的种群参数研究,体长频率数据分析法更是目前被广泛采用[43-46]。本次调查采集的西部食蚊鱼样本仅涵盖了0+和1+两个年龄组,年龄结构简单且寿命较短,因此比较适合采用体长频率数据分析法研究其种群参数。
到目前为止有关西部食蚊鱼极限全长的研究较少,有研究表明西部食蚊鱼雌性样本的极限全长明显大于雄性样本[47-48]。本研究结果与前人结果较为一致,实测数据中雌性样本的最大全长(44.86 mm)明显大于雄性样本的最大全长(32.57 mm),同时利用FiSAT II软件估算的极限全长也证实了上述差异(雌性极限全长L∞为45.20 mm,雄性极限全长L∞为33.60 mm)。本研究中雌性样本拥有更大的极限全长可能是由于雌性样本的寿命更长所致,本次调查发现雌性样本的最长寿命超过1a,而雄性样本最长寿命不超过1a,这种寿命(生长时间)的差异可能会造成雌雄极限全长的差异。通常情况下小型鱼类会表现出r生活史对策(rstrategists),其典型特点是寿命较短、生长速度快和自然死亡率高[25]。本研究中西部食蚊鱼野生种群年龄结构简单且寿命较短,雄性样本年龄组成全部为0+,而雌性样本年龄组成仅包括0+和1+。Branstetter[49]将生长系数k分为三类: 0.05到0.1为缓慢生长类型; 0.1到0.2为中等速度生长类型; 0.2以上为快速生长类型。本研究中雌性样本(k=0.52 a-1)和雄性样本(k=0.53 a-1)均表现出了快速生长类型,可初步认为西部食蚊鱼是一种生长速度较快到的鱼类。同时,本研究中雌性样本自然死亡系数为1.64 a-1、雄性样本自然死亡系数为1.81 a-1,相对其总死亡系数均表现出了较高的自然死亡。因此,武汉地区西部食蚊鱼的野生种群表现出了典型的r生活史对策。鱼类雌性样本表现出更大的极限全长、更低的死亡系数及更长的寿命有利于种群拥有更高的繁殖力,是该物种保证种群数量的一种适应性策略[50-51]。本次调查中西部食蚊鱼也采取了上述对策,保证了该物种在野外环境中较高的种群数量,这也是其在我国长江以南各水体成功入侵的重要原因。
本研究得到了西部食蚊鱼雌雄样本的总死亡系数Z和自然死亡系数M,发现雌雄样本总死亡系数Z和自然死亡系数M较为接近。这可能由于西部食蚊鱼并非一种经济鱼类,通常情况不存在针对该物种的人为捕捞活动[9],且本次调查的两个水域均受到了执法部门的严格保护,不存在大规模的渔业捕捞活动,故也不会存在捕捞其他鱼类的过程中将西部食蚊鱼无意捕捞的情况。到目前为止,有关西部食蚊鱼死亡系数的研究极少,据报道入侵到葡萄牙的西部食蚊鱼雌性样本和雄性样本的自然死亡系数均为1.40 a-1[47-48],这与本文获得的结果较为接近,本研究结果为今后相关研究工作提供了基础数据。
3.4种群补充
种群补充模式表明武汉地区西部食蚊鱼的种群补充是连续的,且种群补充的高峰时期在4—9月份。到目前为止,有关西部食蚊鱼种群补充的研究报道较少[11]。然而有报道表明西部食蚊鱼这一物种的主要繁殖时期在不同地区存在差异,且水温是导致这种差异的关键环境因子。据报道水温16℃是西部食蚊鱼进行繁殖活动的最低需求,一旦水温到达该阈值或更高,西部食蚊鱼即可进行精子排放并与卵子受精[52]。已有的报道表明在纬度较低的地区(如美国夏威夷)其繁殖时期在1—11月份[53],在纬度较高的地区(如美国伊利诺伊及霍维湖)其繁殖时期在4—9月份[30,34],而在纬度处于两者之间的地区(如中国广州)其繁殖时期在3—11月份[37]。本次调查结果表明武汉地区西部食蚊鱼的主要繁殖时期在3—9月份,与纬度较高地区的研究结果较为一致,且西部食蚊鱼的种群补充高峰时期与其主要繁殖时期较为吻合。温度有可能是决定不同地区不同月份西部食蚊鱼繁殖活动和种群补充的重要环境因子,常年温度更高的地区西部食蚊鱼的种群补充时期更长,一年之中温度更高的月份种群补充量相对较大。
3.5防控措施
研究外来物种的种群参数(生长、死亡及种群补充等)的目的是为了更好地控制和管理该外来物种。目前国内外针对西部食蚊鱼的种群调节和控制管理等研究较为少见[11,19],本研究表明西部食蚊鱼是一种典型的r对策物种,我们建议最佳的防控措施是阻止其引入,尽早发现并根除该物种。
具体而言,对于西部食蚊鱼还未入侵的水体,引种西部食蚊鱼需要首先经过严格的科学论证[54]。由于引种西部食蚊鱼的目的通常是为了控制当地的蚊虫及其携带的致病菌,因此可以选取具备控蚊能力的土著物种替代西部食蚊鱼以到达此目的。据报道中国土著的圆尾斗鱼(Macropodus chinensis Cantor,1842)对蚊虫也有较强的捕食能力,且不会给本地的生态系统造成严重危害[55],因此可能的情况下应优先选择圆尾斗鱼等物种作为生物控蚊的工具。
对于西部食蚊鱼已经入侵的水体,基于该物种分布的栖息地特征(本调查发现其喜分布于静水或缓流水、有水生植被覆盖的浅水水域),可以在繁殖季节对其栖息地的水文条件和环境因子进行控制,以降低其种群规模。在小范围水体中可采用人工捕捞和化学防除等手段控制和清除西部食蚊鱼,但是这两种手段各有其弊端,前者会消耗大量的人力和财力,后者会对水体造成化学污染,因此采取上述两种措施前需要进行仔细的权衡[19,54]。
致谢:本实验室成员协助野外采样并提供统计分析指导,加拿大英属哥伦比亚大学(UBC)张雄博士帮助写作,特此致谢。
参考文献(References):
[1]Mack R N,Simberloff D,Mark Lonsdale W,Evans H,Clout M,Bazzaz F A.Biotic invasions: causes,epidemiology,global consequences,and control.Ecological Applications,2000,10(3): 689-710.
[2]Holway D A,Suarez A V.Homogenization of ant communities in mediterranean California: the effects of urbanization and invasion.Biological Conservation,2006,127(3): 319-326.
[3]Marchetti M P,Lockwood J L,Light T.Effects of urbanization on California's fish diversity: differentiation,homogenization and the influence of spatial scale.Biological Conservation,2006,127(3): 310-318.
[4]Alcaraz C,Vila-Gispert A,García-Berthou E.Profiling invasive fish species: the importance of phylogeny and human use.Diversity and Distributions,2005,11(4): 289-298.
[5]Gido K B,Schaefer J F,Pigg J.Patterns of fish invasions in the Great Plains of North America.Biological Conservation,2004,118(2): 121-131.
[6]潘勇,曹文宣,徐立蒲,殷守仁.国内外鱼类入侵的历史及途径.大连水产学院学报,2006,21(1): 72-78.
[7]楼允东.我国鱼类引种研究的现状与对策.水产学报,2000,24(2): 185-192.
[8]García-Berthou E,Alcaraz C,Pou-Rovira Q,Zamora L,Coenders G,Feo C.Introduction pathways and establishment rates of invasive aquatic species in Europe.Canadian Journal of Fisheries and Aquatic Sciences,2005,62(2): 453-463.
[9]Pyke G H.A review of the biology of Gambusia affinis and G.holbrooki.Reviews in Fish Biology and Fisheries,2005,15(4): 339-365.
[10]Hurlbert S H,Zedler J,Fairbanks D.Ecosystem alteration by mosquitofish(Gambusia affinis)predation.Science,1972,175(4022): 639-641.
[11]Pyke G H.Plague minnow or mosquito fish? A review of the biology and impacts of introduced Gambusia species.Annual Review of Ecology,Evolution,and Systematics,2008,39: 171-191.
[12]Alowe S,Browne M,Boudjelas S,De Poorter M.100 of the world's worst invasive alien species: a selection from the global invasive species database.Auckland,New Zealand: Invasive Species Specialist Group,2000.
[13]倪勇.食蚊鱼.水产科技情报,1985,(2): 16-17.
[14]陈银瑞,宇和纮,褚新洛.云南青鳉鱼类的分类和分布(鳉形目:青鳉科).动物分类学报,1989,14(2): 239-246.
[15]陈国柱.入侵种食蚊鱼与土著濒危物种唐鱼的种间关系研究[D].广州:暨南大学,2010.
[16]Nurul Amin S,Zafar M,Halim A.Age,growth,mortality and population structure of the oyster,Crassostrea madrasensis,in the Moheskhali Channel(southeastern coast of Bangladesh).Journal of Applied Ichthyology,2008,24(1): 18-25.
[17]Mancera E,Mendo J.Population dynamics of the oyster Crassostrea rhizophorae from the Ciénaga Grande de Santa Marta,Colombia.Fisheries Research,1996,26(1-2): 139-148.
[18]Blaber S J M,Staunton-Smith J,Milton D A,Fry G,Van der Velde T,Pang J,Wong P,Boon-Teck O.The biology and life-history strategies of Ilisha(Teleostei: Pristigasteridae)in the coastal waters and estuaries of Sarawak.Estuarine,Coastal and Shelf Science,1998,47(4): 499-511.
[19]陈国柱,林小涛,陈佩.食蚊鱼(Gambusia spp.)入侵生态学研究进展.生态学报,2008,28(9): 4476-4485.
[20]Turner C L.Morphogenesis of the gonopodium in Gambusia affinis affinis.Journal of Morphology,1941,69(1): 161-185.
[21]Strange R J.Field examination of fishes//Murphy BR,Willis DW,eds.Fisheries Techniques.Bethesda,MD: American Fisheries Society,1996: 433-446.
[22]严云志,闫莉莉,储玲,梁阳阳,陈毅峰,章星明.徽水河宽鳍鱲的年龄、生长和繁殖.水生生物学报,2012,36(3): 474-481.
[23]Ricker W E.Computation and interpretation of biological statistics of fish populations.Bulletin of the Fisheries Research Board of Canada,1975,191: 2-6.
[24]Sokal R R,Rohlf F J.Introduction to Biostatistics.New York: W.H.Freeman and Company,1996.
[25]Pauly D.On the interrelationships between natural mortality,growth parameters,and mean environmental temperature in 175 fish stocks.ICES Journal of Marine Science,1980,39(2): 175-192.
[26]Gayanilo F Jr,Pauly D.FAO-ICLARM stock assessment tools(FiSAT): Reference Manual.vol.8.FAO Computerized Information Series(Fisheries),1997.
[27]Pauly D.ELEFAN I: User' s instruction and program listings.International Center for Living Aquatic Resources Management,Manila(Mimeo),1980.
[28]王学立,康玲,熊其玲.东湖水温与气温相互关系研究//第5届中国水论坛论文集.南京:第五届中国水论坛,2008: 212-216.
[29]Trendall J T.Covariation of life history traits in the mosquito fish,Gambusia affinis.The American Naturalist,1982,119(6): 774-783.
[30]Hughes A L.Seasonal changes in fecundity and size at first reproduction in an Indiana population of the mosquitofish Gambusia affinis.American Midland Naturalist,1985,114(1): 30-36.
[31]Fernández-Delgado C.Life-history patterns of the mosquito-fish,Gambusia affinis,in the estuary of the Guadalquivir river of south-west Spain.Freshwater Biology,1989,22(3): 395-404.
[32]Vargas M J,De Sostoa A.Life history of Gambusia holbrooki(Pisces,Poeciliidae)in the Ebro delta(NE Iberian peninsula).Hydrobiologia,1996,341(3): 215-224.
[33]Öztürk Ş,Ikiz R.Some biological properties of mosquitofish populations(Gambusia affinis)living in inland waters of the western Mediterranean region of Turkey.Turkish Journal of Veterinary and Animal Sciences,2004,28(2): 355-362.
[34]Krumholz L A.Reproduction in the western mosquitofish,Gambusia affinis affinis(Baird&Girard),and its use in mosquito control.Ecological Monographs,1948,18(1): 1-43.
[35]Britton R H,Moser M E.Size specific predation by herons and its effect on the sex-ratio of natural populations of the mosquito fish,Gambusia affinis Baird and Girard.Oecologia,1982,53(2): 146-151.
[36]Fernández-Delgado C,Rossomanno S.Reproductive biology of the mosquitofish in a permanent natural lagoon in south-west Spain: two tactics for one species.Journal of Fish Biology,1997,51(1): 80-92.
[37]潘烱华,苏炳之,郑文彪.食蚊鱼(Gambusia affinis)的生物学特性及其灭蚊利用的展望.华南师范大学学报:自然科学版,1980,(1): 117-138.
[38]Carlander K D.Handbook of Freshwater Fishery Biology.Iowa: Iowa State University Press,1997.
[39]Erguden S.Age,growth,sex ratio and diet of eastern mosquitofish Gambusia holbrooki Girard,1859 in Seyhan Dam Lake(Adana/Turkey).Iranian Journal of Fisheries Sciences,2013,12(1): 204-218.
[40]Tesch F W.Age and growth//Bagenal T B,Tesch F W,eds.Methods for assessment of fish production in fresh waters.Oxford: Blackwell Scientific Publications,1978: 99-130.
[41]Froese R,Tsikliras A C,Stergiou K I.Editorial note on weight-length relations of fishes.Acta Ichthyologica et Piscatoria,2011,41(4): 261-263.
[42]Jobling M.Environmental factors and rates of development and growth//Hart P J B,Reynolds J D,eds.Handbook of Fish Biology and Fisheries.Oxford: John Wiley&Sons,2002: 97-122.
[43]Moreau J,Nyakageni B.Luciolates stapperssi in Lake Tanganyika.Demographical status and possible recent variations assessed by length frequency distributions.Hydrobiologia,1992,232(1): 57-64.
[44]Etim L,Sankare Y.Growth and mortality,recruitment and yield of the fresh-water shrimp Macrobrachium völlenhovenii,Herklots 1851(Crustacea,Palaemonidae)in the Fahe reservoir,Côte d'Ivoire,West Africa.Fisheries Research,1998,38(3): 211-223.
[45]Özbilgin H,Tosunoglu Z,Bilecenoglu M,TokaçA.Population parameters of Mullus barbatus in Izmir Bay(Aegean Sea),using length frequency analysis.Journal of Applied Ichthyology,2004,20(3): 231-233.
[46]Spence R,Fatema M K,Ellis S,Ahmed Z F,Smith C.Diet,growth and recruitment of wild zebrafish in Bangladesh.Journal of Fish Biology,2007,71(1): 304-309.
[47]Beverton R J H,Holt S J.On the Dynamics of Exploited Fish Populations.London: Chapman and Hall,1993: 532-533.
[48]Froese R,Pauly D.Fishbase.World Wide Web electronic publication.[2014-03-25]http://www.fishbase.org.
[49]Branstetter S.Age and growth estimates for blacktip,Carcharhinus limbatus,and spinner,C.brevipinna,sharks from the northwestern Gulf of Mexico.Copeia,1987: 964-974.
[50]RoffD A.An allocation model of growth and reproduction in fish.Canadian Journal of Fisheries and Aquatic Sciences,1983,40(9): 1395-1404.
[51]Beckman D W,Wilson C A,Stanley A L.Age and growth of red drum,Sciaenops ocellatus,from offshore waters of the northern Gulf of Mexico.Fishery Bulletin,1989,87: 17-28.
[52]Medlen A B.Preliminary observations on the effects of temperature and light upon reproduction in Gambusia affinis.Copeia,1951,1951(2): 148-152.
[53]Stearns S C.A natural experiment in life-history evolution: field data on the introduction of mosquitofish(Gambusia affinis)to Hawaii.Evolution,1983,37(3): 601-617.
[54]严云志,陈毅峰,陶捐.食蚊鱼生态入侵的研究进展.生态学杂志,2009,28(5): 950-958.
[55]周洁,郭先武,林峰.圆尾斗鱼灭蚊效果的研究.湖北农业科学,1993,7(6): 20-22,24-24.
Growth,mortality and recruitment pattern of western mosquitofish(Gambusia affinis Baird&Girard,1853)in lentic wetlands of Wuhan,China
ZHANG Dengcheng1,2,XIONG Wen1,TAO Juan1,2,CHEN Yifeng1,*
1 Laboratory of Biological Invasion and Adaptive Evolution,Institute of Hydrobiology,Chinese Academy of Sciences,Wuhan 430072,China
2 University of Chinese Academy of Sciences,Beijing 100049,China
Abstract:The western mosquitofish(Gambusia affinis)is one of the most invasive fish species worldwide,with welldocumented ecological impacts on ecosystem function and several native taxa.This species was introduced to Shanghai,China in 1924 to control mosquito larvae,and has since invaded aquatic habitats across many parts of China,including the middle Yangtze River.However,the population parameters of western mosquitofish,particularly in China,are relatively unknown.In this context,we determined its population parameters in Wuhan,located in a typical middle reach of the Yangtze River.We surveyed western mosquitofish from two typical water bodies in Wuhan from April 2012 to March 2013.We collected 1489 fish,which included 1069 females,406 males,and 14 juveniles.Based on length frequency data collected from the survey,growth,mortality,and recruitment pattern of the mosquitofish were estimated using FiSAT II software developed by Food and Agriculture Organization of the United Nations(FAO).The results can be summarized asbook=584,ebook=312follows: total length of G.affinis population ranged from 8.30 to 44.86 mm,16—26 mm being the most common,and accounting for 69.17% of the whole population.The overall sex ratio of females to males was 2.63∶1,significantly different from 1∶1,and the ratio varied depending on the month.The ages of the fish captured were determined by scale analysis.Two age groups(0+,1+)were identified in females,but only one age group(0+)was identified in males.The relationship between total length(L,mm)and body weight(W,g)can be expressed as W = 4.686×10(-6)L(3.299)(R2= 0.953)for females and W = 1.008×10(-5)L(2.989)(R2= 0.903)for males,and the slopes(b value)of the total length-body weight relationship indicated positive allometric growth for females and isometric growth for males.The estimated parameters for the von Bertalanffy growth equation were L(∞)(asymptotic length)= 45.20 mm,k(growth coefficient)= 0.52 a(-1),t0=-0.47 a for females and L(∞)= 33.60 mm,k = 0.53 a(-1),t0=-0.50 a for males.Our results showed that asymptotic length was larger in females than in males,and this may be attributed to their relatively longer longevity.The instantaneous rates of natural mortality(M)calculated for females and males were 1.64 a(-1)and 1.81 a(-1),respectively.The length-converted catch curve method gave a total annual instantaneous mortality(Z)of 2.29 a(-1)for females and 2.37 a(-1)for males.These results indicated that natural mortality(M)and total mortality(Z)were quite close.There are two possible reasons for this:(1)this small fish species is not fished because this species has no economic value,and(2)the water bodies we surveyed were strictly protected by local government,and no fishing was allowed,so unintentional fishing for mosquitofish was also not possible.The recruitment pattern was continuous,displaying a single major peak event per year.These results demonstrate that western mosquitofish is a small size fish with a short life span,rapid growth rate,high natural mortality,and a long recruitment period.These characteristics indicate that this species is a very typical r-strategy species.We suggest local governments should prevent its introduction,and detect and eliminate this species as early as possible.
Key Words:Gambusia affinis; growth; mortality; recruitment pattern; biological invasion
*通讯作者
Corresponding author.E-mail: chenyf@ ihb.ac.cn
收稿日期:2014-03-23;网络出版日期: 2015-06-10
基金项目:国家自然科学基金项目(31472016);国家重点基础研究发展计划项目(2009CB119205);中国科学院研究生科技创新与社会实践项目(21Z101101)
DOI:10.5846/stxb201403230522

