血小板/脾脏体积比预测肝硬化门静脉高压症的严重程度
张晓赟 李川 彭伟 金谌 文天夫
·论 著·(门静脉高压症外科专题)
血小板/脾脏体积比预测肝硬化门静脉高压症的严重程度
张晓赟 李川 彭伟 金谌 文天夫
目的 探讨用简单的、无创的模型(血小板/脾脏体积之比,platelet spleen volume ratio, PSVR)来评估肝硬化门静脉高压症病人门静脉高压症的严重程度。方法 连续收集了20例我院因乙型肝炎后肝硬化门静脉高压症行断流术病人的临床资料。根据术中测得的门静脉压力梯度,将病人分为两组,即中度门静脉高压症组(9例)与重度门静脉高压症组(11例)。将两组间的资料进行比较,应用Logistic回归分析建立相关模型来预测门静脉压力的严重程度,并与以往的模型进行比较。结果 20例病人均为最终病理证实肝硬化,中度门静脉高压症组与重度门静脉高压症组相比,γ谷氨酰转移酶(P=0.033)、血小板计数(platelet count, PLT,P=0.005)、脾脏体积(P=0.001)、100×PLT/脾脏体积(PSVR,P=0.006),两组间差异均有统计学意义。单因素Logistic回归分析表明,PLT、脾脏体积、PSVR差异具有统计学意义。进一步多因素Logistic回归分析证实PSVR是预测中度与重度门静脉高压症的独立因素。利用ROC曲线分析PSVR最佳截断值5.08,曲线下面积、敏感度、特异度、阳性预测值、阴性预测值分别为0.929、72.7%、100%、75%、100%。应用同样的方法,分析了PLT、脾脏体积、天冬氨酸转氨酶/丙氨酸转氨酶之比(AST/ALT ratio,AAR)、AST/PLT之比(AST to platelet ratio index,APRI)、FIB-4{[年龄(岁)×AST(U/L)]/[PLT(×109/L)×ALT(U/L)1/2]}来预测重度和中度门静脉高压症,结果显示PSVR均优于上述指标。结论 血小板和脾脏体积之比能准确地预测肝硬化中度及重度门静脉高压症。应用这一指标有望减少有创的肝静脉压力梯度的测量,有助于外科医生对肝硬化门静脉高压症病人进行术前评估。
肝硬化;门静脉高压症;血小板;脾脏体积
门静脉高压症往往导致肝硬化病人严重的并发症,也是肝硬化病人死亡的主要原因。因此,所有肝硬化及其他慢性肝脏疾病病人都应常规评估是否存在门静脉高压症及其严重程度[1]。目前,直接的测量门静脉压力创伤较大,已较少使用。应用较多的是间接测量方法,即肝静脉压力梯度(hepatic vein pressure gradient,HVPG),为楔形肝静脉压与自由肝静脉压之差[2]。正常情况下,门静脉属支与下腔静脉属支的压力梯度约1~4 mmHg。当HVPG为5~10 mmHg时定义为中度门静脉高压症;HVPG≥10 mmHg时为重度门静脉高压症[2]。如果HVPG大于20 mmHg,门静脉高压症病人的死亡率将升高[3]。HVPG 10~12 mmHg时,肝硬化门静脉高压症病人发生并发症的风险将增加[4-5]。若HVPG较低(中度门静脉高压症),发生并发症的风险将降低。因此,判断肝硬化门静脉高压症病人的门静脉压力的严重程度,能帮助临床工作者评估病人病情,采取有效的措施降低病人的门静脉压力,改善病人的预后。
HVPG是诊断门静脉高压症的金标准。但HVPG的测量仍是有创的检查,所以许多学者致力于应用无创的、简单的方法来评估门静脉高压症,如天冬氨酸转氨酶/丙氨酸转氨酶之比(AST/ALT ratio,AAR)[6]、AST/PLT之比(AST to platelet ratio index,APRI)[7]、血小板/脾脏直径之比(PSDR)[8]、Park指数[9]、LOX指数[10]和FIB-4{[年龄(岁)×AST(U/L)]/[PLT(×109/L)×ALT(U/L)1/2]}[11]等。这些无创的方法能够替代HVPG来评估是否存在门静脉高压症及其严重程度。虽然这些指标能准确地评估重度门静脉高压症,但很少有文献通过与HVPG比较,来评估中度门静脉高压症,并用无创、简单的方法来预测重度和中度门静脉高压症。
因此,我们纳入我中心因肝硬化门静脉高压症行脾切除及贲门周围血管离断术的病人,通过术前充分评估,术中测量门静脉压力梯度(portal vein pressure gradient,PVPG),探讨用简单的、无创的方法(血小板/脾脏体积之比,platelet spleen volume ratio, PSVR)来判断重度及中度门静脉高压症,并用这一指标来帮助外科医生对肝硬化门静脉高压症病人进行术前评估。
资料与方法
一、一般资料及分组
自2012年12月至2013年10月本组共20例乙型肝炎后肝硬化门静脉高压症病人试行断流术。其中男性17例,女性3例。病例纳入标准:乙型肝炎后肝硬化导致的门静脉高压症病人,同时伴有上消化道出血史和(或)显著脾肿大(超过肋缘)、脾功能亢进[白细胞计数(WBC)<3×109/L和(或)血小板计数(PLT)<50×109/L]。病人常规术前评估包括血常规、肝肾功能、电解质、凝血功能,胃镜,上腹部CT三维血管重建,肝脏专科门静脉系统超声等。胃镜检查按照Dagradi标准[12-13]确定食管静脉曲张的诊断及严重程度。胃镜结果提示,食管胃底静脉中或中-重度曲张6例,重度曲张6例;食管静脉中或中-重度曲张5例,重度曲张1例;胃底静脉重度曲张2例。
依据术中测量的HVPG值,将病人分为两组:重度门静脉高压症组,HVPG≥10 mmHg,共11例;中度门静脉高压症组,HVPG范围为5~10 mmHg,共9例。两组病人间基线资料的比较见表1。
二、研究方法
1.术前评估 所有门静脉高压症病人术前均接受上腹部增强CT三维血管重建。此影像学检查有助于我们尽量清楚与胃底食管下段曲张血管相通的来源血管,及术中充分地断流食管周围的曲张血管,特别是胃后静脉、食管支、高位食管支、膈下静脉等侧支血管,如图1所示。
2.三维重建及脾脏及肝脏体积测量 采用64位螺旋CT进行上腹部CT三维血管重建。自病人肘前静脉注射120~150 ml碘普罗胺(优维显300或370),注射速度约3 ml/s。CT扫描的截面厚度为1~2 mm。动脉期为注射造影剂后23~35 s,门静脉期为70~75 s,平衡期为注射后3 min。将原始数据传至GE Advantage Windows 4.2工作站,应用EDDA IQQA-liver 影像解读分析系统,选择门静脉期进行脾脏及肝脏体积测量,如图2。

A、B、C为曲张的食管静脉及三维重建;D为术中所见,在断流时保留了大的分流支图1 上腹部CT三维血管重建在门静脉高压症病人术前评估的应用 35岁女性病人,乙型肝炎病史20年,既往上消化道出血病史,胃镜检查结果提示中度食管静脉曲张

A.1例重度肝硬化门静脉高压症病人肝脾三维重建;B.1例中度肝硬化门静脉高压症病人肝脾三维重建图2 肝脏及脾脏三维重建及体积测量 应用EDDAIQQA-liver影像解读分析系统,选择门静脉期进行脾脏及肝脏体积测量
3.手术方式 如我们之前的文献报道[14-15]:取左肋缘下弧形切口,开腹后首先结扎脾动脉。从胃角所对胃大弯处紧贴胃壁向上游胃结肠韧带、胃脾韧带,逐一离断、结扎胃短血管,使胃体、胃底部完全游离,切除脾脏。常规脾脏切除后,行贲门周围血管离断术。在经典手术方法的基础上进行改进[16]:术中在胃小弯幽门切迹处切断、结扎胃右血管,然后紧贴胃壁,沿胃小弯向上逐步离断、结扎胃左动脉和冠状静脉走向胃壁的分支,向上至食管下段右侧缘,然后沿食管四周向上游离食管下段7~9 cm,均至食管裂孔平面,根据术前三维血管重建,确切离断结扎与胃底食管下段曲张血管相通的胃后静脉、食管支、高位食管支等侧支血管。另外,断流完成后,我们常规进行肝组织活检,以此评估病人肝硬化严重程度。
4. PVPG的测量 PVPG为门静脉与下腔静脉之间的压力差,也能较好地反应HVPG[17],因此用PVPG代替HVPG。PVPG的测量方法如前述[17-18]:经胃网膜右静脉插入导管至门静脉主干测得门静脉压力(portal vein pressure,PVP);因下腔静脉压力(inferior vena cava pressure,IVCP)与中心静脉压(central venous pressure,CVP)相似,用CVP代替IVCP;PVPG的计算公式为“PVPG=PVP-CVP”。在整个手术过程中,应用导管持续测量门静脉压及中心静脉压。PVPG的四个测量节点为开腹后、脾动脉结扎后、脾切除后以及断流完成后。
三、手术并发症
应用Clavien-Dindo外科手术并发症分级系统来评估手术后并发症,并将两组进行比较。
四、统计学方法
结 果
一、基线资料比较
所有病人均有肝硬化,两组间的Ishak评分差异无统计学意义(P=0.380)。两组间在性别、年龄、HBV-DNA、消化道出血史、血总胆红素(TBIL)、ALT、AST、白蛋白(ALB)、WBC、凝血酶原时间(PT)、国际标准化比值(INR)、Child-Pugh分级、终末期肝病模型(MELD)评分、肝脏体积等方面差异均无统计学意义(P>0.05)。而中度门静脉高压症组与重度门静脉高压症组相比,γ-GT、PLT、脾脏体积、100×PLT/脾脏体积(PSVR)差异均有统计学意义(P<0.05),见表1。
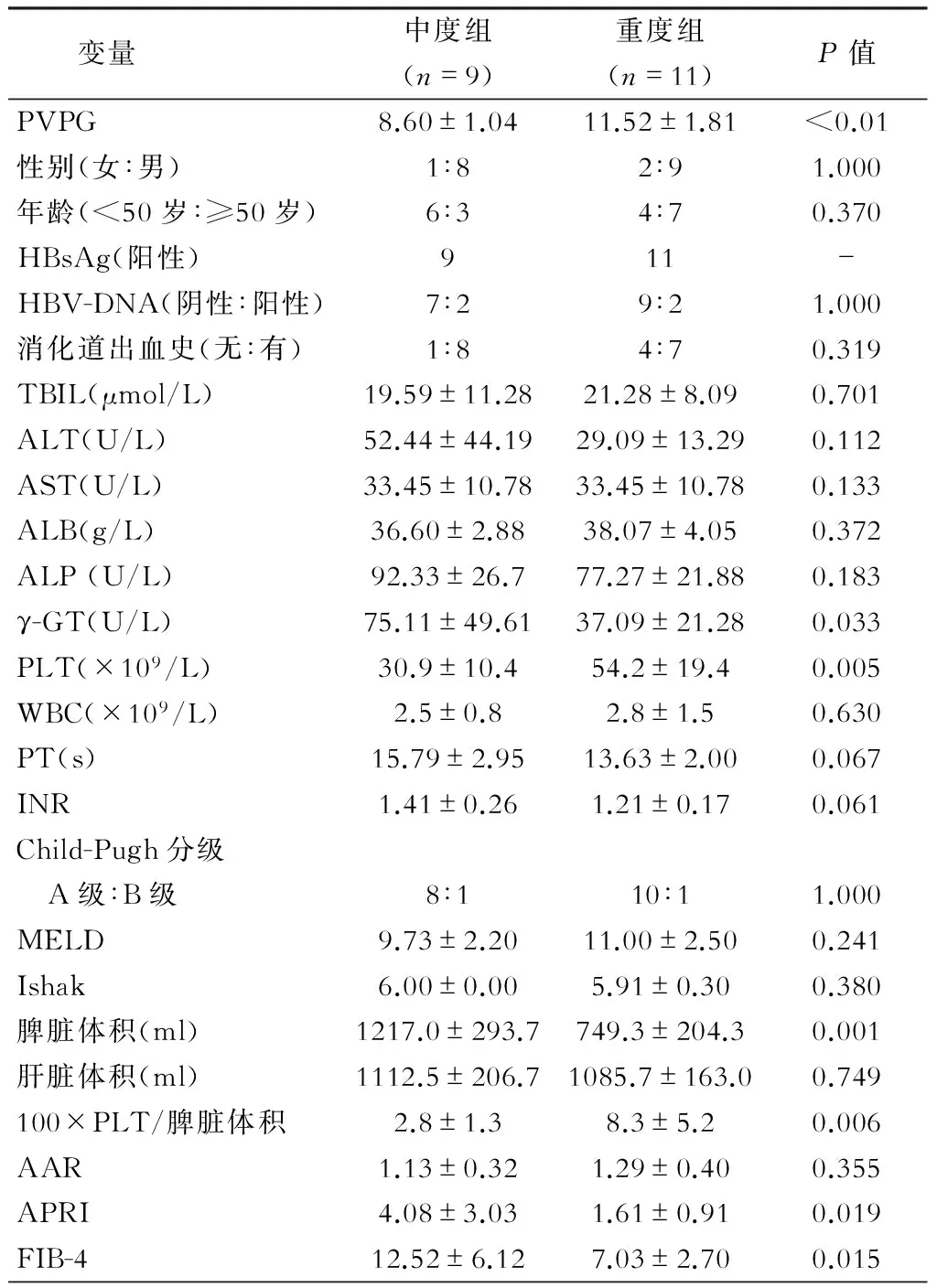
表1 中度和重度肝硬化门静脉高压症组基线资料比较
二、PSVR预测肝硬化门静脉高压症严重程度
单因素Logistic回归分析提示,在重度门静脉高压组与中度门静脉高压症组间,PLT[OR=0.867,95%置信区间(CI):0.772~0.973,P=0.016]、脾脏体积(OR=1.009,95%CI:1.001~1.017,P=0.029)、PSVR(OR=0.277,95%CI:0.085~0.897,P=0.032)差异具有统计学意义(表2)。因考虑PLT、脾脏体积两个变量与PSVR这一变量相互之间有较大影响,因此多因素分析时,我们只纳入了PSVR这一个变量,OR=0.275,95%CI:0.090~0.843,P=0.024,如表2所示。利用ROC曲线,进一步分析PSVR最佳截断值为5.08,AUC=0.929,95%CI:0.821~1.000,P=0.001,敏感度=72.7%,特异度=100%(图3)。另外应用同样的方法,分析了PLT(AUC=0.869,敏感度=72.9%,特异度=100%)、脾脏体积(AUC=0.919,敏感度=77.8%,特异度=91.9%)、AAR(AUC=0.657,敏感度=54.5%,特异度=88.9%)、APRI(AUC=0.879,敏感度=88.9%,特异度=87.9%)、FIB-4(AUC=0.818,敏感度=55.6%,特异度=100%)来预测重度和中度门静脉高压症,结果显示PSVR的AUC均优于上述指标(表3)。
三、手术并发症
所有门静脉高压症病人行断流术后的手术并发症发生率为45%(9/20)。中度门静脉高压症组的手术并发症发生率为22.2%(2/9),重度门静脉高压症组手术并发症发生率为63.6%(7/11),两组间差异有统计学意义(P=0.028)。虽然两组间严重并发症(Clavein分级≥Ⅲ)发生率差异无统计学意义(1/9比3/11,P=0.459),但重度门静脉高压组的严重并发症多于中度门静脉高压症组。

表2 中度及重度肝硬化门静脉高压症组应用Logistic回归分析进行单因素及多因素分析

表3 各检验变量最佳截断值、敏感度、特异度及曲线下的面积的比较
讨 论
随着越来越多非侵入性的检查方法早期诊断肝硬化,肝硬化导致严重门静脉高压症以及食管胃底静脉曲张的病人会逐渐减少[19]。因此早期诊断发现亚临床肝硬化门静脉高压症,即中度门静脉高压症,显得尤为重要。另外,严重的肝硬化门静脉高压症病人发生并发症的风险将增加[4-5]。我们的研究资料显示,重度门静脉高压症组手术后并发症的发生率明显高于中度门静脉高压症组(P=0.028)。
虽然两组间严重并发症(Clavein分级≥Ⅲ)发生率差异无统计学意义(P=0.459),但重度门静脉高压组的严重并发症多于中度门静脉高压症组。因此,术前预测重度门静脉高压症和中度门静脉高压症有重要的临床意义。
通过单因素及多因素Logistic回归分析,我们认为PSVR能有效地预测重度与中度门静脉高压症。重度门静脉高压症组和中度门静脉高压症组的PLT、脾脏体积存在显著差异。正常脾脏的体积约在50~200 ml[20]。肝硬化门静脉高压症病人脾大十分常见,但是并不是所有的肝硬化门静脉高压症病人的脾脏都会增大。既往的研究表明门静脉压力和脾脏体积之间的关系并不是十分明确[21]。而我们的结果提示,重度肝硬化门静脉高压症病人的脾脏体积相对较小。肝硬化所致的淤血肿大的脾脏导致血小板隔离,血小板在循环池与脾池再分布[22]。同时,肿大的脾脏导致脾功能亢进,伴随着血液成分减少,特别是血小板减少。减少的血小板往往和重度的门静脉高压症相关[23]。Hayashi等[24]建议依据脾脏的体积选择血小板减少的治疗方案。肝硬化病人血小板减少时,脾脏体积<400 ml,应行腹腔镜下脾切除术;当脾脏体积在400~700 ml时,应行腹腔镜脾切除或单次部分脾脏栓塞;当脾脏体积>700 ml时,应行腹腔镜脾切除或多次部分脾脏栓塞,直至血小板升高。Giannini等[25]应用血小板/脾脏直径(platelet count/spleen diameter ratio,PSDR)来预测肝硬化病人是否存在食管静脉曲张。因此,血小板及脾脏体积能潜在预测肝硬化门静脉高压症的严重程度。
为了进一步扩大PLT与脾脏体积两变量之间的差异,我们设计了另一个新颖指标,即PSVR。PSVR能准确地预测重度与中度门静脉高压症,其截断值为5.08,ROC曲线下面积为0.929,阳性预测值为75%,阴性预测值为100%。为了进一步验证PSVR能更准确地预测肝硬化中度及重度门静脉高压症,我们将PSVR和PLT、脾脏体积、AAR、APRI及FIB-4这5个指标进行了对比,我们发现PSVR的ROC曲线下面积均优于另外5个指标(AUCPSVR=0.929,AUCPLT=0.869,AUC脾脏体积=0.919,AUCAAR=0.657,AUCAPRI=0.879,AUCFIB-4=0.818),如表3所示。虽然,目前认为AAR、APRI及FIB-4等指标能准确预测肝硬化门静脉高压症的严重程度,但在我们的研究中未能较好地预测肝硬化中度及重度门静脉高压症。我们分析原因如下:第一,上述指标主要是用于预测是否存在肝硬化所致的门静脉高压症,而并非预测中度及重度门静脉高压症;第二,肝硬化所致的中度与重度门静脉高压症本身存在差异,需要用另外的指标来预测二者。因此,我们纳入了一个新的指标,即PSVR,来预测重度与中度门静脉高压症。并且PSVR能准确地预测重度与中度门静脉高压症。
我们的研究也存在许多的不足。第一,纳入研究的样本量较少,需要更大样本量及数据来支持这项的研究;第二,这项研究是回顾性的研究,不可避免的产生选择性偏倚,因此我们计划进行一项前瞻性的随机对照研究,来克服这一不足。
血小板和脾脏体积之比能准确地预测肝硬化中度及重度门静脉高压症。应用这一指标有望减少有创的肝静脉压力梯度的测量,有助于外科医生对肝硬化门静脉高压症病人进行术前评估。
1 de Franchis R. Evolving consensus in portal hypertension. Report of the Baveno IV consensus workshop on methodology of diagnosis and therapy in portal hypertension. J Hepatology ,2005, 43: 167-176.DOI: 10.1016/j.jhep.2005.05.009.
2 Lebrec D, Sogni P, Vilgrain V. Evaluation of patients with portal hypertension. Bailliere’s Clin Gastroenterol,1997, 11: 221-241.
3 Monescillo A, Martinez-Lagares F, Ruiz-del-Arbol L,et al. Influence of portal hypertension and its early decompression by TIPS placement on the outcome of variceal bleeding. Hepatology, 2004,40: 793-801.DOI: 10.1002/hep.20386.
4 Lebrec D, De Fleury P, Rueff B, et al. Portal hypertension, size of esophageal varices, and risk of gastrointestinal bleeding in alcoholic cirrhosis. Gastroenterology,1980,79:1139-1144.
5 Garcia-Tsao G, Groszmann RJ, Fisher RL, et al. Portal pressure, presence of gastroesophageal varices and variceal bleeding. Hepatology, 1985,5: 419-424.
6 Giannini E, Risso D, Botta F,et al. Validity and clinical utility of the aspartate aminotransferase-alanine aminotransferase ratio in assessing disease severity and prognosis in patients with hepatitis C virus-related chronic liver disease. Arch Intern Med ,2003,163: 218-224.DOI: 10.1001/archinte.163.2.218.
7 Wai CT, Greenson JK, Fontana RJ, et al. A simple noninvasive index can predict both significant fibrosis and cirrhosis in patients with chronic hepatitis C. Hepatology, 2003,38: 518-526.DOI: 10.1053/jhep.2003.50346.
8 Giannini E, Botta F, Borro P, et al.Platelet count/spleen diameter ratio: proposal and validation of a non-invasive parameter to predict the presence of oesophageal varices in patients with liver cirrhosis. Gut,2003,52: 1200-1205.DOI: 10.1136/gut.52.8.1200.
9 Park SH, Park TE, Kim YM, et al. Non-invasive model predicting clinically-significant portal hypertension in patients with advanced fibrosis. J Gastroenterol Hepatol ,2009,24:1289-1293.DOI: 10.1111/j.1440-1746.2009.05904.x.
10 Lok AS, Ghany MG, Goodman ZD, et al. Predicting cirrhosis in patients with hepatitis C based on standard laboratory tests: results of the HALT-C cohort. Hepatology, 2005,42:282-292.
11 Vallet-Pichard A, Mallet V, Nalpas B, et al.FIB-4: an inexpensive and accurate marker of fibrosis in HCV infection. comparison with liver biopsy and fibrotest. Hepatology, 2007, 46:32-36.DOI: 10.1002/hep.21669.
12 Dagradi AE, Lee ER, Rodiles D, et al. "Open-tube" vs. fiberoptic esophagoscopy for evaluation of esophageal varices. Am J Gastroenterol, 1973, 60: 240-249.
13 Pan WD, Xun RY, Chen YM. Correlations of portal hypertensive gastropathy of hepatitis B cirrhosis with other factors. HBPD INT, 2002,1: 527-531.
14 Zhang Y, Wen TF, Yan LN, et al. Preoperative predictors of portal vein thrombosis after splenectomy with periesophagogastric devascularization. World J Gastroenterol,2012,18:1834-1839.DOI: 10.3748/wjg.v18.i15.1834.
15 Zhang Y, Wen TF, Chen ZY, et al. Portal vein flow rate used as a early predictor of portal vein thrombosis after periesophagastric devascularization. Zhonghua Wai Ke Za Zhi,2009, 47: 825-828 .
16 李宏为, 周光文. 肝硬化门静脉高压症外科治疗的现状与前景.中华外科杂志,2008,46:1681-1682. DOI: 10.3321/j.issn.0529-5815.2008.22.001.
17 Zhang Y, Wen T, Yan L, et al. The changes of hepatic hemodynamics and functional hepatic reserve after splenectomy with periesophagogastric devascularization. Hepatogastroenterology,2009,56: 835-839.
18 Karara K,el-Gendi MA,Gertsch P,et al.Portal pressure measurements before and after Hassab's decongestion operation. A preliminary report. Int Surg ,1987,72:141-143.
19 Thabut D, Moreau R, Lebrec D. Screening for esophageal varices: Endoscopy, other tools, or endoscopy and other tools?. Hepatology,2008, 47: 1434-1436.DOI: 10.1002/hep.22315.
20 Kaneko J, Sugawara Y, Matsui Y, et al. Normal splenic volume in adults by computed tomography. Hepatogastroenterology, 2002,49: 1726-1727.
21 Simpson KJ, Finlayson ND. Clinical evaluation of liver disease. Baillieres Clin Gastroenterol,1995,9: 639-659.
22 Aster RH. Pooling of platelets in the spleen: role in the pathogenesis of "hypersplenic" thrombocytopenia.J Clin Invest,1966, 45: 645-657.DOI: 10.1172/JCI105380.
23 Sarwar S, Khan AA, Alam A, et al. Non-endoscopic prediction of presence of esophageal varices in cirrhosis. JCPSP,2005,15: 528-531.DOI: 09.2005/JCPSP.528531.
24 Hayashi H, Beppu T, Shirabe K, et al. Management of thrombocytopenia due to liver cirrhosis: a review. World J Gastroenterol, 2014, 20: 2595-2605.DOI: 10.3748/wjg.v20.i10.2595.
25 Giannini E, Botta F, Borro P,et al. Platelet count/spleen diameter ratio: proposal and validation of a non-invasive parameter to predict the presence of oesophageal varices in patients with liver cirrhosis. Gut ,2003, 52: 1200-1205.
Platelet count-spleen volume ratio prediction of both moderate and severe portal hypertention in patients with cirrhosis by platelet count-spleen volume ratio
ZhangXiaoyun,LiChuan,PengWei,JinChen,WenTianfu.
DepartmentofLiverSurgeryandLiverTransplantationCentre,WestChinaHospitalofSichuanUniversity,Chengdu610041,China
WenTianfu,Email:cdwentianfu@sohu.com
Objective To evaluate the degree of portal hypertention (PHT) among the cirrhotic patients by a simple, non-invasive model. Methods Based on the portal vein pressure gradient which was tested during the surgery, 20 patients undergoing pericardial devascularization were divided into two groups: moderate PHT group and severe PHT group. The variables, including age, sex, HBV-DNA, routine blood test, a complete biochemical workup, coagulation and spleen volume, etc, were compared between two groups. Multivariate logistic regression analysis was performed on parameters which were significantly different in a univariate analysis between patients with moderate or severe PHT in order to determine the variables independently associated with the degree of PHT. 100 platelet count/spleen volume ratio (PSVR) was calculated for all patients. The AUC of PSVR was compared with that of other indexes (such as, AAR, APRI and FIB-4). Results All of patients have been proven pathological cirrhosis. γ-GT was higher, and PLT was lower in the moderate PHT group than in the severe PHT group (75.11±49.61 vs. 37.09±21.28,P=0.033; 30.9±10.4 vs. 54.2±19.4,P=0.005, respectively). The spleen volume in the severe PHT group was bigger than that in the moderate PHT group (1217.0±293.7 vs. 749.3±204.3,P=0.001). Multivariate logistic regression analysis showed that PSVR was independently associated with the degree of the PHT. AUC of PSVR for predicting the degree of the moderate and severe PHT was 0.929. And the cut-off value, sensitivity, specificity, positive predictive value and negative predictive value were about 5.08, 72.7%, 100%, 75%, and 100% respectively. In addition, the PSVR perform was better than AAR, APRI and FIB-4 when predicting the degree of PHT. Conclusions Platelet count/spleen volume ratio could predict accurately the degree of PTH. This novel index may reduce the use of the invasive measurement of hepatic vein pressure gradient and help surgeon evaluate the cirrhotic patients with PTH before surgery.
Cirrhosis; Portal hypertension; Platelet; Spleen volume
610041 成都,四川大学华西医院肝脏外科/肝移植中心
文天夫,Email:cdwentianfu@sohu.com
R657.3+4;R657.3+1
A
10.3969/j.issn.1003-5591.2016.03.009
2016-05-15)

