AXL在胃癌中的表达及临床意义
戴平 龙拥军 孟培 王坤
·论 著·(临床研究)
AXL在胃癌中的表达及临床意义
戴平 龙拥军 孟培 王坤
目的 检测AXL及上皮间质转化(epithelial mesenchymal transition, EMT)相关基因在胃癌中的表达与临床意义,探索AXL介导的EMT在胃癌发生、发展及侵袭转移中的作用。方法 利用逆转录-聚合酶链反应(RT-PCR)和蛋白质印迹法(Western blot)技术检测42例胃癌原发灶及癌旁组织中AXL核酸及蛋白的表达;采用免疫组化技术检测AXL及EMT相关基因在102例胃癌原发灶及相应癌旁组织中的表达,统计分析AXL及EMT相关基因在胃癌原发灶中表达的相关性及与胃癌临床病理特征之间的关系。结果 ①胃癌原发灶中AXL核酸及蛋白表达均高于其癌旁组织(P<0.001;P<0.001);AXL、Slug及Vimentin在胃癌中的表达率分别显著高于相应癌旁组织(58.8%比37.3%,P=0.002; 54.9%比38.2%,P=0.017; 56.9%比33.3%,P=0.001);E-cadherin在胃癌中的表达率显著低于相应的癌旁组织(39.2%比68.6%,P<0.001)。②胃癌原发灶中AXL、E-cadherin、Slug及Vimentin的表达高低分别与T分期(P<0.001;P=0.004;P<0.001;P<0.001)、TNM分期(P=0.023;P=0.023;P<0.001;P=0.022)及淋巴结转移(P<0.001;P=0.002;P<0.001;P=0.005)有关。③在胃癌原发灶中,AXL的表达与Slug及Vimentin的表达呈正相关(r=0.323,P=0.001;r=0.317,P=0.001); AXL的表达与E-cadherin的表达呈负相关(r=-0.470,P<0.001)。④胃癌原发灶中AXL(P<0.001)、Slug(P<0.001)及Vimentin(P=0.009)阳性表达显示预后不佳; Cox风险回归多因素生存分析显示,AXL阳性表达(P=0.022)、Slug阳性表达(P=0.004)及淋巴结转移(P=0.029)是影响胃腺癌病人术后生存的独立因素。结论 AXL在胃癌中高表达,在其发生、发展具有重要意义,并可能通过介导EMT的发生促进胃癌的侵袭及转移。
胃癌;AXL;E-cadherin;Slug;Vimentin
胃癌是最常见的恶性肿瘤之一,其发病率位居第四位[1],死亡率位居第二位[2]。胃癌已成为我国发病率和死亡率较高的恶性肿瘤之一[3-4]。胃癌的侵袭转移及复发是导致胃癌病人死亡的最主要原因,是影响临床疗效和预后的关键因素,但是其发生、发展及侵袭转移的分子机制尚不完全清楚。
肿瘤细胞具备侵袭能力以及从原发灶脱落是肿瘤侵袭转移的关键。近年来国内外学者研究发现上皮间质转化(epithelial mesenchymal transition, EMT)在多种肿瘤的侵袭转移过程中发挥了重要作用[5]。EMT是指上皮细胞形态改变和极性的丧失,细胞之间黏附能力减弱,转变为间质细胞,获得迁移能力的一个过程,被认为在肿瘤的侵袭转移过程中发挥关键的作用[6-7],其特征包括上皮细胞表型分子如E-cadherin表达下调,间质细胞表型分子如Vimentin及N-cadherin表达上调伴随转录因子表达上调[5,8]。近年来,研究证实EMT在胃癌的侵袭转移及复发中同样扮演了重要角色[9]。
AXL作为最新研究发现的一种受体酪氨酸激酶家族(receptor tyrosine kinases, RTKs)中的一员,在多种肿瘤中呈高表达,并参与其发生、发展及侵袭转移的过程,可以通过调控基因转录从而参与对肿瘤细胞黏附及迁移的调节[10]。Robison等[11]于1996年首先报道了前列腺癌组织中有AXL表达。此后诸多研究证实,AXL在多种肿瘤中呈高表达[12-16],可以通过调控EMT的发生促进肿瘤的侵袭转移[12-15]。其中更有研究指出AXL可促进转录因子Snail、Slug的激活并由此下调E-cadherin的表达引起EMT的发生从而导致肿瘤侵袭转移能力的增强[12-13]。但目前国内外针对AXL在胃癌中的相关报道较少,AXL在胃癌中作用以及参与作用的机制尚不清楚。本研究首先检测AXL核酸及蛋白在胃癌中的表达情况,其次应用免疫组化技术检测胃癌原发灶及癌旁组织中AXL和EMT相关基因的表达,结合临床资料分析其在胃癌侵袭转移中的意义,探讨AXL和EMT在胃癌侵袭转移中的关系并为进一步揭露其机制奠定基础。
资料与方法
一、病例资料及组织样本来源
经医院伦理委员会审批后同意,选取我院普外科2010年2月至2013年2月期间收治的102例经病理组织学检验确诊为胃腺癌的病人作为研究对象,男性67例,女性35例;年龄37~84岁,中位年龄59岁;均行D2胃癌根治术(R0)。新鲜标本取自切除的胃癌原发灶或配对的距原发灶边缘5 cm以上并获得病理学检查证实的正常胃黏膜组织。术中严格遵守无瘤原则,避免挤压。所有病人术前均未行放疗或化疗。所有入组病例均经病人或其家属知情同意。生存随访截止时间为2015年5月,均采用电话或门诊随访,随访率为86%。
二、主要试剂
兔抗人AXL多克隆抗体及Vimentin单克隆抗体均购自英国Abcam公司,兔抗人E-cadherin单克隆抗体及兔抗人Slug单克隆抗体均购自美国CST公司。RIPA裂解液购自上海碧云天公司;辣根过氧化物酶(HRP)标记的山羊抗兔二抗购自美国Jackson公司;化学发光底物(enhanced chemiluminescence, ECL)试剂盒购自美国Thermo scientific公司;Trizol试剂购自美国Invitrogen公司;PCR试剂盒购自日本Takara公司;链霉亲和素-生物素-过氧化物酶复合物(SABC)免疫组化试剂盒和二氨基联苯胺(DAB)酶底物显色试剂盒购自武汉博士德公司。PBS缓冲液(pH 7.4)、二甲苯、枸橼酸盐抗原修复液、多浓度梯度酒精、过氧化氢等试剂均为上海市第一人民医院宝山分院病理科提供。
三、逆转录-聚合酶链反应(RT-PCR)
取适量组织剪碎后置于研钵中研磨至粉末状后,加入1 ml Trizol试剂提取总RNA,逆转录成cDNA后行PCR反应。AXL引物序列:5’-GGCAACCCAGGGAATATCACA-3’和5’-ACACGAAGGTCTGATGTCCCA-3’;E-cadherin引物序列:5’-TGCCCAGAAAATGAAAAAGG-3’和5’-GTGTATGTGGCAATGCGTTC-3’;Slug引物序列:5’-GGGGAGAAGCCTTTTTCTTG-3’和5’-TCCTCATGTTTGTGCAGGAG-3’;Vimentin引物序列:5’-CCAGGCAAAGCAGGAGTCCAC-3’和5’-GGCCATCTTAACATTGAGCAGGT-3’;GAPDH引物序列:5’-ACGGATTTGGTCGTATTGGGCG-3’和5’-CTCCTGGAAGATGGTGATGG- 3’。 应用凝胶成像系统及凝胶图像分析软件行半定量分析目的产物与对应GAPDH产物的灰度值,目的mRNA表达水平以目的mRNA扩增条带灰度值与GAPDH mRNA扩增条带灰度值比值表示并分析。
四、蛋白质印迹法(Western blot)
取适量组织于研钵中研碎,加入150 μl裂解液冰上裂解30 min,获取组织蛋白样品。BCA法对蛋白进行定量。将样品及蛋白质分子量标准溶液行SDS-PAGE凝胶电泳分离,经电转膜仪转至PVDF膜。然后用5%脱脂奶粉室温封闭2 h,分别加一抗AXL抗体(1∶1000)、E-cadherin抗体(1∶1000)、Slug抗体(1∶1000)、Vimentin抗体(1∶1000),4 ℃杂交过夜。膜漂洗后,HRP标记二抗IgG室温孵育1 h(1∶5000),漂洗后加ECL显色。应用凝胶成像系统及凝胶图像分析软件分析目的产物与对应GAPDH产物电泳条带的灰度值。目的蛋白表达水平以目的蛋白电泳条带灰度值与GAPDH电泳条带灰度值比值表示并分析。
五、免疫组化染色
AXL、E-cadherin、Slug及Vimentin蛋白检测:标本经甲醛溶液固定,常规脱水、石蜡包埋,将石蜡包块连续切片(以4 μm为厚度)。应用SABC法行免疫组化染色,染色步骤按试剂盒说明书进行。所有石蜡切片60 ℃烘箱中烘片30 min,依次二甲苯脱蜡,梯度乙醇脱水,3%过氧化氢溶液浸泡10 min灭活内源性过氧化氢酶,蒸馏水冲洗后置入柠檬酸缓冲液中,微波加热法高火7 min,低火10 min修复抗原。自然冷却后,PBS冲洗,滴加5%牛血清白蛋白(BSA)封闭液,室温30 min后,甩去多余液体,不冲洗。滴加一抗(稀释浓度为AXL为1∶100,E-cadherin为1∶400,Slug为1∶200,Vimentin为1∶300)后,置湿盒4 ℃孵育过夜。PBS冲洗后滴加二抗,室温孵育30 min。PBS冲洗后,滴加SABC,室温孵育30 min,PBS冲洗后用DAB染色。DAB显色后,蒸馏水冲洗,苏木素复染3 min,盐酸酒精分化。最后脱水、烘干、封片和显微镜下观察。以PBS替代一抗作为阴性对照,以试剂公司提供的已知阳性切片为阳性对照。
六、免疫组化染色评分
切片经两名病理科医生在未知临床病理资料情况下阅片评分,并协商取得统一。染色结果判定标准:①根据染色强度判定:无阳性染色为0分;浅黄色染色为1分;深黄色染色为2分;棕黄色染色为3分。②根据阳性细胞着色比率判定:0%为0分;1%~25%为1分;26%~50%为2分;51%~75%为3分;>75%为4分。最终以染色的评分和染色细胞所占比率的评分乘积作为每张切片的最终染色评分。0~3分视为阴性,>3分视为阳性。
七、统计学处理

结 果
一、胃癌组织和癌旁组织中AXL、E-cadherin、Slug及Vimentin表达的比较
应用RT-PCR和Western blot技术检测42例胃癌组织及相应的癌旁组织中的AXL蛋白及核酸表达。结果表明,胃癌组织中AXL蛋白及核酸表达均显著高于其相应的癌旁组织(P<0.05)。(图1、2)应用免疫组化技术检测102例胃癌组织及相应的癌旁组织中的AXL蛋白表达。染色结果表明,AXL、Slug及Vimentin在胃癌组织中均有广泛表达,而E-cadherin在癌旁组织中广泛表达(图3)。102例胃癌组织标本中AXL的表达率为58.8%(60/102),高于癌旁组织中的表达(P=0.002)。E-cadherin在胃癌组织中的表达率为39.2%(40/102),明显低于癌旁组织中的表达(P<0.001)。Slug在胃癌组织中的表达率为54.9%(56/102),高于癌旁组织中的表达(P=0.017)。Vimentin在胃癌组织中的表达率为56.9%(58/102),高于癌旁组织中的表达(P=0.001)。(表1)

图1 胃癌原发灶组织及癌旁正常胃黏膜组织中AXL蛋白的表达

图2 胃癌原发灶组织及癌旁正常胃黏膜组织中AXL核酸的表达
二、胃癌组织中AXL、E-cadherin、Slug及Vimentin表达与胃癌病人临床病理间的关系(表2)
AXL、Slug及Vimentin在T3+T4期(T分期)、Ⅲ+Ⅳ期(TNM分期)及N1+N2+N3期(N分期)胃癌中的表达明显高于T1+T2期、Ⅰ+Ⅱ期及N0期胃癌中的表达,差异有统计学意义(P<0.05)。相反,E-cadherin在T3+T4期、Ⅲ+Ⅳ期及N1+N2+N3期胃癌中的表达明显低于T1+T2期、Ⅰ+Ⅱ期及N0期胃癌中的表达,差异有统计学意义(P<0.05)。但是,AXL、E-cadherin、Slug及Vimentin在胃癌组织中的表达与胃癌病人年龄、性别、肿瘤直径、Lauren分型、血管浸润和淋巴管浸润等因素无关(P>0.05)。(表2)

表1 102例胃癌组织和癌旁组织中AXL、E-cadherin、Slug及Vimentin的表达[例(%)]
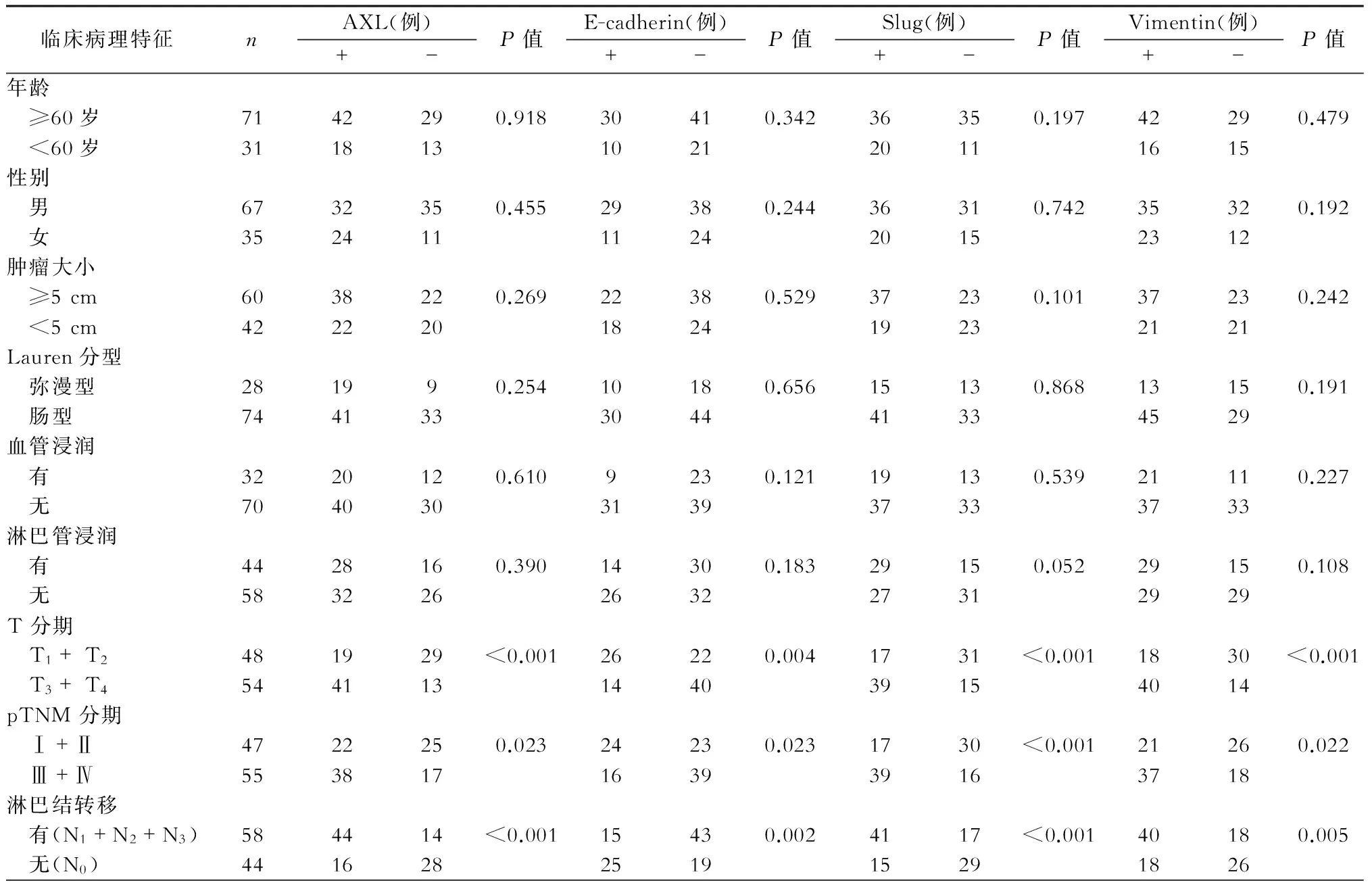
表2 胃癌组织中AXL、E-cadherin、Slug和Vimentin的表达与胃癌病人临床病理特征间的关系
三、胃癌组织中AXL、E-cadherin、Slug及Vimentin表达的相关性
Spearman等级相关分析显示,AXL与E-cadherin在胃癌组织中的表达呈负相关(r=-0.470,P<0.001);AXL与Slug在胃癌组织中的表达呈正相关(r=0.323,P=0.001);AXL与Vimentin在胃癌组织中的表达呈正相关(r=0.317,P=0.001)。(表3)
四、生存分析
Kaplan-Meier法生存分析显示AXL、Slug和Vimentin阳性组生存时间小于阴性组生存时间,而E-cadherin阳性组生存时间大于阴性组生存时间,经Log-rank法检验各组生存时间具有统计学意义(AXLP<0.001; SlugP<0.001; VimentinP=0.009; E-cadherinP<0.001)(图4)。

表3 AXL、E-cadherin、Slug和Vimentin在胃癌组织中表达强度的相关性(例)

A.胃癌组织中AXL呈阳性表达;B.胃癌组织中E-cadherin呈阳性表达;C.胃癌组织中Slug呈阳性表达;D.胃癌组织中Vimentin呈阳性表达;E.癌旁正常胃黏膜组织中AXL呈阴性表达;F.癌旁正常胃黏膜组织中E-cadherin呈阳性表达;G.癌旁正常胃黏膜组织中Slug呈阴性表达;H.癌旁正常胃黏膜组织中Vimentin呈阴性表达图3 胃癌原发灶及癌旁正常胃黏膜组织中AXL、E-cadherin、Slug及Vimentin蛋白的表达(SABC法,×200)

A.AXL阳性表达与AXL阴性表达的比较;B.E-cadherin阳性表达与E-cadherin阴性表达的比较;C.Slug阳性表达与Slug阴性表达的比较;D.Vimentin阳性表达与Vimentin阴性表达的比较图4 胃癌原发灶中AXL、E-cadherin、Slug及Vimentin阳性表达组与阴性表达组胃腺癌病人生存曲线
Cox风险回归多因素生存分析显示,AXL阳性表达(P=0.022)、Slug阳性表达(P=0.004)及淋巴结转移(P=0.029)是影响胃腺癌病人术后生存的独立因素(表4)。

表4 Cox回归模型多因素生存分析结果
讨 论
胃癌是我国常见的恶性肿瘤,近年来尽管胃癌的早期诊断、手术方式及新辅助化疗取得了一定的进步,但其5年生存率仍不足30%[16]。其预后不良的重要原因是局部浸润和远处转移,大部分胃癌确诊时已是进展期,因发生转移而失去根治性手术的机会,因此探索胃癌侵袭转移的机制及寻找其关键的基因,可为胃癌预后判断及治疗提供新的方向。
EMT与肿瘤侵袭转移密切相关,转录因子Slug在多种恶性肿瘤中下调上皮细胞标志物E-cadherin的表达,诱导EMT的发生[17-18]。本研究发现,Slug和Vimentin在胃癌原发灶组织中的表达均高于其相应的癌旁组织中的表达,并且与胃癌的T分期、pTNM分期及淋巴结转移相关。此外,胃癌原发灶组织中Slug及Vimentin表达阳性,则病人5年生存率较低;而E-cadherin的结果正好与Slug和Vimentin相反,预示着EMT在胃癌的发生、发展中占据重要的地位。
AXL其胞膜外区与神经细胞黏附分子结构相似,胞质区为酪氨酸激酶样区,具有激酶活性。AXL因其特殊的结构,既有黏附分子的特点,又具有酪氨酸激酶的活性,在细胞的黏附与增殖中均有一定的作用[10]。Holland等[19]研究发现AXL通过基质因子玻璃粘连蛋白调节新颖的内皮细胞趋触性迁移。Shieh等[20]研究证实,侵袭能力较高的肺腺癌细胞中AXL表达要显著高于侵袭能力较低的肺腺癌细胞系;干扰AXL的表达,其细胞侵袭能力也随之减弱,提示AXL的表达与肺腺癌细胞系的侵袭转移能力密切相关。此外,Asiedu等[12]近期研究显示,在乳腺癌中,AXL通过调控转录因子Slug的表达促进EMT的发生,从而调控肿瘤细胞的侵袭转移能力。在本研究中,我们发现AXL核酸及蛋白在胃癌原发灶组织中的表达均高于其相应的癌旁组织中的表达,且胃癌原发灶组织中AXL的表达与胃癌的T分期、pTNM分期及淋巴结转移相关;同样,胃癌原发灶组织中AXL表达阳性,则病人5年生存率较低。此外,相关分析显示胃癌中AXL的表达与Slug及Vimentin表达呈正相关,而与E-cadherin表达呈负相关。Cox风险回归多因素生存分析显示,AXL阳性表达亦是影响胃腺癌病人术后生存的独立因素。因此,我们推断胃癌组织中AXL表达的升高可促进Slug表达从而在转录水平上抑制E-cadherin表达,诱导Vimentin表达,在胃癌的发生、发展及侵袭转移中发挥重要作用。
综上所述,AXL在胃癌原发灶中高表达,其表达水平与胃癌的侵袭转移密切相关,AXL可能通过调控Slug诱导EMT的分子机制参与胃癌的侵袭转移。因此,AXL可能在胃癌形成、侵袭及转移过程中扮演着重要角色,对AXL在胃癌组织中的表达检测可能是预判胃癌复发和转移的可行方法,并有望成为胃癌靶向治疗的靶点。由此可知,针对胃癌中AXL表达的研究对胃癌的早期诊断、治疗和预后具有重要意义,针对AXL的干扰措施将会为胃癌的治疗提供新的研究方向和治疗途径,但是对AXL介导的EMT具体过程还有待于深入研究。
1 Jemal A, Bray F, Center MM, et al. Global cancer statistics. CA Cancer J Clin, 2011, 61:69-90. DOI: 10.3322/caac.20107.
2 Nagini S. Carcinoma of the stomach: A review of epidemiology, pathogenesis, molecular genetics and chemoprevention. World J Gastrointest Oncol, 2012, 4:156-169. DOI: 10.4251/wjgo.v4.i7.156.
3 Forman D, Burley VJ. Gastric cancer: global pattern of the disease and an overview of environmental risk factors. Best Pract Res Clin Gastroenterol, 2006, 20:633-649. DOI:10.1016/j.bpg.2006.04.008.
4 Goh KL. Changing trends in gastrointestinal disease in the Asia-Pacific region. J Dig Dis, 2007, 8:179-185. DOI: 10.1111/j.1751-2980.2007.00304.x.
5 Lamouille S, Xu J, Derynck R. Molecular mechanisms of epithelial-mesenchymal transition. Nat Rev Mol Cell Biol, 2014, 15:178-196. DOI: 10.1038/nrm3758.
6 Cardiff RD. Epithelial to mesenchymal transition tumors: fallacious or snail's pace?. Clin Cancer Res,2005,11:8534-8537.DOI:10.1158/1078-0432.CCR-05-2250.
7 Cowin P, Rowlands TM, Hatsell SJ. Cadherins and catenins in breast cancer. Curr Opin Cell Biol, 2005, 17:499-508. DOI:10.1016/j.ceb.2005.08.014.
8 Saitoh M, Shirakihara T, Miyazono K. Regulation of the stability of cell surface E-cadherin by the proteasome. Biochem Biophys Res Commun, 2009, 381:560-565. DOI: 10.1016/j.bbrc.2009.02.098.
9 Peng Z, Wang CX, Fang EH, et al. Role of epithelial-mesenchymal transition in gastric cancer initiation and progression. World J Gastroenterol, 2014, 20:5403-5410. DOI: 10.3748/wjg.v20.i18.5403.
10 Wu YM, Robinson DR, Kung HJ. Signal pathways in up-regulation of chemokines by tyrosine kinase MER/NYK in prostate cancer cells. Cancer Res,2004,64:7311-7320. DOI: 10.1158/0008-5472.CAN-04-0972.
11 Robinson D, He F, Pretlow T, et al. A tyrosine kinase profile of prostate carcinoma. Proc Natl Acad Sci USA, 1996, 93:5958-5962.
12 Asiedu MK,Beauchamp-Perez FD,Ingle JN,et al. AXL induces epithelial-to-mesenchymal transition and regulates the function of breast cancer stem cells. Oncogene,2014,33:1316-1324.DOI:10.1038/onc.2013.57.
13 Gjerdrum C, Tiron C, H iby T, et al. Axl is an essential epithelial-to-mesenchymal transition-induced regulator of breast cancer metastasis and patient survival. Proc Natl Acad Sci USA, 2010, 107:1124-1129. DOI: 10.1073/pnas.0909333107.
14 Dunne PD, McArt DG, Blayney JK, et al. AXL is a key regulator of inherent and chemotherapy-induced invasion and predicts a poor clinical outcome in early-stage colon cancer. Clin Cancer Res,2014,20:164-175.DOI:10.1158/1078-0432.CCR-13-1354.
15 Lee HJ,Jeng YM,Chen YL,et al. Gas6/Axl pathway promotes tumor invasion through the transcriptional activation of Slug in hepatocellular carcinoma. Carcinogenesis, 2014, 35:769-775. DOI: 10.1093/carcin/bgt372.
16 Leung WK, Wu MS, Kakugawa Y, et al. Asia Pacific Working Group on Gastric Cancer. Screening for gastric cancer in Asia: current evidence and practice. Lancet Oncol, 2008, 9:279-287. DOI: 10.1016/S1470-2045(08)70072-X.
17 Thiery JP. Epithelial-mesenchymal transitions in tumour progression. Nat Rev Cancer,2002,2:442-454. DOI:10.1038/nrc822.
18 Kumar B,Uppuladinne MV,Jani V,et al. Auto-regulation of Slug mediates its activity during epithelial to mesenchymal transition. Biochim Biophys Acta,2015,1849:1209-1218.DOI:10.1016/j.bbagrm.2015.07.006.
19 Holland SJ, Powell MJ, Franci C, et al. Multiple roles for the receptor tyrosine kinase axl in tumor formation. Cancer Res, 2005, 65:9294-9303. DOI: 10.1158/0008-5472.CAN-05-0993.
20 Shieh YS, Lai CY, Kao YR, et al. Expression of axl in lung adenocarcinoma and correlation with tumor progression. Neoplasia, 2005, 7:1058-1064.
Expression and significance of AXL in human gastric cancer
DaiPing,LongYongjun,MengPei,WangKun.
DepartmentofGeneralSurgery,BaoshanBranchofShanghaiFirstPeople'sHospitalAffiliatedtoShanghaiJiaoTongUniversitySchoolofMedicine,Shanghai200940,China.
DaiPing,Email:daiping999@126.com
Objective To investigate the clinical significance and expression of AXL and EMT-related proteins (E-cadherin, Slug and Vimentin) in human gastric cancer, and explore the role of AXL-mediated EMT in the development of gastric cancer.Methods The expression levels of AXL mRNA and protein in 42 cases were detected using RT-PCR and Western blotting respectively. And 102 cases were immunohistochemically examined for the expression of AXL and EMT-related proteins in primary lesion and adjacent normal gastric mucosas. The relationships between AXL and EMT-related proteins, as well as their correlations with clinicopathologic features and survival time were analyzed.Results (1)The AXL mRNA and proteins expression levels were increased in primary lesions as compared with adjacent normal gastric mucosas (bothP<0.001). The expression levels of AXL, Slug and Vimentin in primary lesions were significantly higher than those in adjacent normal gastric mucosas (58.8% vs. 37.3%,P=0.002; 54.9% vs. 38.2%,P=0.017; and 56.9% vs. 33.3%,P=0.001). E-cadherin showed significantly lower expression in primary lesions (39.2% vs. 68.6%,P<0.001).(2)The expression levels of AXL and EMT-related proteins were closely correlated with T stage (P<0.001;P=0.004;P<0.001;P<0.001), pTNM stage (P=0.023;P=0.023;P<0.001;P=0.022) and lymph node metastasis (P<0.001;P=0.002;P<0.001;P=0.005).(3)The expression level of AXL was positively related with that of Slug (r=0.323,P=0.001) and Vimentin (r=0.317,P=0.001), but negatively with E-cadherin expression (r=-0.470,P<0.001) in primary lesions.(4)Patients with gastric cancer positive for AXL-1 (P<0.001), Slug (P<0.001), or Vimentin (P=0.009) but negative for E-cadherin (P<0.001) had poorer prognosis. Cox analysis revealed that AXL-positive (P=0.022), Slug-positive (P=0.004) and lymph node metastasis (P=0.029) were the independent risk factors for survival time.Conclusions AXL played a critical role in the development of gastric cancer, and probably facilitated the invasion and metastasis of gastric cancer through the induction of EMT.
Gastric cancer; AXL; E-cadherin; Slug; Vimentin
200940 上海,上海交通大学医学院附属第一人民医院宝山分院普外科
戴平,Email:daiping999@126.com
R735.2
A
10.3969/j.issn.1003-5591.2016.03.019
2015-11-23)

