家兔血气指标正常值测定及初步分析
韩丽丽 丛馨 宋德懋
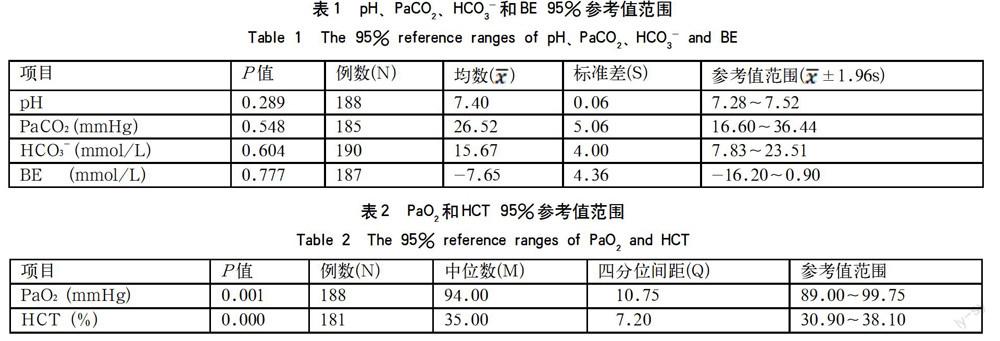
摘要:目的统计家兔血气指标正常值,为教学实验及研究提供数据参考。方法选取健康成年大耳白兔190只,麻醉状态下股动脉取血,利用血气分析仪测定各项血气指标,通过颈总动脉插管监测血压。结果pH值:7.28~7.52;二氧化碳分压(PaCO2):16.60~36.44mmHg;氧分压(PaO2):89.00~99.75mmHg;红细胞比容(HCT):30.90~38.10%;碳酸氢盐(HCO3-):7.83~23.51mmol/L;碱剩余(BE):-16.20~0.90mmol/L。结论家兔血气指标正常值与人类相比存在较大差异。
关键词:家兔;血气指标;正常值
中图分类号:Q95-33 文献标识码:A 文章编号:1672-3791(2016)04(b)-0000-00
Abstract: Objective: To quantify and analyze the normal blood gas indexes in rabbits, and provide references for teaching and research experiments. Methods: 190 Health adult rabbits were chosen and the artery blood was harvested from the femoral artery under anesthesia. The blood gas indexes were measured by use of blood gas analyzer, and the blood pressure was monitored through the common carotid artery. Results: pH: 7.28-7.52; partial pressure of carbon dioxide (PaCO2): 16.60-36.44mmHg; partial pressure of oxygen (PaO2): 89.00-99.75mmHg; hematocrit (HCT): 30.90-38.10%; bicarbonate (HCO3-): 7.83~23.51mmol/L; base excess (BE): -16.20-0.90mmol/L. Conclusion: The normal blood gas indexes of rabbit showed great differences compared with that of human.
Keywords: Rabbit; blood gas index; normal value
家兔是生理学与病理生理学实验教学中常用的实验动物。在机能实验教学中,酸碱平衡紊乱实验颇为重要,并且普遍使用家兔作为实验对象。但我们的教材中提供的大多是人的正常血气指标数据,关于家兔的血气指标正常参考值报道较少。在教学中,经常会有学生提出疑问——家兔血气值与人类是否相同?有何差异?为更好的服务教学工作,本实验对近两个学期酸碱平衡紊乱实验中家兔血气指标正常值的实验数据进行了初步统计分析,旨在为今后的教学及科研提供参考。
1 实验材料与方法
实验材料
实验动物
2014年11月至2015年11月期间,选取健康成年大耳白兔190只,雌雄不限,体重2.0 ~3.0kg,普通级,由北京大学医学部实验动物饲养中心提供。
仪器设备
采用丹麦雷度米特(RADIOMETER)公司生产的ABL80全自动血气分析仪,原装试剂包及测试卡,在室温(18~28℃)下,测定家兔动脉血的血气指标:pH值、二氧化碳分压(PaCO2)、氧分压(PaO2)、红细胞比容(HCT)、碳酸氢盐(HCO3-)和碱剩余(BE),剔除实验中极值。采用成都泰盟公司生产的BL-420S生物机能实验系统监测血压。
实验方法
动物手术
称重与固定
将家兔称重后仰卧位放于兔台上,采用背位交叉固定法,即先将后肢绑紧于兔台底端的金属框上,然后将两前肢的固定带在背部交叉后分别压住对侧前肢的前臂,并绑紧于兔台两侧的金属框上,最后将头部用兔头固定器固定,适当调整固定器高度,使家兔颈部平直。
备皮与麻醉
将颈部与一侧腹股沟处剪毛备皮。采用局部麻醉方式,每部位用2~3ml 1%普鲁卡因作皮下浸润性注射,边进针边注药至整个手术区域均被浸润。颈部沿颈正中线进行麻醉,腹股沟部位沿股动脉走行方向进行麻醉。
气管插管
在甲状软骨下沿颈正中线作4~6cm皮肤切口,钝性分离皮下组织,暴露颈部肌肉,分开颈部正中肌群即可看到气管。在甲状软骨下1~2cm处剪一倒“T”型切口,注意,为避免较多出血,横向切口尽量剪在软骨环上,然后将气管插管沿向心方向插入并固定。
分离血管
本实验需分离一侧颈总动脉及股动脉两处血管。分离颈总动脉用于监测血压,翻开气管一侧肌肉层,将颈总动脉从血管神经鞘中分离出来,游离出3~4cm,下穿两根细线备结扎固定插管用。分离股动脉用于取血,测定血气指标,沿股动脉走行方向作3~4cm长皮肤切口,钝性分离皮下组织,将股动脉同股神经及股静脉分离开,并游离出2~3cm,穿线备用。
肝素化
耳缘静脉注射0.5%肝素溶液5ml/kg,行全身肝素化抗凝血。
动脉插管
先将两动脉插管内充满肝素,然后结扎动脉远心端,用动脉夹夹闭近心端,用眼科剪在近结扎线处45°角向心方向剪一小斜口,插入动脉插管并结扎固定。
描记正常血压曲线
打开BL-420S生物机能实验系统,描记一段正常的血压曲线。
股动脉取血
用1ml注射器吸取少量肝素,将管壁润湿后推出,然后将针头刺入橡皮塞以隔绝空气。打开三通活塞,松开动脉夹,弃去前2~3滴血液后,迅速除掉注射器上的针头,立即插入三通活塞,取血0.5ml(注意勿进入气泡)。关闭三通活塞,拔出注射器并立即套上原针头,转动注射器30秒,使血液与肝素混合。
血气指标测定
将ABL80血气分析仪探针插入血样中,按照标准操作程序进行测定,并打印各项数据。
统计学处理
使用SPSS18.0统计软件对实验数据进行Shapiro-Wilk正态性检验,P>0.05呈正态分布,其95%参考值范围选用公式x ?± 1.96S表示;P<0.05呈偏态分布,其95%参考值范围选用百分位数法P2.5和P97.5表示。对PaCO2、PaO2与HCT三组实验数据作Pearson直线相关性分析,计算相关系数r值并作t检验,P<0.05表示具有统计学意义。
结果
2.1 各项血气指标值
对pH值、PaCO2、PaO2、HCT、HCO3-和BE数据进行Shapiro-Wilk正态性检验,结果显示:pH值、PaCO2、HCO3-和BE呈正态分布(P > 0.05),因此其95 %参考值范围选用公式x ?±1.96S进行计算(表1);PaO2和HCT呈偏态分布(P < 0.05),因此其95 %参考值范围选用百分位数法P2.5和P97.5 进行计算(表2)。
2.2PaCO2与PaO2的相关关系
Pearson直线相关性分析结果显示:PaCO2与PaO2成显著负相关(r=-0.325,P<0.01)。
讨论
本实验对190只教学用健康大耳白兔血气指标正常值进行了测定,结果显示,家兔的血气值除pH值、PaO2与人类较为接近以外,其他指标PaCO2、HCT、HCO3-和BE与健康人体血气均值相比均偏低[1,2]。本实验结果与已报道资料的检测结果略有差异。如本实验检测家兔动脉血pH均值7.40,参考范围7.28~7.52,这与人类动脉血正常pH值范围7.35~7.45相比,虽波动范围较大,但差异不大。国内研究报道家兔动脉血pH均值由7.37~7.53不等[3-8],国外所报道的家兔或实验兔动脉血pH均值位于7.33-7.50之间[9-14]。而本实验中PaO2数值与本校前期报道结果基本一致[3],但均高于国内其他已报道PaO2的研究结果。
我们认为造成以上差异的可能原因有:家兔品系不同,饲养条件不一,测定仪器各异,地区差异等,另外,国外有文献报道,是否麻醉及采用不同麻药种类也会对家兔血气值造成影响[11,14]。麻醉药如乌拉坦,普鲁卡因等会在不同程度上对家兔呼吸产生抑制作用,再加上家兔属草食性动物,消化管较长,容易压迫隔膜导致肺不张,所以,为避免家兔在麻醉后与插管前这段时间内由于呼吸抑制出现短暂高碳酸血症,我们建议待气管插管后5~10min再进行动脉取血,另外,气管横向切口尽量剪在软骨环,也是避免出血较多灌入气管造成家兔呼吸不畅的有效方法。此外,实验未考虑测定温度、时间等因素的影响,实验手术操作及动脉取血在机能实验教学过程中,学生操作不规范可能会对实验数据造成轻微影响,比如血样短时间与空气接触或存在少量气泡等。为使结果相对准确,实验中仪器设备由专业技术老师负责并尽可能扩大统计样本量。
分析数据后,我们还发现,家兔动脉血中PaCO2与PaO2成显著负相关(r=-0.325,P<0.01)。根据波尔效应,PaCO2升高,可使Hb与O2的亲和力下降,促进氧气的释放。而根据何尔登效应,O2与Hb结合会促进CO2的释放。这两种效应从侧面证明了我们的数据是可靠的。
综上所述,我们认为本实验结果真实可信,对今后教学有一定参考价值。
参考文献
[1] 吴立玲.病理生理学·第二版[M].北京:北京大学医学出版社,2011:38-58.
[2] 祝世功.医学机能学实验教程[M].北京:北京大学医学出版社,2008:80-81.
[3] 余晓星,窦豆,徐海,等.酸碱平衡紊乱实验中家兔血气正常值统计[J].科技创新导报, 2009,(29):175-176.
[4] 张春军,崔林,徐上知.家兔血气指标正常值的探讨[J].石河子大学学报(自然科学版),2005,23(3):310-312.
[5] 吴芳,张帆,张宏,等.家兔酸碱常用检测指标正常值的初步测定[J].农垦医学,2013, 35(6):521-523.
[6] 郝刚,江瑛,张立克,等.家兔血气指标正常值的初探[J].首都医科大学学报(社科版),2007, 28(增刊):165,171.
[7] 闫峰,吉训明,田欣,等.新西兰兔血气和部分血液生理生化参数的测定[J].实验动物科学,2010,27(2):55-57.
[8] 马兰,赵迅霞,李桂忠.宁夏产家兔动脉血液酸碱度和气体正常值的测定[J].宁夏医学院学报,1996,18(1):81-82.
[9] L.Benato, M.Chesnel, K.Eatwell, etal.Arterial blood gas parameters in pet rabbitsanaesthetized using a combination of fentanyl-fluanisone-midazolam-isoflurane. Journal Of Small Animal Practice2013,54(7):343-346.
[10]Allweiler, S., Leach, M. C. & Flecknell, P. A. The use of propofol and sevoflurane for surgical anaesthesia in new zealand white rabbits. Laboratory Animals 2010,44(2): 113–117.
[11] Topal, A. & Gul, N. Comparison of the arterial blood gas, arterial oxyhaemoglobin saturation and the end-tidal carbon dioxide during sevofluorane and isofluraneanaesthesia in rabbits. Irish Veterinary Journal 2006,59: 278–281.
[12] Schroeder, C. A. & Smith, L. J. Respiratory rates and arterial blood-gas tensions in healthy rabbits given buprenorphine, butorphanol, midazolam or their combinations. Journal of the American Association for Laboratory Animal Science 2011, 50:205–211.
[13] Eatwell K1, Mancinelli E, Hedley J, et al. Use of arterial blood gas analysis as a superior method for evaluating respiratory function in pet rabbits(Oryctolaguscuniculus).Veterinary Record 2013, 173(8):191.
[14]Patricia Hedenqvist, Anna Edner and Marianne Jensen-Waern.Anaesthesia in medetomidine
premedicated New Zealand White rabbits: a comparison between intravenousufentanil-
midazolam and isofluraneanaesthesia for orthopaedic surgery. Laboratory Animals 2014,48(2):155-163.

