火龙果炭疽病病原菌的鉴定及生物学特性研究
朱迎迎 李敏 高兆银 章武 杨冬平 陈亮
摘要:【目的】明确火龙果果实炭疽病病原菌的种类及其生物学特性,为火龙果炭疽病病害防控提供理论依据。【方法】通过致病性测定、形态学特征观察及rDNA-ITS序列和系统发育树分析的方法对引起火龙果果实炭疽病的病原菌进行鉴定,并初步研究其生物学特性。【结果】供试菌株ITS序列为576 bp,与平头炭疽菌(登录号:HQ896482、AF451899)、辣椒炭疽菌(登录号:JX910365、HQ271465)的同源性均达100%;系统发育分析结果表明,该菌株与平头炭疽菌和辣椒炭疽菌具有很近的遗传关系。该菌菌丝生长的适宜温度为20~30 ℃,产孢适宜温度为25~35 ℃,最适生长和产孢温度为30 ℃,致死温度为60 ℃处理10 min;菌丝适宜生长pH为4~9,最适pH为8,产孢适宜pH为4~7,最适产孢pH为4;最适碳源为蔗糖和D-果糖,最适氮源为牛肉膏和蛋白胨,可溶性淀粉和硝酸铵有利于該菌产孢;连续光照和光暗交替有利于菌丝生长,黑暗则有利于该菌产孢。【结论】引起海南省火龙果果实炭疽病的另一种病原菌是平头炭疽菌[C. truncatum (Schw.) Andrus & Moore],该菌不仅侵染火龙果果实,还能侵染大豆豆荚和番茄果实。
关键词: 火龙果;炭疽病;平头炭疽菌;rDNA-ITS;生物学特性
中图分类号: S436.67 文献标志码:A 文章编号:2095-1191(2016)01-0059-08
0 引言
【研究意义】火龙果(Hylocereus undulatus)又称红龙果,为仙人掌科量天尺属植物,是典型的热带水果(郑良永,2004)。火龙果果实外形独特,含丰富的植物性蛋白、矿物质、抗氧化物质等,口味佳,深受人们喜爱。近年来,随着火龙果栽培面积的不断扩大,其病害问题更加明显,严重影响了火龙果的产量和品质(胡美姣等,2010;李敏等,2012a)。炭疽病是火龙果上的一种重要病害,具有潜伏侵染性,主要危害火龙果果实,常在采后贮运时发生,造成重大经济损失(袁诚林等,2004;李茂和蒋昌顺,2008;Phoulivong et al.,2010)。因此,对火龙果果实炭疽病病原菌进行分离、鉴定,并初步探究其生物学特性,对火龙果炭疽病的综合防治具有重要意义。【前人研究进展】关于火龙果病害,前人的研究主要集中在采前田间病害防治方面,在果实采后病害方面的研究报道较少。胡美姣等(2010)对火龙果采后病害研究发现,胶孢炭疽菌(Collectotrichum gloeosporioides)是引起火龙果果实炭疽病的主要病原菌。李敏等(2012b)对火龙果采后病害发生种类及病原菌种类进行调查,发现胶孢炭疽菌(C. gloeosporioides)和辣椒炭疽菌(C. capsici)是引起海南省火龙果果实炭疽病的两种病原菌,且不同的病原菌所引起的病害症状不同。郑伟等(2014)对从火龙果炭疽病病株上分离得到的病原菌进行形态特征、致病性及核糖体DNA-ITS序列分析,结果发现胶孢炭疽菌(C. gloeosporioides)和平头炭疽菌(C. truncatum)均能引起贵州火龙果果实炭疽病,但未对病原菌的生物学特性进行研究。Guo等(2014)对火龙果果实病害进行分析,初步鉴定认为平头炭疽菌(C. truncatum)能引起云南省火龙果果实炭疽病,并认为该病原菌最适生长温度为25 ℃。【本研究切入点】大多数的研究认为胶孢炭疽菌是引起火龙果炭疽病的主要病原菌,而对其他病原菌引起的火龙果炭疽病及其生物学特性研究的报道较少。【拟解决的关键问题】通过对海南省火龙果果实炭疽病病原菌进行分离,发现除胶孢炭疽菌(C. gloeosporioides)外,还有其他种类炭疽菌(Collectotrichum sp.)也能引起炭疽病,因此,本研究在前人研究的基础上,采用组织分离、形态学特征结合分子鑒定的方法对所分离的病原菌进行种类鉴定,并初步研究其生物学特性,以期为火龙果炭疽病的防治提供理论依据。
1 材料与方法
1. 1 试验材料
从海南省海口市各超市、水果市场采集发病火龙果果实;健康火龙果果实购于海口市南北水果市场。
1. 2 试验方法
1. 2. 1 菌株分离及纯化 对典型炭疽病症状进行描述,并采用组织分离法对病原菌进行分离纯化。将所获得菌株进行初步筛选,剔除胶孢炭疽菌,其余菌株于4 ℃保存待用。
1. 2. 2 菌株致病性测定
1. 2. 2. 1 对火龙果的致病性测定 采用损伤接种法。取28 ℃恒温培养5 d的菌饼(ф=5 mm,下同)接种于健康火龙果果实上,每个果实接种2点,每处理3个果实,以无菌PDA培养基块为对照,置于保鲜盒中28 ℃恒温保湿培养,每天观察发病情况,明确该病原菌对火龙果的致病性。
1. 2. 2. 2 对其他作物的致病性测定 采用损伤接种法。取28 ℃恒温培养5 d的菌饼接种于健康大豆豆荚和番茄果实上,置于保鲜盒中28 ℃恒温保湿培养,每天观察发病情况,明确该病原菌对大豆豆荚和番茄的致病性。
1. 2. 3 病原菌形态学观察及鉴定 将纯化后的菌株接种于PDA培养基上,28 ℃倒置培养,每天观察菌落特征,在显微镜下观察菌丝体形态、产孢结构、刚毛及孢子形态、颜色、大小等特征,同时参考已有文献(戚佩坤,2000;陆家云,2001)进行病原菌形态学鉴定。
1. 2. 4 病原菌rDNA-ITS区扩增和序列分析
1. 2. 4. 1 病原菌基因组DNA提取及rDNA-ITS区PCR扩增 用灭菌小药勺轻轻刮取约100 mg新鲜菌丝于研钵中,用液氮充分研磨成粉状,采用植物基因组DNA提取试剂盒[购于天根生化科技(北京)有限公司]对病原菌基因组DNA进行提取。参照White等(1990)设计的真菌rDNA-ITS通用引物(上游引物ITS1:5'-TCCGTAGGTGAACCTGCGG-3',下游引物ITS4:5'-TCCTCCGCTTATTGATATGC-3')对病原菌rDNA-ITS区进行PCR扩增。PCR反应体系(50.0 μL):1.0 μL病原菌DNA,2.0 μL 10 μmol/L ITS1,2.0 μL 10 μmol/L ITS4,25.0 μL 2×(HS)Taq-Mixture,20.0 μL ddH2O。扩增程序:94 ℃预变性5 min;94 ℃ 30 s,50 ℃ 30 s,72 ℃ 10 s,进行35个循环;72 ℃延伸10 min。
1. 2. 4. 2 病原菌rDNA-ITS序列克隆及测序 采用TA Cloning试剂盒(购于Invitrogen公司)将回收纯化产物连接转化至大肠杆菌DH5α感受态细胞。将PCR检测阳性的产物送至北京诺赛基因组研究中心有限公司测序,将测序结果在NCBI网站上用BLAST软件与已知的植物病原菌ITS基因进行比对,分析它们之间的生物相似性。
1. 2. 5 病原菌生物学特性研究
1. 2. 5. 1 不同温度对菌丝生长和产孢量的影响 挑取菌龄一致的菌饼于PDA培养基上,分别置于5、10、15、20、25、28、30、35和40 ℃下倒置培养,每处理3个皿,5 d后采用十字交叉法测量菌落直径,10 d后用10 mL无菌水洗下孢子,采用血细胞计数板测定各梯度产孢量。重复3次。
1. 2. 5. 2 不同pH对菌丝生长和产孢量的影响 用无菌的0.1 mol/L NaOH和0.1 mol/L HCl调节灭菌后PDA培养基,制成pH分别为3、4、5、6、7、8、9、10和11的9种培养基,将菌饼分别接种于不同pH PDA培养基上,28 ℃倒置培养,其余方法同1.2.5.1。
1. 2. 5. 3 不同光照对菌丝生长和产孢量的影响 将菌饼接种于PDA培养基上,分别在黑暗、12 h光暗交替和连续光照的条件下,28 ℃倒置培养,其余方法同1.2.5.1。
1. 2. 5. 4 不同碳源对菌丝生长和产孢量的影响 参考胡美姣等(2013)的方法并略加修改。以査氏培养基为基础培养基(沈萍和陈向东,2007),分别用等摩尔C量的D-果糖、山梨醇、D-半乳糖、麦芽糖、葡萄糖、蔗糖、可溶性淀粉、D-木糖代替蔗糖,以无碳源培养基作对照,其余方法同1.2.5.1。
1. 2. 5. 5 不同氮源对菌丝生长和产孢量的影響 参考胡美姣等(2013)方法并略加修改。以査氏培养基为基础培养基(沈萍和陈向东,2007),分别用等摩尔N量的牛肉膏、蛋白胨、甘氨酸、L-精氨酸、L-苯丙氨酸、硝酸铵、硝酸钠、尿素代替硝酸钠,以无氮源培养基作对照,其余方法同1.2.5.1。
1. 2. 5. 6 致死温度测定 取菌饼置于含5 mL无菌水的离心管中,分别于50、55、60、65、70和75 ℃恒温水浴10 min,挑取菌饼接种至PDA培养基上,倒置培养,每天观察菌落生长情况。每处理3皿,重复4次。
1. 3 统计分析
利用SAS 8.1软件对试验数据进行处理,采用Duncans法进行多重比较分析。
2 结果与分析
2. 1 病害症状
该病危害火龙果果实,引起果实大量腐烂。发病初期,在果皮及其鳞片上出现污黄色、水渍状的小斑点,圆形,病斑扩大后,边缘呈污黄色至黄褐色水渍状、中央黑色凹陷,其上布满许多小颗粒,即为分生孢子盘及分生孢子(图1)。湿润时,发病部位长出红色粘稠物质,即为分生孢子堆。
2. 2 致病性测定结果
该菌可使火龙果果实致病,发病症状与自然发病时相似,病斑污黄色且呈较规则圆形,随后病斑不断扩大,中间为淡灰色至黑色,分布有黑色小点,即为分生孢子盘及分生孢子(图2),病健交界更明显。挑取病部病原物置于显微镜下观察,可见弯曲、单胞的分生孢子。该菌也侵染大豆豆荚、番茄果实,引起严重腐烂(图3)。
2. 3 病原菌形态鉴定
在PDA培养基上,该菌菌落圆形,边缘整齐,初期灰白色,绒毛状,后期为深灰色至墨绿色,菌丝暗灰色,菌落轮纹较清晰,基質黑褐色,菌落表面分散许多小颗粒即分生孢子盘及分生孢子,培养后期出现橘红色孢子堆。菌核不规则,表面为黑色,内部浅褐色,组织紧密;分生孢子盘椭圆形或扁圆形,黑褐色;刚毛黑褐色,顶端色浅,较尖,具有1~3分隔,基部无明显膨大,大小42.25~209.44 μm。分生孢子梗棒状。分生孢子无色,镰刀形,两头钝尖,单胞,有油滴,大小17.14~26.91(21.41)μm×2.43~5.49(3.44)μm。附着胞褐色,近圆形、扁球形、棒形或不规则,大小为6.9~11.3(8.4)μm×4.5~6.4(5.4)μm。
2. 4 病原菌rDNA-ITS序列和系统发育树分析
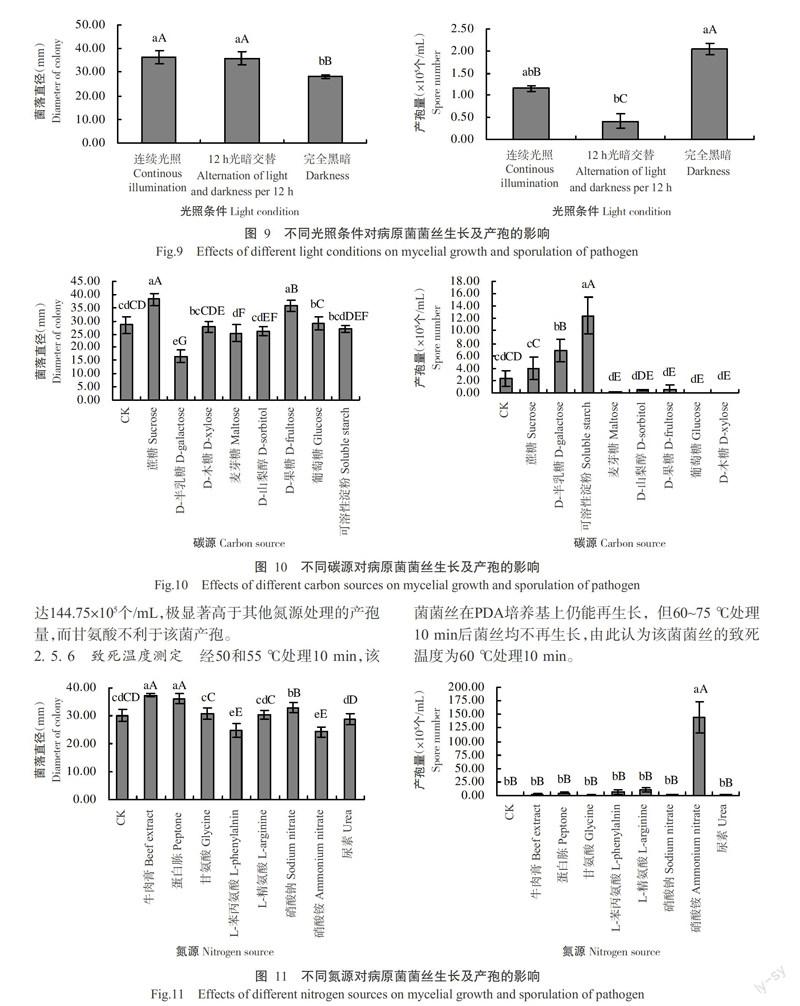
测序结果表明,供试菌株ITS序列为576 bp(图5)。在NCBI上BLAST比对发现,该菌ITS序列与平头炭疽菌(登录号:HQ896482、AF451899)、辣椒炭疽菌(登录号:JX910365、HQ271465)的同源性均达100%。用Neighbor-Joining构建系统发育树,另外选取10个同源性高低不同的菌株进行多重序列比较,并进行系统发育分析。该菌与平头炭疽菌(登录号:HQ896482、AF451899)和辣椒炭疽菌(登录号:JX910365、HQ27 1465)具有很近的遗传关系(图6)。因此,通过病原菌的形态鉴定、rDNA-ITS序列分析和系统发育树,以及致病性测定结果,确定引起海南省火龙果果实炭疽病的另一种病原菌为平头炭疽菌[C. truncatum(Schw.)Andrus & Moore],该病原菌在基因库中的登录号为:KP731886。
2. 5 病原菌生物学特性分析
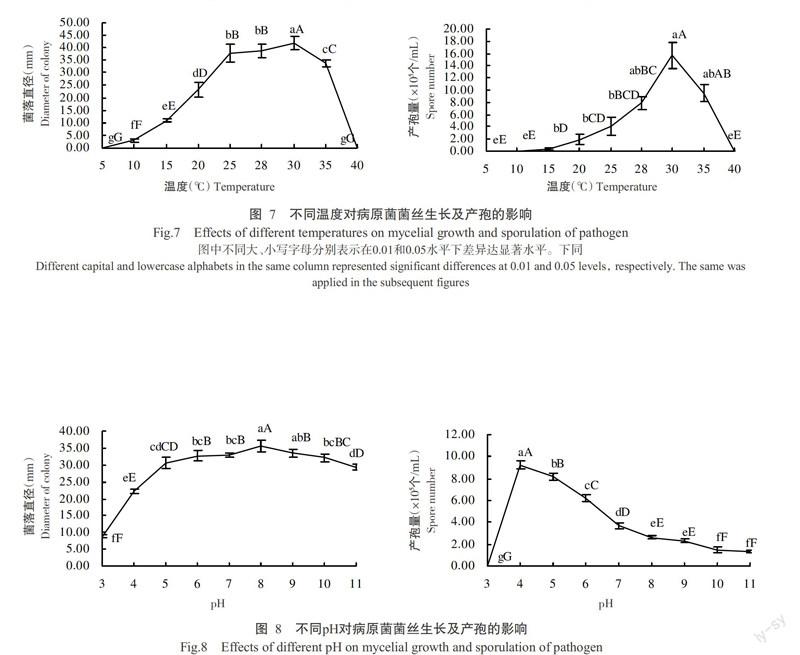
2. 5. 1 温度对菌丝生长及产孢量的影响 由图7可知,在5~30 ℃内,该菌菌丝生长速率随着温度升高而增大,在30 ℃时菌丝生长最快,菌落直径达41.78 mm,极显著高于其他温度条件下的菌落直径(P<0.01,下同);在35 ℃时,菌丝生长速率下降,40 ℃时不生长;该菌产孢量在15~30 ℃时逐渐升高,30 ℃时的产孢量最大,为15.67×105个/mL,除与35 ℃时产孢量不显著外(P>0.05,下同),极显著高于其他温度条件下的产孢量。本研究还发现,在5和40 ℃下该菌菌丝不能生长,但当温度恢复到30 ℃时,5 ℃的菌丝呈现缓慢生长现象,而40 ℃菌丝停止生长;10 ℃时,菌丝虽然生长但不产孢。故该菌适宜生长温度为20~30 ℃,产孢适宜温度为25~35 ℃,最适生长和产孢温度均为30 ℃。
2. 5. 2 pH对菌丝生长及产孢量的影响 由图8可知,该菌在弱酸、弱碱条件下均能够生长,在pH为3~8时,菌丝生长速率逐渐增快,pH为8时菌落最大,直径达35.63 mm,极显著高于其他处理的菌落大小,之后随着pH升高,菌丝生长速率下降。该菌在pH为3时不产孢,当pH为4时产孢量最大,达9.43×105个/mL,极显著高于其他处理的产孢量,之后随着pH升高,产孢量下降。故该菌适宜生长pH为4~9,最适pH为8,适宜产孢pH为4~7,最适产孢pH为4。
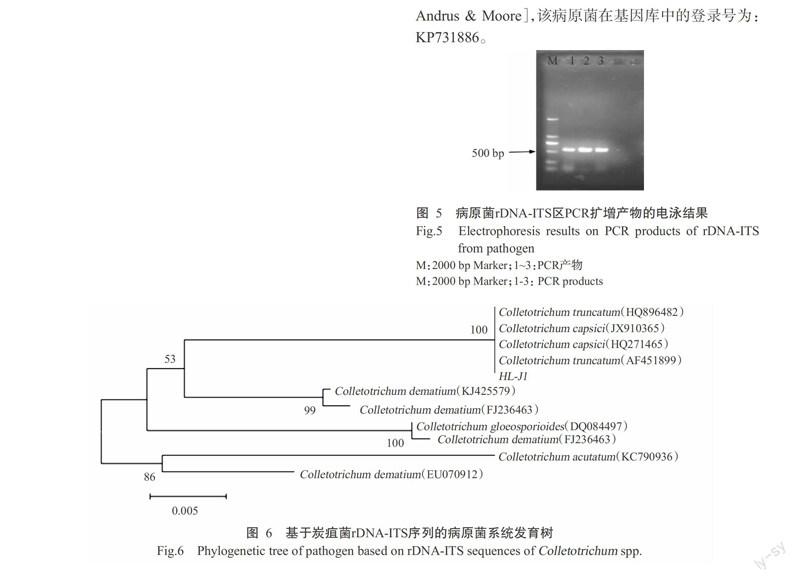
2. 5. 3 光照对菌丝生长及产孢量的影响 由图9可知,该菌在不同光照条件下均能生长,其中连续光照和12 h光暗交替条件下的菌落直径极显著高于完全黑暗条件下的菌落直径,且前两者菌落直径差异不显著。完全黑暗有利于产孢,产孢量为2.05×105个/mL,极显著高于其他2个处理的产孢量。
2. 5. 4 不同碳源对菌丝生长及产孢量的影响 由图10可知,该菌对蔗糖和D-果糖2种碳源的利用率最高,培养5 d后菌落直径分别达38.07和35.79 mm,极显著高于其他处理的菌落大小;在无碳源的培养基上菌丝虽然生长较快,但菌丝稀疏,较难观察;对其他碳源利用高低依次为葡萄糖>D-木糖>可溶性淀粉>D-山梨醇>麦芽糖>D-半乳糖。可溶性淀粉有利于该菌产孢,產孢量最大,为12.50×105个/mL,极显著高于其他处理的产孢量,而葡萄糖和D-木糖不利于该菌产孢。
2. 5. 5 不同氮源对菌丝生长及产孢量的影响 由图11可知,牛肉膏和蛋白胨为该菌适宜氮源,培养5 d后菌落直径达37.33和36.04 mm,极显著高于其他氮源处理的菌落大小;在无氮源的培养上菌丝虽然生长较快,但菌丝稀薄;对其他氮源利用高低依次是硝酸钠>甘氨酸>L-精氨酸>尿素>L-苯丙氨酸>硝酸銨。硝酸铵虽然不利于菌丝生长,但有利于该菌产孢,产孢量可达144.75×105个/mL,极显著高于其他氮源处理的产孢量,而甘氨酸不利于该菌产孢。
2. 5. 6 致死温度测定 经50和55 ℃处理10 min,该菌菌丝在PDA培养基上仍能再生长,但60~75 ℃处理10 min后菌丝均不再生长,由此认为该菌菌丝的致死温度为60 ℃处理10 min。
3 讨论
本研究分离获得的菌株的ITS序列与基因库中C. truncatum(登录号:HQ896482)、C. capsici(登录号:JX910365)的同源性均达100%,与Guo等(2014)报道一致。陈吴键(2007)研究发现,C. truncatum与C. capsici的菌落形态相似,但两者间存在一些区别,如C. capsici在培养基中不产生菌核,而C. truncatum产生菌核。本研究在培养后期观察到菌核。曾大兴等(2004)研究认为,C. truncatum和C. capsici是同一个种,而传统分类系统认为炭疽菌属的种在一定寄主植物上严格专化。孙志峰等(2008)和楼兵干等(2009)认为引起大豆豆荚炭疽病的病原菌种名用C. truncatum比C. Capsici更贴切。Guo等(2014)和郑伟等(2014)对引起火龙果果实炭疽病病原菌种名采用平头炭疽菌(C. truncatum)而不是辣椒炭疽菌(C. capsici)。本研究交互接种结果显示,从火龙果果实上分离的C. truncatum能侵染大豆豆荚和番茄果实,且发病快。此外,Von Arx(1970)认为炭疽菌的各形态单位在分类中的权重并不一样,分生孢子和附着胞的形态和大小是鉴定分类中的主要形态特征,但分生孢子盘、刚毛、菌落、菌核也可作为病原菌鉴定的辅助依据。因此,本研究综合考虑分生孢子、菌核与寄主特征、rDNA-ITS序列、系统发育树分析及种名应用的稳定性,认为引起海南省火龙果果实炭疽病的另一种病原菌是C. truncatum。该菌对其他作物的致病性测定结果表明,其还可侵染大豆豆荚、番茄果实等,与已报道C. truncatum引起大豆豆荚炭疽病(楼兵干等,2009;肖杰文等,2011)、番茄炭疽病(Diao et al.,2014)一致。此外,C. truncatum也能引起豇豆茎炭疽病(徐丽慧等,2014)、棉花炭疽病(杨友联等,2014),但对该菌株的寄主范围及专化型仍需进一步研究。
Guo等(2014)和郑伟等(2014)分别对引起云南省、贵州省火龙果果实炭疽病病原进行鉴定,发现其病原菌为平头炭疽菌(C. truncatum),但均未深入研究该菌生物学特性。本研究发现,火龙果平头炭疽菌菌丝生长的适宜温度为20~30 ℃,产孢适宜温度为25~35 ℃,最适生长和产孢温度均为30 ℃。Guo等(2014)认为该菌生长的最适温度为25 ℃,本研究结果较其略高,究其原因可能是菌株来源的地区间差异所造成。该菌菌丝适宜生长pH为4~9,最适生长pH为8,产孢适宜pH为4~7,最适产孢pH为4,与孙志峰等(2008)对大豆C. truncatum研究结果略有不同,其认为C. truncatum适宜的生长pH为4~7,可能是由于C. truncatum在进化过程中受寄主或环境条件的选择作用而产生变化。
该菌在以蔗糖和D-果糖作为碳源和以牛肉膏和蛋白胨作为氮源时菌丝生长最快,在无碳氮源时菌丝生长缓慢,菌丝稀疏,不易观察,说明火龙果平头炭疽菌的生长需要碳氮源。此外,可溶性淀粉为碳源、硝酸铵为氮源、酸性和黑暗条件下,均能促进该病原菌产孢。因此,在C. truncatum防治中要尽量避免其生长和产孢的有利条件。
4 结论
本研究结果表明,引起海南省火龙果果实炭疽病的另一种病菌原是平头炭疽菌[C. truncatum(Schw.)Andrus & Moore],该菌不仅侵染火龙果果实,还能侵染大豆豆荚和番茄果实。
参考文献:
陈吴健. 2007. 大豆豆荚炭疽病的病原鉴定及其防治[D]. 杭州:浙江大学.
Chen W J. 2007. Identification and control of soybean pod anthracnose[D]. Hangzhou: Zhejiang University.
胡美姣,李敏,高兆银. 2010. 热带亚热带水果采后病害及防治[M]. 北京:中国农业出版社.
Hu M J, Li M, Gao Z Y. 2010. Postharvest Diseases of Tropical and Subtropical Fruits and Their Control Measures[M]. Beijing: China Agricultural Press.
胡美姣,杨波,李敏,杨冬平,蒲金基,张正科,高兆银. 2013. 海南省芒果果腐病病原菌鉴定及其生物学特性研究[J]. 热带作物学报, 34(8):1564-1569.
Hu M J, Yang B, Li M, Yang D P, Pu J J, Zhang Z K, Gao Z Y. 2013. Idengtification and biological characteristicics of mango fruit rot pathogen[J]. Chinese Journal of tropical Crop,34(8):1564-1569.
李敏,胡美姣,高兆銀,薛丁蓉,杨冬平,杨波. 2012a. 一种火龙果腐烂病病原菌鉴定及生物学特性研究[J]. 热带作物学报,33(11):2044-2048.
Li M, Hu M J, Gao Z Y, Xue D R, Yang D P, Yang B. 2012a. Identification and biological characteristics of a pathogen causing fruit rot of Hylocereus undatus(Haw.) Britt. et. Rose[J]. Chinese Journal of Tropical Crop, 33(11):2044-2048.
李敏,胡美姣,高兆银,张正科,薛丁榕,杨冬平,杨波. 2012b. 海南火龙果采后病害调查及防治技术研究[J]. 中国热带农业,(6): 43-44.
Li M, Hu M J, Gao Z Y,Zhang Z K, Xue D R, Yang D P, Yang B. 2012b. Disease investigation and control technique of pitaya in Hainan[J]. China Tropical Agricultiure,(6): 43-44.
李茂,蒋昌顺. 2008. 主要热带作物对炭疽病抗病机制研究进展[J]. 热带农业科技,31(1): 45-47.
Li M, Jiang C S. 2008. Study on several tropical crops disease-resistance mechanism to anthracnose[J]. Tropical Agricultural Science & Technology, 31(1): 45-47.
楼兵干,陈吴健,林钗,王国荣,夏国绵,楼曼庆. 2009.一种新大豆豆荚炭疽病症状类型及其病原鉴定[J]. 植物保护学报,36(3): 229-233.
Lou B G, Chen W J, Lin C, Wang G R, Xia G M,Lou M Q. 2009. A new symptom type of soybean pod anthracnose and identificationof its pathogen[J]. Plant Protection,36(3): 229-233.
陆家云. 2001. 植物病原真菌学[M]. 北京: 中国农业出版社.
Lu J Y. 2001. Plant Mycology[M]. Beijing: China Agricultural Press.
戚佩坤. 2000. 广东果树真菌病害志[M]. 北京:中国农业出版社.
Qi P K. 2000. Fungal Diseases of Fruit Tree in Guangdong[M]. Beijing: China Agricultural Press.
沈萍,陈向东. 2007. 微生物学实验[M]. 北京: 高等教育出版社.
Shen P, Chen X D. 2007. Microbiology Experiment[M]. Beijing: Higher Education Press.
孙志峰,楼兵干,王国荣,夏国绵,楼曼庆. 2008. 大豆豆荚炭疽病菌生物学特性[J]. 浙江农业学报,20(6): 432-436.
Sun Z F, Lou B G, Wang G R, Xia G M, Lou M Q. 2008. Biological characterics of the pathogen of soybean pod anthracnose Colletorichum truncatum[J]. Acta Agriculturae Zhejiangensis, 20(6): 432-436.
肖杰文,劉月廉,冉俊祥,杨占臣. 2011. 巴西大豆中炭疽菌的分离鉴定研究[J]. 中国农学通报, 27(5): 333-337.
Xiao J W, Liu Y L, Ran J X,Yang Z C. 2011. Identification of Colletotrichum isolates from Brazil Soybean[J]. Chinese Agricultural Science Bulletin, 27(5): 333-337.
徐丽慧,曾蓉,陆金萍,戴富明. 2014. 豇豆茎基部病害的病原鉴定及主要生物学特性研究[J]. 上海农业学报,30(4): 1-5.
Xu L H, Zeng R, Lu J P, Dai F M. 2014. Identification and biological characteristics of cowpea stem base disease-producing germ[J]. Acta Agriculturae Shanghai, 30(4): 1-5.
杨友联,刘永翔,刘作易. 2014. 棉花炭疽病的病原鉴定[J]. 贵州农业科学,42(8): 86-91.
Yang Y L, Liu Y X, Liu Z Y. 2014. Identification of Colletotrichum species associated with cotton anthracnose[J]. Guizhou Agricultural Sciences, 42(8): 86-91.
袁诚林,张伟锋,袁红旭. 2004. 粤西地区火龙果病害调查初报及防治措施[J]. 中国南方果树,33(2): 49-50.
Yuan C L, Zhang W F, Yuan H X. 2004. Preliminary study on disease investigation and control measures of pitaya in Yuexi area[J]. South China Fruit,33(2): 49-50.
曾大兴,戚佩坤,姜子德. 2004. 弯孢类炭疽菌rDNA ITS区的RFLP分析及分类研究[J]. 植物病理学报,34(5): 431-436.
Zeng D X, Qi P K,Jiang Z D. 2004. RFLP analysis of ITS region of rDNA in the falcate-spored species of Colletotrichum[J]. Acta Phytopathologica Sinica, 34(5): 431-436.
鄭良永. 2004. 海南岛火龙果丰产栽培技术[J]. 热带农业科学,24(4): 36-41.
Zheng L Y. 2004. Techniques of productive cultivation of titaya in Hainan Island[J]. Chinese Journal of Tropical Agriculture, 24(4): 36-41.
郑伟,王彬,彭丽娟,李兴忠. 2014. 火龙果炭疽病病原鉴定与ITS序列分析[J]. 西南农业学报,27(5): 1970-1973.
Zheng W,Wang B,Peng L J, Li X Z. 2014. Identification and ITS sequence analysis of pitaya Colletotrichum gloeosporioide[J]. Southwest China Journal of Agricultural Sciences, 27(5): 1970-1973.
Diao Y Z, Zhang C, Lin D. 2014. First report of Colletotrichum truncatum causing anthracnose of tomato in China[J]. Plant Disease, 98(5): 687-688.
Guo L W, Wu Y X, Ho H H, Su Y Y, Mao Z C, He P F, He Y Q. 2014. First report of dragon fruit(Hylocereus undatus) anthracnose caused by Colletotrichum truncatum in China [J]. Journal of Phytopathology, 162(4): 272-275.
Phoulivong S, Cai L, Chen H, McKenzie E H C, Abdelsalam K. 2010. Colletotrichum gloeosporioides is not a common pathogen on tropical fruits[J]. Fungal Diversity, 44(1): 33-43.
White T J, Bruns T, Lee S. 1990. Amplification and Direct Sequencing of Fungal Ribosomal RNA Genes for Phylogenetics[M]//Innis M A, Gelfand D H, Sninsky J J. PCR Protocols: A Guide to Methods and Applications. New York: Academic Press:315-322.
Von Arx J A. 1970. A review of the fungi classified as genus Gloeosporium[J]. Bibliotheca Mycologica, 24(3): 1-203.
(責任编辑 麻小燕)

