还原型谷胱甘肽联合丹参注射液治疗酒精性肝病临床观察
王祖君,李小丹
(湖北省恩施土家族苗族自治州民族医院,湖北 恩施 445000)
还原型谷胱甘肽联合丹参注射液治疗酒精性肝病临床观察
王祖君,李小丹
(湖北省恩施土家族苗族自治州民族医院,湖北 恩施 445000)
[摘要]目的探讨还原型谷胱甘肽联合丹参注射液治疗酒精性肝病(ALD)患者的临床疗效。方法将82例确诊为ALD患者随机分为对照组和治疗组,对照组41例采用戒酒、营养支持、甘草酸二铵以及丹参注射液综合治疗,治疗组41例在对照组治疗的基础上加用还原型谷胱甘肽治疗。2组均治疗2个疗程。观察2组临床症状和体征、肝功能指标(ALT、AST、GGT、TBil)、肝纤维化指标(HA、LN、PC-Ⅲ、Ⅳ-C)、细胞因子指标(TGF-β1、IL-6、Leptin、TNF-α)变化,并记录治疗过程中出现的不良反应。结果2组临床症状和体征都得到不同程度的改善,对照组的总有效率为56%,治疗组为88%,组间比较差异有统计学意义(P<0.05)。治疗后2组肝功能指标、肝纤维化指标以及细胞因子指标均下降(P均<0.05),且治疗组下降更加明显(P均<0.05)。在治疗过程中2组患者未出现严重的不良反应。结论还原型谷胱甘肽联合丹参注射液治疗ALD临床疗效好,值得临床推广应用。
[关键词]酒精性肝病;还原型谷胱甘肽;丹参注射液
酒精性肝病(alcoholic liver disease, ALD)是由于长期大量饮酒所致的肝脏疾病。随着人们生活水平的提高,ALD的发病率呈上升趋势,仅次于病毒性肝病,是肝病及与肝病相关疾病之一[1]。ALD的临床分型为轻症ALD、酒精性脂肪肝(alcoholic fatty liver,AFL)、酒精性肝炎(alcoholic hepatitis,AH)、酒精性肝纤维化(alcoholic hepatic fibrosis,AHF)和酒精性肝硬化(alcoholic cirrhosis,AC),严重危害患者的健康。目前,ALD主要接受戒酒、营养支持和并发症防治的对症治疗,尚无其他特效治疗方案。笔者采用还原型谷胱甘肽联合丹参注射液治疗ALD患者取得较好疗效,现报道如下。
1临床资料
1.1一般资料选择2010年8月—2013年9月入住我院确诊为ALD的患者82例,参考中华医学会肝病学分会脂肪肝和酒精性肝病学组制定的《酒精性肝病诊疗指南》[2]根据患者的临床症状和体征、饮酒史、实验室检查、肝脏B超或CT影像学以及组织病理学全面诊断为ALD。排除标准:年龄低于18岁或高于75岁;嗜肝病毒现症感染以及药物、中毒性肝损伤和自身免疫性肝病等;HAV、HBV、HCV、HEV、CMV以及EB病毒感染;对药物过敏以及精神病、妊娠或哺乳患者。男45例,女37例;年龄23~73(44.3±10.1)岁。临床分型:轻症ALD 11例(13%),AFL 29例(35%),AH 21例(26%),AHF 16例(20%),AC 5例(6%)。患者临床症状和体征无特异性,常见为恶心呕吐、腹泻、乏力、纳差、腹胀等,部分伴有发热,少数无明显症状;其中恶心呕吐43例,腹泻37例,乏力75例,纳差70例,腹胀51例,黄疸35例,肝大49例,脾大6例,肝性脑病4例,凝血酶原时间延长2例,腹水2例,发热1例,食管静脉曲张1例,下肢水肿4例。将患者随机分为2组:对照组41例,男23例,女18例;年龄23~71(42.9±9.6)岁。治疗组41例,男22例,女19例;年龄24~73(45.7±10.4)岁。2组性别、年龄、病程、肝功能、实验室检查指标等一般资料比较差异均无统计学意义(P均>0.05),具有可比性。
1.2治疗方法2组均先进行健康教育,注意休息与合理饮食;要戒酒并给予足量的营养支持,食用易消化、富含优质蛋白质、高热量、低脂肪的饮食,多补充维生素B、维生素C、维生素K和叶酸等,以改善已存在的继发性营养不良;并对于肝纤维化、门静脉高压、食管胃底静脉曲张以及肝性脑病等酒精肝硬化的并发症给予相应的积极治疗。对照组给予甘草酸二铵注射液(江苏正大天晴药业股份有限公司,国药准字H10940190)150 mg加入5%葡萄糖溶液250 mL中静脉滴注,1次/d;丹参注射液(浙江康恩贝制药股份有限公司,国药准字Z33020529)30 mL加入5%葡萄糖溶液250 mL静脉滴注,1次/d。治疗组在对照组治疗的基础上加用还原型谷胱甘肽(重庆药友制药有限责任公司,国药准字h10067129)1.8 g加入5%葡萄糖溶液250 mL静脉滴注,1次/d。2组均以15 d为1个疗程,共治疗2个疗程。
1.3观察指标①治疗前后患者的临床症状、体征改善情况。②治疗前后的肝功能指标:丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、总胆红素(TBil)、γ-谷氨酰转肽酶(GGT);肝纤维化指标:透明质酸(HA)、层黏连蛋白(LN)、Ⅲ型前胶原肽(PC-Ⅲ)、Ⅳ型胶原(Ⅳ-C);细胞因子:血清转化生长因子β1(TGF-β1)、白细胞介素-6(IL-6)、瘦素(Leptin)、肿瘤坏死因子-α(TNF-α)。③治疗前后的肝脏B超和CT检查。④治疗前后血、尿常规,电解质,肾功能,心电图,并记录治疗过程中的不良反应。肝功能采用贝克曼全自动生化分析仪检测,肝纤维指标和细胞因子采用放射免疫法测定。
1.4疗效判定标准显效:临床症状消失或明显改善,肝功能恢复正常;有效:临床症状大部分消失,ALT、AST、GGT、TBil等肝功能指标下降50%以上且低于正常上限值2倍以下;无效:临床症状和体征、肝功能指标无变化或病情恶化。
1.5统计学方法采用SPSS 13.0统计软件包进行统计分析。计数资料以率表示,比较采用2检验;计量资料以±s表示,比较采用t检验。P<0.05为差异有统计学意义。
2结果
2.12组临床疗效比较经过1个月的临床治疗后,2组临床症状和体征都得到不同程度的改善,其中对照组显效8例,有效15例,无效18例,总有效率为56%;治疗组显效25例,有效11例,无效5例,总有效率为88%。2组临床疗效比较差异有统计学意义(P<0.05)。
2.22组肝功能指标变化比较治疗后,2组血清ALT、AST、GGT以及TBil水平均明显下降(P均<0.05),而且治疗组下降更加明显(P均<0.05)。见表1。
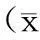
表1 2组治疗前后肝功能指标比较±s)
注:①与治疗前比较,P<0.05;②与对照组比较,P<0.05。
2.32组肝纤维化指标变化比较治疗后,2组HA、LN、PC-Ⅲ以及Ⅳ-C水平均明显下降(P均<0.05),且治疗组下降更加明显(P均<0.05)。见表2。
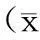
表2 2组治疗前后肝纤维化指标比较±s, μg/L)
注:①与治疗前比较,P<0.05;②与对照组比较,P<0.05。
2.42组细胞因子水平比较治疗后,2组TGF-β1、IL-6、Leptin以及TNF-α水平均明显下降(P均<0.05),且治疗组下降更加明显(P均<0.05)。见表3。
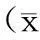
表3 2组治疗前后细胞因子水平比较±s)
注:①与治疗前比较,P<0.05;②与对照组比较,P<0.05。
2.5不良反应2组患者在治疗过程中,血尿常规、肾功能以及心电图检查均无异常,未出现严重的不良反应。
3讨论
ALD是由于长期大量饮酒所致的慢性肝脏疾病。经口摄入吸收的乙醇约90%在肝内经过乙醇脱氢酶(ADH)以及细胞色素P450微粒体乙醇氧化酶(MEOS)两大系统代谢,在肝细胞内均产生乙醛,经乙醛脱氢酶作用转化为乙酸,最终产物为二氧化碳和水。ALD的发病机制[3-4]:①乙醇在肝细胞内的代谢过程中会使还原型辅酶Ⅰ增多,抑制脂肪酸氧化,导致肝细胞内三酰甘油形成增多,引起脂肪肝。②由于代谢产物会损伤肝细胞,导致脂质过氧化,促进活性自由基的形成,并抑制谷胱甘肽的生物合成;同时,由于乙醛和自由基还会使线粒体受到损害,会加重谷胱甘肽耗竭。③由于肝细胞直接损伤同时通过激活Kupffer细胞,会引起细胞因子介导的炎症,并同时使肝星状细胞活化,大量增生,合成过多的细胞外基质引起肝纤维化。④由于长期大量饮酒引起消化吸收障碍导致继发性营养不良,也会导致肝脂肪变性和肝纤维化。肝病流行病学调查显示,ALD的检出率为4.34%,其中轻症ALD为1.21%,AFL为0.94%,AH为1.51%,AC为0.68%[5]。
AFL形成是多种因素协同作用的结果,是由于激活肝星状细胞导致过多的细胞外基质的异常沉积。TGFβ1可以促进细胞外基质的合成和沉积,同时抑制其生物降解,导致纤维化[6];IL-6作为肝细胞刺激因子,可直接刺激肝细胞和储脂细胞增生分泌胶原、合成胶原、层黏蛋白和蛋白多糖,并分泌多种细胞因子,导致纤维化[7];激活的Kupffer细胞会产生TNF-α,TNF-α能够诱导成纤维细胞、平滑肌细胞以及血管内皮细胞产生多种细胞因子,与炎症反应、脂质代谢关系密切[8],是引起ALD的重要细胞因子,参与其发生与发展[9];Leptin可以通过p38与JNK途径大量分泌TNF-α[10],而TNF-α也可以通过调节其受体促使Leptin分泌[11],两者协同作用加重酒精性肝损伤。
ALD的病因主要与饮酒量、饮酒方式、性别、遗传因素、营养不良、肝炎病毒感染等有关。关于饮酒致病量目前尚有争议,一般为饮酒史超过5年,男性饮用乙醇量≥40 g/d、女性饮用乙醇量≥20 g/d或2周内有大量饮酒史,乙醇量>80 g/d,同时需要考虑性别、遗传因素的影响[12]。由于女性对乙醇的敏感性大于男性,而且女性胃肠道乙醇脱氢酶活性低于男性,乙醇的代谢速率慢,血液中乙醇浓度偏高,即使饮酒量较小也能诱导产生ALD;另外,女性体内的雌激素可加剧急性肝损伤,增强Kupffer细胞对内毒素的敏感性及提高肝脏脂多糖蛋白复合物的合成,引发炎症反应和细胞损伤[13]。由于遗传因素的影响,个体对乙醇的敏感程度存在个体差异,可能与ALDh1、ADH、CYP450 2E1以及TNF-α等细胞因子的多态性有关[14]。长期大量饮酒可导致蛋白质、多不饱和脂肪酸、维生素等的缺乏[15],营养不良与肝病严重程度呈正相关,与乙醇对肝损伤可能起协同作用。由于病毒性肝炎患者对乙醇更加敏感,同时饮酒会促进肝炎病毒在体内复制,二者相互促进,加速对肝脏的损害。研究表明,HBV、HCV感染与乙醇所致的肝毒性呈协同作用,HCV的作用可能更突出[16]。病毒性肝炎的患者饮酒容易发展为ALD。
目前,对ALD的治疗综合方案为戒酒、营养支持、药物治疗并积极处理肝硬化及防治并发症。由于ALD患者肝损伤以及体内肝细胞线粒体中谷胱甘肽浓度减少,可以通过补充外源性还原型谷胱甘肽减轻ALD由氧化应激导致肝细胞内ATP和谷胱甘肽耗竭而所引起的肝细胞损害。还原型谷胱甘肽是由谷氨酸、半胱氨酸和甘氨酸组成的三肽,主要通过化学分子中的巯基(-SH)和γ-谷氨酰胺键发挥生理功能并参与体内代谢。自由基对肝脏的损害是重要的病理基础,由于其具有活泼的化学活性,能与体内多种化学物质发生反应,可导致肝细胞蛋白质变性、酶失活、核酸突变、细胞膜磷脂双键破坏,并能产生其他自由基,引起连锁反应。还原型谷胱甘肽在过氧化物酶的作用下,通过-SH与体内的超氧基团、氧自由基以及其他自由基结合而使这些化学物质灭活,并转化成容易代谢的酸性物质,加速自由基的排泄,从而抑制过氧化物的产生和TG堆积,防止乙醛所致的肝细胞变性、坏死以及肝纤维化等损害作用的发生[17-19]。还原型谷胱甘肽具有清除自由基、抗氧化、抗炎、保护细胞膜,能明显改善肝功能,起到降酶、保肝作用,减轻肝组织损伤,促进肝组织修复功能。丹参含有丹参酚、丹参素、丹参酮等多种活性成分,抗氧化活性强,可抑制ALT、AST以及IL-8升高,可降低肝细胞内脂质过氧化自由基幅值,还能够抑制单核、巨噬细胞产生炎性递质,从而抑制肝脏的炎症反应,减轻肝细胞变性坏死,促进肝细胞再生,还可以改善和加强肝脏的微循环,减轻瘀血性缺血状态以及肝脏缺血再灌注损伤中肝细胞受损伤程度,增强脂质的代谢和排泄,具有良好的保护肝细胞、促进肝细胞再生的作用[3,20-21]。
本研究结果显示,治疗后治疗组的总有效率,明显高于对照组,治疗组的ALT、AST、GGT、TBil等肝功能指标得到明显改善,且肝功能改善效果明显优于对照组,说明还原型谷胱甘肽在降酶、改善肝功能等方面疗效显著;另外,治疗组患者中的血清HA、LN、PC-Ⅲ、Ⅳ-C肝纤维化指标和TGF-β1、IL-6、Leptin、TNF-α细胞因子指标较治疗前明显下降,而且下降程度明显优于对照组。以上结果表明,还原型谷胱甘肽联合丹参注射液不仅能够缓解临床症状,还能够改善肝功能,抗肝纤维化,并能降低细胞因子,具有良好的治疗作用。
总之,对于ALD患者,首先要评估饮酒量、肝损伤表现以及是否合并其他肝病和病情严重程度判断,尽早确诊并及时治疗。还原型谷胱甘肽联合丹参注射液治疗ALD,治疗后患者的症状、体征、肝功能、肝纤维化指标和细胞因子指标较治疗前有明显改善,而且临床疗效明显优于对照组,说明还原型谷胱甘肽和丹参注射液能够发挥协同作用,有助于改善症状,加快ALD的恢复。
[参考文献]
[1]Diehl AM. Liver disease in alcohol abusers:clinical perspective[J]. Alcohol,2002,27(1):7-11
[2]中华医学会肝病学分会脂肪肝和酒精性肝病学组. 酒精性肝病诊疗指南[J]. 临床肝胆病杂志,2010,26(3):229-232
[3]赵雪珂,穆茂,程明亮. 酒精性肝病与氧化应激[J]. 临床肝胆病杂志,2014,30(2):118-120
[4]肖楠,庄辉. 酒精性肝病分子发病机制的研究进展[J]. 肝脏,2010,15(4):299-302
[5]徐俊斌. 酒精性肝病40例临床分析[J]. 中国医药导报,2010,7(30):153;156
[6]韩俊岭,韩莹,张春艳,等. 复方甘草酸苷联合川芎嗪治疗酒精性肝病的疗效观察[J]. 南京医科大学学报:自然科学版,2009,29(11):1607-1610
[7]王欣,张明威,孙淑艳. 酒精性肝病患者血清NO、TNF-α 和IL-6的检测及意义[J]. 临床肝胆病杂志,2000,16(3):163-164
[8]Lieber CS. New concepts of the pathogenesis of alcoholic liver disease lead to novel treatments[J]. Curr Gastroenterol Rep,2004,6(1):60-65
[9]Tilg H,Diehl AM. Cytokines in alcoholic and nonalcoholic steatohepatitis[J]. N Engl J Med,2000,343(20):1467-1476
[10] Shen J,Sakaida I,Uchida K,et al. Leptin enhances TNF-alpha production via p38 and JNK MAPK in LPS-stimulated Kupffer cells[J]. Life Sci,2005,77(13):1502-1515
[11] Finck BN,Johnson RW. Tumor necrosis factor (TNF)-alpha induces leptin production through the p55 TNF receptor[J]. Am J Physiol Regul Integr Comp Physiol,2000,278(2):537-543
[12] Arteel GE. New role of plasminogen activator inhibitor-1 in alcohol-induced liver injury[J]. J Gastroen Hepatol,2008,23(Suppl1):S54-S59
[13] Yokoyama Y,Nimura Y,Nagino M,et al. Current understanding of gender dimorphism in hepatic pathophysiology[J]. J Surg Res,2005,128(1):147-156
[14] 邬升,郑世华. 酒精性肝病的研究进展[J]. 海南医学,2013,24(9):1326-1328
[15] Plauth M,Cabre E,Campillo B,et al. ESPEN Guidelines on Parenteral Nutrition:hepatology[J]. Clin Nutr,2009,28(4):436-444
[16] Lieber CS. Hepatitis C and alcohol[J]. J Clin Gastroenterol,2003,36(2):100-102
[17] Lu SC,Huang ZZ,Yang JM,et al. Effect of ethanol and high-fat feeding on hepatic gamma-glutamylcysteine synthetase subunit expression in the rat[J]. Hepatology,1999,30(1):209-214
[18] Morgenstern R,Svensson R,Bernat BA,et al. Kinetic analysis of the slow ionization of glutathione by microsomal glutathione transferase MGST1[J]. Biochemistry,2001,40(11):3378-3384
[19] Sun QA,Kirnarsky L,Sherman S,et al. Selenoprotein oxidoreductase with specificity for thioredoxin and glutathione systems[J]. Proc Natl Acad Sci USA,2001,98(7):3673-3678
[20] 石琼英. 复方丹参联合还原型谷胱甘肽治疗酒精性肝病[J]. 河北医药,2007,29(1):61
[21] 张立新,高世文. 丹参粉针联合硫普乐宁治疗酒精性肝病疗效观察[J]. 现代中西医结合杂志,2008,17(25):3950-3951
[收稿日期]2015-08-05
[中图分类号]R575
[文献标识码]B
[文章编号]1008-8849(2016)12-1304-03
doi:10.3969/j.issn.1008-8849.2016.12.018
[通信作者]李小丹,E-mail:1515206627@qq.com

