外周循环血微小RNA表达水平与冠心病发病风险的关联分析
宁明安 刘立鹏 陈书影 程康 瞿发林 郭文怡
710032 西安,第四军医大学西京医院心内科
·临床研究·
外周循环血微小RNA表达水平与冠心病发病风险的关联分析
宁明安刘立鹏陈书影程康瞿发林郭文怡
710032 西安,第四军医大学西京医院心内科
【摘要】目的探讨微小RNA-133a(miRNA-133a)、miRNA-208a和miRNA-499a在冠心病患者外周循环血中的表达水平及其临床意义。方法选择冠心病患者290例,冠状动脉阴性对照组110例,收集两组样本临床资料;运用实时定量聚合酶链反应检测样本血浆中miRNA-133a、miRNA-208a和miRNA-499a表达水平,并分析其表达差异。结果(1)与冠状动脉阴性对照组比较,冠心病组miRNA-133a[0.62(0.32-0.92)比0.39(0.21-0.72),Z=8.80]、miRNA-208a[5.85(2.31-9.78)比5.06(2.17-9.13),Z=2.32]和miRNA-499a[5.07(2.08-9.54)比3.12(1.96-5.03),Z=10.08] 表达水平均显著升高,差异均有统计学意义(均为P<0.01);(2)根据Gensini评分将所有研究对象分为4组,各组之间miRNA-133a[0.36(0.21-0.66)比0.48(0.36-0.85)比0.60(0.42-0.87)比0.70(0.56-0.92),H=64.84]、miRNA-208a[4.99(2.17-6.73)比5.16(3.56-8.04)比5.85(4.31-8.63)比6.18(4.84-9.78),H=21.54]和miRNA-499a[2.94(1.96-4.93)比3.55(2.02-6.63)比4.51(2.38-7.54)比6.24(4.08-9.54),H=89.70]表达水平差异均有统计学意义(均为P<0.01),且表达水平变化与Gensini评分即冠状动脉粥样硬化狭窄程度呈正相关(miRNA-133a:r=0.343,P<0.01;miRNA-208a:r=0.395,P<0.01;miRNA-499a:r=0.410,P<0.01)。结论冠心病患者外周循环血中miRNA-133a、miRNA-208a和miRNA-499a表达水平较冠状动脉阴性对照者有显著差异,且表达水平变化与Gensini评分即冠状动脉粥样硬化狭窄程度呈正相关。
【关键词】微小RNA;冠状动脉疾病;逆转录;实时定量聚合酶链反应;Gensini评分
微小RNAs(microRNAs,miRNAs)是一类高度保守的内源性小分子单链非编码RNA,几乎存在于所有真核微生物中[1]。其可通过与特定靶基因mRNA的3′端非翻译区互补性结合促使其降解或抑制其翻译,从而在转录后水平对基因表达进行调控[2]。研究发现外周循环血中存在miRNAs,作为调节因子在心脏发育、血管发育和血管再生中起着重要作用[3]。目前在人类基因组中已发现约800种miRNAs,估计总共有超过1 000种miRNAs在人类基因组中表达[4]。而且miRNAs不易受温度、pH值及放置时间长短的影响,因此具有非常好的稳定性[5]。miRNAs将可能作为一种新型的生物标记物在冠心病患者的诊断和预后中发挥重要作用[6],并且有望成为冠心病的一个新型治疗靶点[7]。
冠心病是心血管疾病中的常见病,具有高发病率和高致死率的特点,已成为人群最主要的死亡病因[8]。因此,冠心病应早期预防、早期发现和早期诊断,从而阻止该病进行性发展,改善患者的远期预后,提高患者的治愈率和生存率。本研究旨在观察冠心病患者血浆中miRNAs表达水平变化,探讨其与冠状动脉狭窄程度的相关性,对早期诊断和预防冠心病具有重要意义,为进一步探讨冠心病的基因诊断和治疗提供重要的理论依据。
1对象和方法
1.1研究对象
选取2014年12月至2015年5月于第四军医大学西京医院心内科住院并行冠状动脉造影明确诊断为冠心病的患者290例作为病例组,年龄>18岁,无血缘关系,冠状动脉三支主要血管中,至少有一支狭窄程度≥50%[9]。同时选取基线资料配对的110例疑诊冠心病患者,行冠状动脉造影后,冠状动脉三支主要血管的狭窄程度均<50%,能够明确排除冠心病,作为对照组。记录所有研究对象的完整病史信息。排除标准:(1)恶性肿瘤病史;(2)终末期肾脏疾病,肝功能衰竭;(3)1个月内输血史;(4)骨髓移植术史;(5)急性感染。本研究经第四军医大学西京医院伦理委员会批准同意。所有研究方案均取得患者或家属知情同意。
1.2研究方法
1.2.1病史资料收集所有研究对象的年龄、性别、身高、体重、吸烟史、饮酒史、既往高血压和糖尿病病史等资料。
1.2.2生化检查收集所有研究对象的采血检测的生化检查资料,包括谷丙转氨酶、谷草转氨酶、肌酐、尿素氮、尿酸、三酰甘油(triglyceride,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high-density lipoproteincholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoproteincholesterol,LDL-C)、空腹血糖(fasting blood glucose,FBG)、肌酸激酶(creatine kinase,CK)、肌酸激酶同工酶(creatine kinase-MB,CK-MB)、肌钙蛋白I(cardiac troponin I,cTnI)。
1.2.3冠状动脉造影及Gensini评分[10]所有研究对象的冠状动脉造影均采用桡动脉或股动脉途径进行,术中尽量使冠状动脉各段能充分显示。冠状动脉病变狭窄程度采用Gensini评分,根据评分结果将所有研究对象分为4组:A组99例,Gensini评分≤22分,B组98例,Gensini评分23~55分,C组102例,Gensini评分56~96分,D组101例,Gensini评分≥97分。
1.2.4血液样本的采集和储存所有研究对象在胸痛发作24 h内行冠状动脉造影术前抽取桡动脉血5 ml于含EDTA抗凝剂采血管中,静置1 h,室温1 200 rpm离心15 min,提取上清液分装到去RNA酶的EP管中,再以8 000 rpm充分离心5 min,取上层血浆每500 μl分装至RNAse-free EP管中,最终每例患者收集2~3管,然后放置到-80℃低温冰箱中保存待用。

表1 两组样本基本临床资料比较
1.2.5miRNAs检测将离心得到的血浆取500 μl到新的离心管中,用RNAiso Plus(TaKaRa,Code No.9109),按照试剂操作说明提取各样本总RNA,放置于-80℃低温冰箱中保存集中进行逆转录。各样本均取20 ng总RNA应用PrimeScriptTMRT Master Mix(TaKaRa,Code No.RR036A),按照试剂操作说明配制成10 μl体系的RT反应液进行逆转录,得到cDNA。以RNU6B为内参。各样本逆转录产物均取2 μl应用SYBR Premix Ex TaqTMⅡ(TaKaRa,Code No.RR820A),按照操作说明配制成25 μl体系的PCR反应液,使用ABI 7500仪应用TaqMan探针实时定量聚合酶链反应(qRT-PCR)和PCR双重特异性引物扩增技术检测miRNA-133a、miRNA-208a和miRNA-499a的Ct值。以RNU6B为内参。
1.3统计学方法
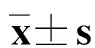
2结果
2.1两组样本临床资料及生化指标比较
表1、2显示,病例组和对照组的年龄、性别、体重、体质指数(body mass index,BMI)、高血压病史、糖尿病病史、FBG、水平差异均无统计学意义(均为P>0.05)。与对照组比较,病例组的吸烟比以及TG、TC、LDL-C、肌酐和尿酸均显著高于对照组,HDL-C水平低于对照组(均为P<0.01)。
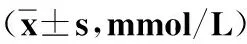
表2 两组样本基本生化指标比较
2.2根据Gensini评分分组的样本间临床资料及生化指标比较
表3、4显示,将所有研究对象根据Gensini评分按照四分位数间距分为4组,分析结果表明各组间年龄、性别、体重、BMI、高血压病史、糖尿病病史、吸烟史、FBG、HDL-C、肌酐和尿酸水平的差异均无统计学意义(均为P>0.05);各组间TG、TC和LDL-C的差异均有统计学意义(均为P<0.05)。
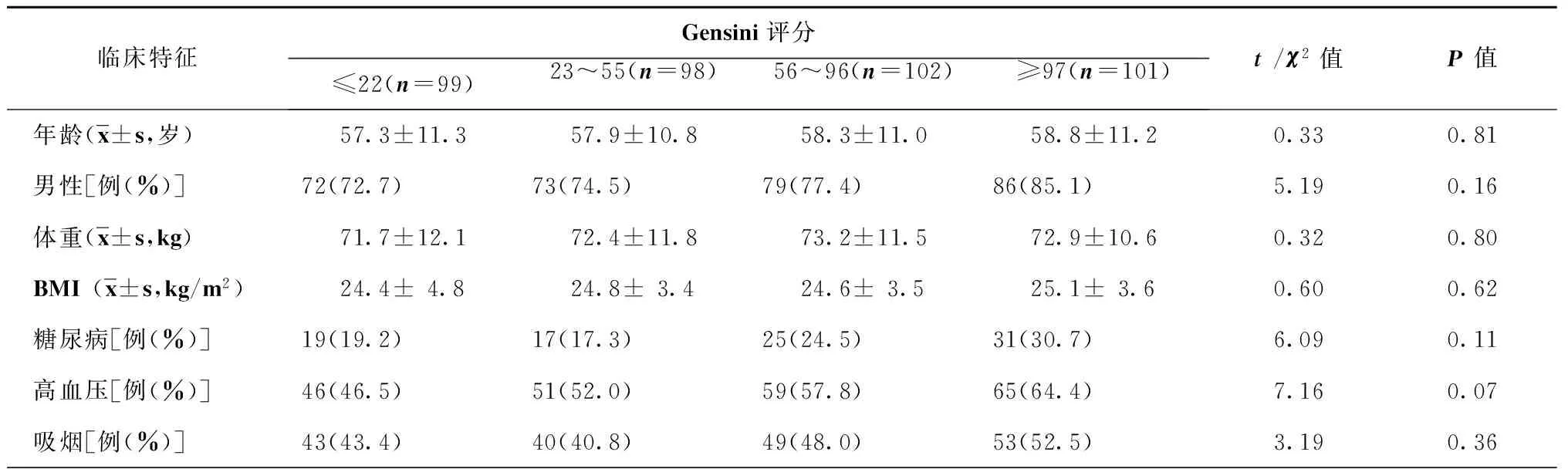
表3 根据Gensini评分分组的基本临床资料比较
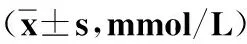
表4 根据Gensini评分分组的基本生化指标比较
2.3实时荧光定量PCR相对定量检测miRNA结果
表5显示,与对照组比较,病例组miRNA-133a、miRNA-208a和miRNA-499a的表达水平显著升高,差异有统计学意义(均为P<0.01)。结果以中位数和四分位数间距表示。

表5 两组样本miRNA检测结果比较[M(P25-P75)]
表6显示,将所有研究对象根据Gensini评分按照四分位数间距分组,分析结果表明各组间miRNA-133a、miRNA-208a和miRNA-499a表达水平差异均有统计学意义(均为P<0.01)。
2.4相关性分析
图1、2、3显示,Pearson直线相关分析表明,血浆中miRNA-133a、miRNA-208a和miRNA-499a表达水平与Gensini评分呈正相关,即表达水平变化与冠状动脉狭窄程度呈正相关,相关系数(r)分别为0.343、0.395和0.410(均为P<0.01)。
3讨论
目前发现与冠心病相关的miRNAs很多,其中研究较多的有miRNA-1、miRNA-126、miRNA-133、miRNA-208和miRNA-499等,这些血管内皮特异性表达的miRNAs在冠心病患者表达水平异常,提示它们可能是冠心病的潜在生物标志物,但尚未得出一致结论[11-15]。并且,此类miRNAs在外周循环血中的表达水平与冠心病患者冠状动脉病变狭窄程度是否具有相关性尚不清楚。
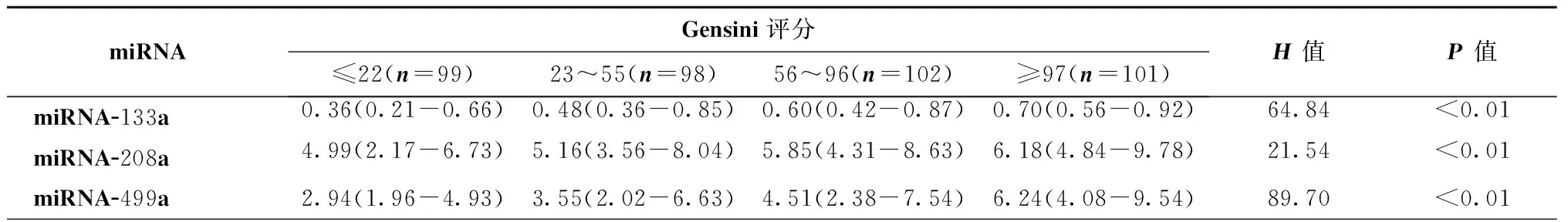
表6 根据Gensini评分分组的miRNA检测结果比较[M(P25-P75)]
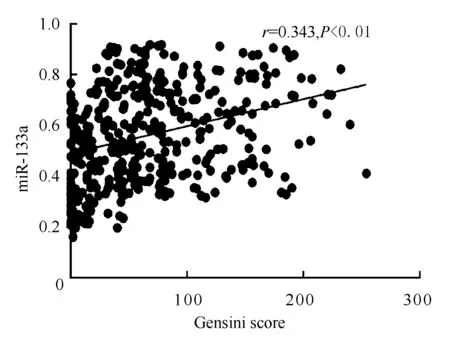
图1 miRNA-133a与Gensini评分的关联性分析
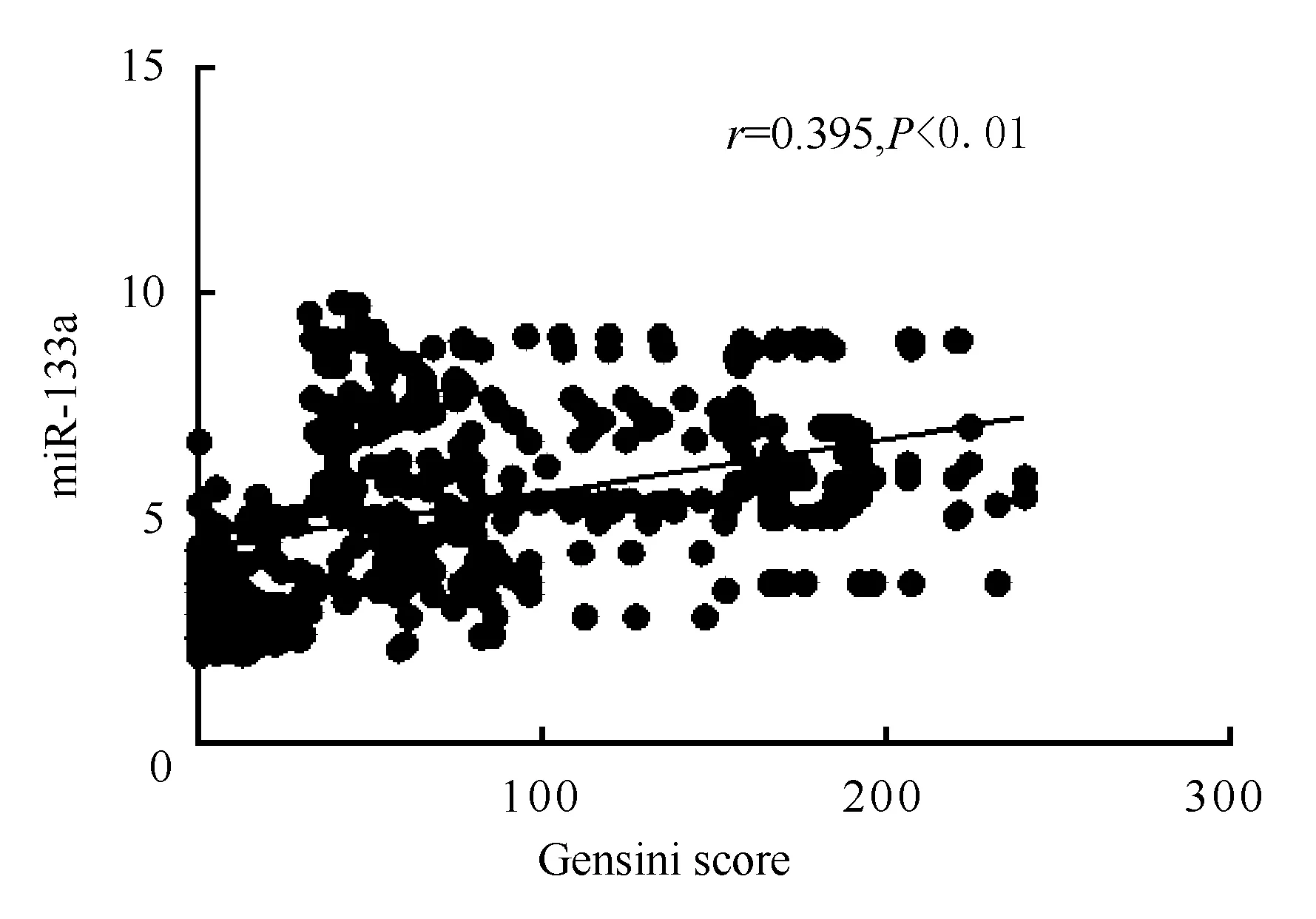
图2 miRNA-208a与Gensini评分的关联性分析
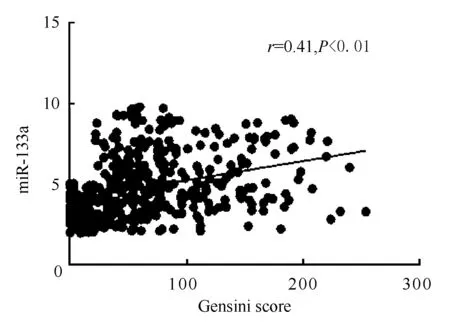
图3 miRNA-499a与Gensini评分的关联性分析
D′ Alessandra等[16]研究发现,大鼠冠状动脉闭塞6 h后心肌梗死区miRNA-1和miRNA-133的表达水平均下降;而在血清或血浆中检测到的miRNA-1、miRNA-133和miRNA-499的表达水平则升高,表明miRNA-1和miRNA-133在心肌损伤后才释放入血,并在心肌梗死患者出现症状后156 min即能检测到miRNA-1和miRNA-133的高峰值,且此数值比cTnI峰值出现更早、数值更高。Eitel等[17]研究126例ST段抬高型心肌梗死患者,也发现血清或血浆中miRNA-133a表达水平的升高与心肌损伤修复、损伤面积扩大和再灌注损伤密切相关。上述研究表明,血清或血浆miRNA-133可能是一种有意义的早期诊断急性心肌梗死的生物标记物,对于早期接受再灌注治疗挽救心肌有重要意义。
miRNA-499在肌肉中特异表达,在肌球蛋白基因调控中起重要作用。Li等[18]研究发现,与健康组相比,有6种miRNAs(miRNA-l、miRNA-134、miRNA-186、miRNA-208、miRNA-223和miRNA-499) 在急性心肌梗死患者血清或血浆中表达均明显升高,且miRNA-208和miRNA-499在心绞痛患者中表达更高。这些提示miRNA-499也有作为生物标记物诊断冠心病的潜力。
miRNA-208由α肌球蛋白重链(α-MHC)的内含子编码,特异性地表达于心肌组织[19],其功能主要在心肌细胞发育过程中调控肌球蛋白重链的生成。Xu等[20]通过静脉注射异丙肾上腺素建立大鼠心肌缺血的动物模型,再用miRNA微阵列分析得出miRNA-208是心脏特异性miRNA这一结果。Wang等[21]研究发现,无论是在大鼠还是人体内,正常状态下检测不到miRNA-208a,且只有受损的心脏组织中才能检测到miRNA-208a;此外,通过建立心肌缺血动物模型,发现心肌损伤1 h内大鼠血浆miRNA-208a即会明显升高,如果未损伤心肌而只损伤骨骼肌,则miRNA-208a不升高。进一步研究发现,miRNA-208a在心肌梗死患者血清或血浆中明显高于正常人以及其他患心血管疾病的患者,并且通过受试者工作特征曲线分析证实miRNA-208a具有很高的敏感性和特异性。上述结果表明,miRNA-208a具有高度的心肌特异性,提示miRNA-208a可能是一种有意义的早期诊断急性心肌梗死的生物标志物。
本研究仍然存在一些不足。首先,本研究所选的3个miRNAs仅仅来源于国内外相关参考文献,研究为非探索性研究;其次,同所有病例-对照研究一样,本研究存在一些不可避免的选择偏倚;再次,此研究只包括了新诊断的急性冠状动脉综合征患者并且只在手术治疗前采集了血液样本,并且未对患者进行随访。急性冠状动脉综合征患者从发病到确诊的时间难以精确掌握,对于该部分患者的采血时间可能存在偏差;最后,本研究只入选了陕西汉族的冠心病人群。
4小结
本临床研究以冠心病患者为研究对象,检测其血浆中miRNA-133a、miRNA-208a和miRNA-499a表达水平。研究发现冠心病组血浆miRNA-133a、miRNA-208a和miRNA-499a表达水平较对照组显著升高,差异有统计学意义。将所有研究对象根据Gensini评分按照四分位数间距分为4组,各组之间血浆miRNA-133a、miRNA-208a和miRNA-499a表达水平差异有统计学意义,且表达水平变化与Gensini评分即冠状动脉狭窄程度呈正相关。但是,冠心病是一种多种基因参与的多因素疾病,由于1种miRNA可能靶向多个基因,1种基因可能受多个miRNA的共同调控,因此miRNA在临床诊疗冠心病方面的应用仍需不断研究、探索、尝试,才能最终实现其临床价值。
利益冲突:无
参考文献
[1] Cullen BR.Transcription and processing of human microRNA precursors[J].Mol Cell,2004,16(6):861-865.DOI:10.1016/j.molcel.2004.12.002.
[2] Bartel DP.MicroRNAs:target recognition and regulatory functions[J].CELL,2009,136(2):215-233.DOI:10.1016/j.cell.2009.01.002.
[3] Zampetaki A,Willeit P,Tilling L,et al.Prospective study on circulating MicroRNAs and risk of myocardial infarction[J].J Am Coll Cardiol,2012,60(4):290-299.DOI:10.1016/j.jacc.2012.03.056.
[4] Bentwich I,Avniel A,Karov Y,et al.Identification of hundreds of conserved and nonconserved human microRNAs[J].Nat Genet,2005,37(7):766-770.DOI:10.1038/ng1590.
[5] Mitchell PS,Parkin RK,Kroh EM,et al.Circulating microRNAs as stable blood-based markers for cancer detection[J].Proc Natl Acad Sci U S A,2008,105(30):10513-10518.DOI:10.1073/pnas.0804549105.
[6] Sayed AS,Xia K,Yang TL,et al.Circulating microRNAs:a potential role in diagnosis and prognosis of acute myocardial infarction[J].Dis Markers,2013,35(5):561-566.DOI:10.1155/2013/217948.
[7] Frost RJ,van Rooij E.MiRNAs as therapeutic targets in ischemic heart disease[J].J Cardiovasc Transl Res,2010,3(3):280-289.DOI:10.1007/s12265-010-9173-y.
[8] Wang Q.Molecular genetics of coronary artery disease[J].Curr Opin Cardiol,2005,20(3):182-188.
[9] WHO publishes definitive atlas on global heart disease and stroke epidemic[J].Indian J Med Sci,2004,58(9):405-406.
[10] Gensini GG.A more meaningful scoring system for determining the severity of coronary heart disease[J].Am J Cardiol,1983,51(3):606.
[11] Sayed AS,Xia K,Salma U,et al.Diagnosis,prognosis and therapeutic role of circulating miRNAs in cardiovascular diseases[J].Heart Lung Circ,2014,23(6):503-510.DOI:10.1016/j.hlc.2014.01.001.
[12] Faruq O,Vecchione A.MicroRNA:diagnostic perspective[J].Front Med (Lausanne),2015,2:51.DOI:10.3389/fmed.2015.00051.
[13] Izarra A,Moscoso I,Levent E,et al.MiR-133a enhances the protective capacity of cardiac progenitors cells after myocardial infarction[J].Stem Cell Reports,2014,3(6):1029-1042.DOI:10.1016/j.stemcr.2014.10.010.
[14] Samanta S,Balasubramanian S,Rajasingh S,et al.MicroRNA:a new therapeutic strategy for cardiovascular diseases[J].Trends Cardiovasc Med,2016.DOI:10.1016/j.tcm.2016.02.004.
[15] 唐义信,孙权,朱灵萍,等.冠心病患者血浆中microRNA-145表达与冠状动脉侧支循环形成的相关性研究[J].中国心血管杂志,2015,20(4):262-266.DOI:10.3969/j.issn.1007-5410.2015.04.006.
Tang YX,Sun Q,Zhu LP,et al.Relationship between the plasma expression of microRNA-145 and formation of coronary collateral circulation in patients with coronary artery disease[J].Chin J Cardiovasc Med,2015,20(4):262-266.DOI:10.3969/j.issn.1007-5410.2015.04.006.
[16] D′Alessandra Y,Devanna P,Limana F,et al.Circulating microRNAs are new and sensitive biomarkers of myocardial infarction[J].Eur Heart J,2010,31(22):2765-2773.DOI:10.1093/eurheartj/ehq167.
[17] Eitel I,Adams V,Dieterich P,et al.Relation of circulating MicroRNA-133a concentrations with myocardial damage and clinical prognosis in ST-elevation myocardial infarction[J].Am Heart J,2012,164(5):706-714.DOI:10.1016/j.ahj.2012.08.004.
[18] Li C,Fang Z,Jiang T,et al.Serum microRNAs profile from genome-wide serves as a fingerprint for diagnosis of acute myocardial infarction and angina pectoris[J].BMC Med Genomics,2013,6:16.DOI:10.1186/1755-8794-6-16.
[19] Van Rooij E,Sutherland LB,Qi X,et al.Control of stressdepen-dent cardiac growth and gene expression by a microRNA[J].Science,2007,316(5824):575-579.DOI:10.1126/science.1139089.
[20] Ji X,Takahashi R,Hiura Y,et al.Plasma miR-208 as a biomarker of myocardial injury[J].Clin Chem,2009,55(11):1944-1949.DOI:10.1373/clinchem.2009.125310.
[21] Wang GK,Zhu JQ,Zhang JT,et al.Circulating microRNA:a novel potential biomarker for early diagnosis of acute myocardial infarction in humans[J].Eur Heart J,2010,31(6):659-666.DOI:10.1093/eurheartj/ehq013.
(本文编辑:谭潇)
Fund program:National High Technology Research and Development Program of China (863 Program) (No.2012AA02A603)
Association between the expression of peripheral plasma microRNAs and the risk of coronary heart disease
NingMing′an,LiuLipeng,ChenShuying,ChengKang,QuFalin,GuoWenyi
DepartmentofCardiovascularMedicine,XijingHospital,FourthMilitaryMedicalUniversity,Xi′an710032,China
【Abstract】ObjectiveTo investigate the expression and clinical significance of peripheral plasma miRNA-133a,miRNA-208a and miRNA-499a in patients with coronary heart disease (CHD).Methods The 290 CHD patients and 110 controls subjects were enrolled in this study.Peripheral blood of all subjects and their clinical data were collected.Plasma miRNA-133a,miRNA-208a and miRNA-499a levels were determined by quantitative real-time polymerase chain reaction (qRT-PCR) analysis and their expressions were furtherly analyzed.Results(1)Compared with control group,the expression of plasma miRNA-133a [0.62(0.32-0.92) vs.0.39(0.21-0.72),Z=8.80],miRNA-208a [5.85(2.31-9.78) vs.5.06(2.17-9.13),Z=2.32] and miRNA-499a [5.07(2.08-9.54) vs.3.12(1.96-5.03),Z=10.08] were significantly increased in CHD group (all P<0.01).(2)CHD patients were further divided into four groups according to Gensini score.The expression levels of plasma miRNA-133a [0.36(0.21-0.66) vs.0.48(0.36-0.85) vs.0.60(0.42-0.87) vs.0.70(0.56-0.92),H=64.84],miRNA-208a [4.99(2.17-6.73) vs.5.16(3.56-8.04) vs.5.85(4.31-8.63) vs.6.18(4.84-9.78),H=21.54],and miRNA-499a [2.94(1.96-4.93) vs.3.55(2.02-6.63) vs.4.51(2.38-7.54) vs.6.24(4.08-9.54),H=89.70] were significantly difference among those groups (all P<0.01),and positively correlated with severity of coronary artery stenosis (miRNA-133a: r=0.343,miRNA-208a: r=0.395,miRNA-499a: r=0.410,all P<0.01).ConclusionsThere is significant difference between CHD and control groups in the expressions of peripheral plasma miRNA-133a,miRNA-208a and miRNA-499a.In addition,the expression levels and Gensini Score-severity of coronary artery stenosis is positively correlated.
【Key words】MicroRNAs (miRNAs);Coronary artery disease;Reverse transcription;Real-time quantitative polymerase chain reaction;Gensini score
(收稿日期:2016-03-16)
Corresponding author:Guo Wenyi,Email:guowenyi@tom.com
基金项目:国家高技术研究发展计划(863计划)(2012AA02A603)
DOI:10.3969/j.issn.1007-5410.2016.02.008
通讯作者:郭文怡,电子信箱:guowenyi@tom.com