雷沙吉兰对乳胞素诱导帕金森病大鼠神经的保护作用及机制
鲍 波 朱少平 胡 利 冷 扬 苏小华 柴星星
(广东医学院实验动物学教研室,广东 湛江 524023)
雷沙吉兰对乳胞素诱导帕金森病大鼠神经的保护作用及机制
鲍波1朱少平1胡利2冷扬1苏小华柴星星
(广东医学院实验动物学教研室,广东湛江524023)
〔摘要〕目的观察雷沙吉兰对乳胞素诱导帕金森病(PD)大鼠神经的保护作用及机制。方法SD大鼠分为空白对照组、模型组、雷沙吉兰预治疗组和治疗组,通过立体定向注射乳胞素至模型大鼠左侧黑质部位诱导模型,进行行为学、组织病理学检测,PCR检测目的蛋白表达变化。结果模型大鼠在阿朴吗啡的诱导下,向右旋转;与空白对照组相比,其余各组大鼠脑组织切片中酪氨酸羟化酶(TH)阳性细胞数显著减少,但预治疗组和治疗组中TH阳性细胞较多; PCR定量显示Lamp2A与热休克蛋白(HSP)70在治疗组与空白组间存在差异(P<0.05),而治疗组间无差异。 结论雷沙吉兰可以抵抗乳胞素所致的神经损害,改善动物行为学及组织病理学表现,具有神经保护作用, 其机制可能与促进Lamp2A及HSP 70表达,减少TH阳性细胞丢失相关。
〔关键词〕帕金森病;乳胞素;雷沙吉兰;自噬
帕金森病(PD)是一种不可治愈的、伴随多巴胺能神经元逐步变性而不断演进的神经系统疾病〔1〕,常见的临床表现有静止性震颤、肌强直和运动障碍,目前常用药物替代体内逐渐减少分泌的多巴胺,减缓PD的运动症状,但需要长期服药,并逐渐加大药物剂量,导致更多的副作用,因此需要改变替代策略,以减轻各种运动及精神症状〔2〕。在体内、体外及临床实验研究中发现〔3〕,雷沙吉兰不仅能明显改善PD症状,而且具有能延缓PD进程的作用,其保护神经元的作用受到浓度及代谢产物等因素影响,机制比较复杂〔4,5〕。蛋白酶体抑制剂乳胞素被用于构建PD大鼠模型〔6〕,可以较好地模拟PD病理改变〔7〕。本实验将通过乳胞素脑立体定位注射法构建大鼠PD模型,并观察雷沙吉兰能否对抗乳胞素引起的多巴胺能神经元损伤,以探讨其可能的作用机制。
1实验材料
1.1动物SPF级健康成年SD大鼠48只,体重250~300 g,雌雄各半,来自广东医学院实验动物中心〔SCXK(粤)2008-0008〕。乳胞素(L6785,Sigma公司)、阿朴吗啡(A4393,Sigma公司);雷沙吉兰和水合氯醛为国产试剂;抗酪氨酸羟化酶(TH)抗体(单抗,R&D公司);抗α-synulein抗体(单抗,Cell Signaling 公司);DAB试剂盒(中杉金桥);反转录试剂盒(Fermentas公司);PCR扩增试剂盒(Takara公司)。大鼠脑立体定位仪(ZH-蓝星C型,淮北正华生物仪器设备有限公司);凝胶成像仪(InGemus LHR型,Syngene公司)。
1.2实验方法
1.2.1造模将SD大鼠标记后随机分成4组:空白对照组、模型组、预治疗组和治疗组,各12只。按每只每公斤体重300~350 mg水合氯醛腹腔注射麻醉,利用脑立体定位仪在左侧黑质部位注射含8 μg乳胞素的二甲基亚砜(DMSO)溶液2 μl。空白对照组SD大鼠黑质内注射DMSO 2 μl。给予预治疗组及治疗组中每只大鼠腹腔注射雷沙吉兰(使用DMSO溶解),剂量为0.15 mg/kg,1次/d;分别在造模前1 d和造模后1 w〔8〕开始给药。空白对照组和模型组给予生理盐水腹腔注射作为对照。
1.2.2行为学检测观察SD大鼠是否出现被毛杂乱、身体屈曲、活动迟缓、震颤、抓握等异常行为,同时采用阿朴吗啡诱导旋转实验评价行为学改变〔9〕:每只SD大鼠给予颈部皮下注射阿朴吗啡0.5 mg/kg,3 min后,开始计时并记录30 min内大鼠旋转的圈数,以每分钟旋转7转及半小时旋转210转为标准,计算达标只数。手术前1 d进行第1次,手术后第6、13天和20天分别进行第2、3次和四次阿朴吗啡诱导旋转实验。
1.2.3RT-PCR检测所有RNA操作用品均用0.1%DEPC水处理,用于RNA的试剂均用DEPC处理的水配制。使用Trizol试剂盒提取中脑组织细胞总RNA,测量总RNA的A260、A280及A260/A280,计算其总RNA的浓度和纯度。用二步法进行PCR扩增目标RNA,2%琼脂糖凝胶电泳显色,凝胶图像分析软件进行电泳区带的灰度扫描,计算各组指标的目的条带/内参的灰度比值。各引物如表1。

表1 引物序列
1.2.4免疫组织化学检测所有大鼠在手术后第20天完成行为学检测后处死,取左侧黑质固定后作连续病理切片,片厚4 μm。切片用抗TH单抗进行免疫组织化学染色后于光学显微镜下观察,先在10倍物镜下选择TH阳性细胞密集区,然后在40倍物镜放大倍数下进行阳性细胞计数,每个大鼠脑组织蜡块的4张切片细胞数取平均值进行统计。使用同样的方法对α-syn蛋白进行免疫组织化学染色,观察其在大鼠中脑切片上是否有聚集现象及分布情况。

2结果
2.1行为学观察所有大鼠在造模之前进行的阿朴吗啡诱导旋转行为中均未出现旋转行为。模型组及治疗组SD大鼠,在注射乳胞素后4 d,逐渐出现行为迟缓,对外界反应变得迟钝,出现弓背姿势,部分出现自发性旋转。在注射乳胞素后第6天,检测阿朴吗啡诱导的旋转行为,发现空白对照组中的大鼠没有出现旋转行为,而模型组及治疗组中分别有4只和3只SD大鼠出现旋转,速度在7 r/min以上,旋转时间长于10 min;预治疗组中则未见到大鼠的诱导旋转行为。注射乳胞素后第13天进行阿朴吗啡诱导旋转实验,空白对照组没有SD大鼠发生旋转行为;模型组中有7只SD大鼠出现旋转行为,旋转所维持的时间均比上次测试有所增加;治疗组有5只大鼠出现诱导旋转行为,预治疗组中有2只大鼠出现旋转行为(达到标准)。在第20天进行的旋转诱导实验与第13天进行的实验结果相同。
2.2Lamp2A、HSP70 mRNA的表达水平结果分析Lamp2A平均吸光度比值各组间有显著差异,治疗组及预治疗组平均吸光度比值较空白对照组及模型组均升高。HSP70平均吸光度比值各组间有显著差异,治疗组及预治疗组平均吸光度比值较空白对照组及模型组均升高。见表2。
2.3α-syn染色结果模型组大鼠脑皮质和中脑神经元胞质内见到棕色的聚集成团块状的小结,散在分布,治疗组及预治疗组中大鼠神经元中聚集的α-syn蛋白比模型组中的聚集减少。
2.4TH免疫组织化学结果及分析图1可见,空白对照组SD大鼠中,可见黑质染成棕色,大体观呈倒眉毛状;高倍镜下,棕色染色集中在胞质和神经突触。对黑质部位的多巴胺能神经元计数发现,脑内注射乳胞素的各组大鼠TH阳性细胞数较空白对照〔(55.64±6.35)〕组显著减少,治疗组〔(34.79±3.16)〕及预治疗组〔(42.38±3.08)〕中阳性细胞数较模型组〔(19.96±2.31)〕多,使用雷沙吉兰预治疗组大鼠TH阳性神经元细胞数较治疗组多。
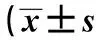
表2 各组SD大鼠Lamp2A及HSP70 mRNA表达
与空白对照组比较:1)P<0.05,2)P<0.01;与模型组比较:3)P<0. 05,4)P<0.01

图1 各组大鼠TH免疫组织化学染色结果(DAB,×400)
3讨论
随着老龄化社会的到来,PD等老年人高发的神经变性疾病已经成为一个重要的社会问题〔10〕。目前PD的病因还不是十分清楚,遗传和环境因素交互作用可能是主要的原因〔11〕。左旋多巴仍是目前治疗的常用药〔12〕,雷沙吉兰也被认为具有神经保护作用而在临床上协同左旋多巴进行治疗〔13〕。在体内、体外及临床实验研究中发现〔3〕,雷沙吉兰不仅能明显的改善PD症状,而且具有能延缓PD进程的作用。结构分析显示,其神经保护作用活性来自于药物的炔丙基胺〔14〕。本实验发现,使用雷沙吉兰治疗组SD模型大鼠TH阳性细胞数与预治疗组有减少,模型组中TH阳性细胞数与治疗组相比显著减少,给予雷沙吉兰预治疗比治疗可以更有效地保护神经元,延缓多巴胺能神经元的凋亡进程,也提示早期给予雷沙吉兰能够保护神经元。最近研究表明,PD的发病机制之一是细胞内错误蛋白聚积。已确定α-syn的聚积促进了多巴胺能神经元的丢失〔15〕。伴侣蛋白介导的自噬(CMA)可能参与调节多种与神经元功能相关的蛋白,其活性的改变也许与PD动物模型及PD病人的发病机制有关〔16〕。Lamp2A是CMA途径的关键蛋白,其表达量的增加表明CMA作用增强〔17〕。本实验发现,雷沙吉兰能促进HSP70及Lamp2A的表达。HSP70蛋白与靶蛋白的KFERQ序列结合后,将识别的底物输送至溶酶体表面与Lamp2A结合,形成溶酶体HSP转位复合物,进入溶酶体内腔,迅速被降解〔18〕。CMA降解蛋白的作用在雷沙吉兰药物的作用下增强。
4参考文献
1Heisters D.Parkinson's:symptoms, treatments and research〔J〕.Br J Nurs,2011;20(9):548-54.
2Meissner WG,Frasier M,Gasser T,etal.Priorities in Parkinson's disease research〔J〕.Nat Rev Drug Discov,2011;10(5):377-93.
3Bar-Am O,Weinreb O,Amit T,etal.The neuroprotective mechanism of 1-(R)-aminoindan, the major metabolite of the anti-Parkinsonian drug rasagiline〔J〕.J Neurochem, 2010;112(5): 1131-7.
4Song MS,Matveychuk D,Mac Kenzie EM,etal.An update on amine oxidase inhibitors:multifaceted drugs〔J〕.Prog Neuropsychopharmacol Biol Psychiatry,2013;44: 118-24.
5Al-Nuaimi SK,Mackenzie EM,Baker GB,etal.Monoamine oxidase inhibitors and neuroprotection: a review〔J〕.Am J Ther,2011;19(6):436-48.
6张海娜, 胡国华,陈秋惠,等.乳胞素诱导大鼠致帕金森病的实验研究〔J〕.中国老年学杂志, 2009;29(2):139-41.
7朱少平,胡利,鲍波.乳胞素诱导PD大鼠模型行为学及病理学观察〔J〕.实验动物科学,2013;30(4):26-9.
8梅加明,牛朝诗.蛋白酶体抑制剂诱导帕金森病大鼠模型行为学退行性改变的研究〔J〕.中国微侵袭神经外科杂志, 2008;13(10):466-9.
9Thomas J,Wang J,Takubo H,etal.A 6-hydroxydopamine-induced selective Pakinsonian rat model: further biochemical and behavioral characterization〔J〕.Exp Neurol, 1994;126(2): 159-67.
10王刚,陈生弟.老龄化社会的阵痛——老年性神经变性疾病的社会解读〔J〕.医学与哲学(人文社会医学版), 2006;27(3):59-60.
11陈生弟.帕金森病〔M〕.北京:人民卫生出版社,2006:24-8.
12Rascol O,Lozano A,Stern M,etal.Milestones in Parkinson's disease therapeutics〔J〕.Mov Disord,2011;26(6): 1072-82.
13陈生弟.中国帕金森病治疗指南(第二版)〔J〕.中华神经科杂志,2009;42(5):352-5.
14Weinreb O,Bar-Am O,Amit T,etal.Neuroprotection via pro-survival protein kinase C isoforms associated with Bcl-2 family members〔J〕. FASEB J, 2004;18(12): 1471-3.
15Li B,Zhang Y,Yuan Y,etal.A new perspective in Parkinson's disease, chaperone-mediated autophagy〔J〕.Parkin Relat Disord,2011;17(4): 231-5.
16Yang Q,Mao Z.Dysregulation of autophagy and Parkinson's disease: the MEF2D link〔J〕.Apoptosis,2010;15(11): 1410-4.
17Dice JF.Chaperone-mediated autophagy〔J〕.Autophagy,2007;3(4): 295-9.
18Kon M,Cuervo AM.Chaperone-mediated autophagy in health and disease〔J〕.FEBS Lett, 2010; 584(7): 1399-404.
〔2014-09-17修回〕
(编辑赵慧玲/曹梦园)
基金项目:广东省科技计划项目(No.2010B060500015)
〔中图分类号〕R742.5
〔文献标识码〕A
〔文章编号〕1005-9202(2016)09-2065-03;
doi:10.3969/j.issn.1005-9202.2016.09.007
1广东医学院病理生理学教研室
2广东医学院组织学与胚胎学教研室
第一作者:鲍波(1968-),男,副教授,硕士生导师,主要从事神经系统的病理生理研究。

