布鲁氏菌Ⅳ型分泌系统效应分子BPE123和BPE275基因的原核表达与鉴定
孙志华,张 辉,刘来珍,刘 娟,韩玉霞,关 团,王 浩,陈创夫
(石河子大学 动物科技学院,动物疾病防控兵团重点实验室,新疆 石河子 832003)
布鲁氏菌Ⅳ型分泌系统效应分子BPE123和BPE275基因的原核表达与鉴定
孙志华,张辉,刘来珍,刘娟,韩玉霞,关团,王浩,陈创夫
(石河子大学 动物科技学院,动物疾病防控兵团重点实验室,新疆 石河子 832003)
[摘要]【目的】 克隆布鲁氏菌Ⅳ型分泌系统效应分子 BPE123 和 BPE275 的基因并进行诱导表达。【方法】 从牛种布鲁氏菌2308 株基因组中 PCR 扩增BPE123和BPE275基因片段,亚克隆到 pGEM-T Easy 载体中并测序。将BPE123 和 BPE275基因克隆至融合表达载体pET-28a,构建表达重组质粒 pET-28a-BPE123和pET-28a-BPE275,在大肠杆菌中进行诱导表达,Western blot分析重组蛋白His-BPE123 和 His-BPE275的免疫学特性。【结果】 PCR 扩增获得了 462 bp 的BPE123 基因片段和762 bp的BPE275基因片段,成功构建了pET-28a-BPE123、pET-28a-BPE275原核表达载体,并在大肠杆菌中成功表达了BPE123和BPE275蛋白,经 SDS-PAGE 检测,重组融合蛋白BPE123、BPE275 的分子质量分别约为22和31 ku,布鲁氏菌免疫动物血清能特异性识别表达的蛋白。【结论】 克隆了分泌蛋白BPE123、BPE275基因片段,并成功表达了布鲁氏菌Ⅳ型分泌系统效应分子 BPE123和BPE275。
[关键词]布鲁氏菌;Ⅳ型分泌系统;效应蛋白
布鲁氏菌病(Brucellosis)简称为布病,其致病菌为布鲁氏杆菌(Brucella)。布鲁氏杆菌是一种革兰氏阴性、兼性胞内寄生菌,它可以感染人和动物,人主要表现为持续性感染并常伴有关节炎和心内膜炎等症状;动物感染后,公畜表现为睾丸肿胀,母畜表现为不孕或流产。作为胞内寄生菌,胞内生存和复制是布鲁氏菌的主要毒力特征[1],布鲁氏菌主要通过皮肤或消化道黏膜侵入机体,随着淋巴液的循环到达淋巴结后被巨噬细胞吞噬[2],巨噬细胞和胚胎滋养层细胞是布鲁氏菌主要的宿主细胞[3]。布鲁氏菌在宿主细胞中胞内的存活及繁殖机理成为近年来的研究热点,这主要涉及几种重要的毒力相关因子:-1,2葡聚糖、O-抗原、BvrR/BvrS二元调控系统和Ⅳ型分泌系统(T4SS)[4]。研究发现,布鲁氏菌的Ⅳ型分泌系统是一个含有11个可跨越细菌膜的多蛋白复合物,由 VirB 操纵子编码,与布鲁氏菌的胞内存活密切相关[5-6]。布鲁氏菌Ⅳ型分泌系统可以调控大量的毒力基因在感染前期进行表达,协助布鲁氏菌在胞内运输使其适应环境并得以存活。研究表明,布鲁氏菌Ⅳ型分泌系统有很多效应分子,并通过这些效应分子发挥其调控作用[7]。已有研究表明, VceC 和 VceA 是第一次被鉴定出的布鲁氏菌 T4SS 分泌蛋白,其被转运到巨噬细胞中,会引起乳酸脱氢酶(LDH)释放增加,显示了其细胞毒性,导致细胞因子产生[3]。研究者利用 CyaA 报告系统确定 BPE865、BPE159、BPE123、BPE005、BPE043 和 BPE275 为分泌蛋白,其中 BPE123 和 BPE275 是布鲁氏菌Ⅳ型分泌系统重要的分泌蛋白分子,可能与布鲁氏菌Ⅳ型分泌系统的调控机制密切相关,但其在布鲁氏菌感染宿主细胞和胞内存活中发挥的作用尚不清楚[4]。目前,研究人员通过 TEM1 报告系统和 CyaA 报告系统筛选出了布鲁氏菌的部分效应蛋白,但其生物学功能还鲜为人知,因此,本研究以分泌蛋白分子BPE123 和 BPE275 为研究对象,构建其原核表达载体,通过SDS和Western blot 法检测其免疫原性和反应原性,以期为布鲁氏菌的免疫诊断及基因疫苗的开发奠定基础。
1材料与方法
1.1试验材料
1.1.1菌株和质粒牛种布鲁氏菌2308株、E.coliDH5α、E.coliDL21(DE3)和原核表达载体,均由石河子大学动物疾病防控兵团重点实验室保存;pGEM-T Easy 载体,购自Promega公司。
1.1.2试剂琼脂糖凝胶回收试剂盒和质粒小提试剂盒,购自北京康为世纪生物科技有限责任公司;布鲁氏菌阳性血清(一抗),由石河子大学动物疾病防控兵团重点实验室保存; HRP 标记的兔抗羊 IgG,购自天根生化科技(北京)有限公司;限制性内切酶(SacⅠ/XhoⅠ)和 T4 连接酶,购自大连宝生物工程有限公司。
1.1.3引物的设计与合成根据 GenBank 登录的牛种布鲁氏菌2308株BPE123 和BPE275基因序列(登录号分别为3828185和3787861)设计特异性引物,BPE123上、下游引物分别为P1:5′-GAGCTCATGAGCTTGTTGCTGGCTAACGT-3′,P2:5′-CTCGAGTCATGCCTGTCCCGCCAGT-3′;BPE275上、下游引物分别为P3:5′-GAGCTCATGCTTCCGAAAGACAAGAGAGAG-3′,P4:5′-CTCGAGCTATCGCCTCAAAACGGCATCA-3′。P1、P2、P3、P4 中斜体部分分别为SacⅠ,XhoⅠ,SacⅠ和XhoⅠ,引物由北京六合华大基因有限公司合成。
1.2方法
1.2.1目的基因的扩增与纯化以100 ℃金属浴灭活1 h的牛种布鲁氏菌2308株悬液为模板进行 PCR 扩增,PCR反应体系(20 μL)为:2×EsTaqMastermix 10 μL,上、下游引物(25 μmol/L)各0.2 μL,模板2 μL,去离子水7.6 μL。反应条件:95 ℃ 4 min;94 ℃ 40 s,65 ℃ 90 s,72 ℃ 40 s,30 个循环;72 ℃ 7 min。采用 20 g/L琼脂糖凝胶检测 PCR 扩增产物,并用琼脂糖凝胶试剂盒回收、纯化目的片段。
1.2.2原核表达载体的构建与鉴定分别将回收纯化后的产物BPE123和BPE275基因片段与 pGEM-T Easy 载体于16 ℃过夜连接,构建重组质粒 pGEM-T-BPE123和pGEM-T-BPE275,转化E.coliDH5α 感受态细胞,在含氨苄抗性的 LB 培养基平板上进行阳性筛选,通过菌液 PCR 和限制性内切酶SacⅠ/XhoⅠ鉴定阳性克隆,并将提取的质粒送交北京六合华大基因有限公司进行测序鉴定。
分别用限制性核酸内切酶SacⅠ/XhoⅠ对重组质粒 pGEM-T-BPE123、pGEM-T-BPE275 和表达载体 pET-28a 进行双酶切,20 g/L琼脂糖凝胶回收消化后的BPE123和BPE275基因片段,10 g/L琼脂糖凝胶回收消化后的 pET-28a 大片段。将BPE123和BPE275分别与 pET-28a 在T4连接酶的作用下于 16 ℃ 过夜连接,转化E.coliDL21,在含卡那抗性的 LB 培养基平板上进行阳性筛选后,进行菌液 PCR 和双酶切鉴定。
1.2.3BPE123和BPE275蛋白表达条件的优化及蛋白纯化将筛选出的阳性克隆菌在 LB 培养基中于 37 ℃ 摇床培养过夜,将过夜菌液按1∶100 的体积比稀释后接种至新鲜 LB 培养基中,37 ℃培养1 h左右,使其 600 nm 处的吸光度为 0.4~0.6,在其他条件不变的情况下,按照不同的诱导剂浓度(终浓度为0.1,0.2,0.6和1 mmol/L)、不同诱导时间(BPE123:0,2,4,6,8 h;BPE275:2,4,6,8 h)进行诱导表达。取1.5 mL 菌液,13 000 r/min离心1 min,向沉淀中加入 80 μL 灭菌水和 20 μL 5×SDS 蛋白上样缓冲液,振荡混匀后沸水煮10 min稍离心,取上清 20 μL进行 15% SDS-PAGE 电泳,观察电泳结果,选择目的蛋白BPE123和BPE275的最佳表达条件。在最佳的诱导条件下,用上述同样的方法对BPE123和BPE275蛋白进行大规模诱导表达,采用 AKTA 蛋白纯化系统纯化后进行15% SDS-PAGE 电泳鉴定。
1.2.4重组蛋白的 Western-blot检测对诱导表达并纯化的融合蛋白 His-BPE123 和 His-BPE275 进行 SDS-PAGE后,转移到 NC 膜上,以200 mA的电流转膜60 min。将膜用 TBST 洗涤后,用封闭液37 ℃ 封闭1 h,用 TBST 洗涤3次,每次10 min。加入1∶200(体积比)稀释的布鲁氏菌阳性血清,4 ℃ 过夜孵育,用 TBST 洗涤3次,每次10 min,加入1∶1 000(体积比)稀释的HRP 标记的兔抗羊IgG,37 ℃孵育1 h,TBST 洗涤后,DAB 显色,去离子水终止显色。
2结果与分析
2.1BPE123和BPE275目的基因的扩增
经20 g/L琼脂糖凝胶电泳分析,PCR扩增的BPE123和BPE275 片段的长度分别为 462 和 762 bp(图1),与预期结果一致。

图 1 BPE123 和BPE275 基因的PCR 扩增
2.2重组质粒的鉴定
对鉴定为阳性的克隆菌测序,并用 DNAMAN 软件进行比对,结果(图2)显示,BPE123和BPE275基因序列与原序列(BPE123_1_M13-47_A41190_A03_1308134020J和BPE275_O_M13-47_A41190_C03_1308134022J)的同源性均为100%。图 3 显示,pGEM-T-BPE123 经SacⅠ/XhoⅠ双酶切获得了462 bp的BPE123片段;pGEM-T-BPE275 经SacⅠ/XhoⅠ双酶切获得了762 bp的BPE275片段。
2.3BPE123、BPE275蛋白表达条件的优化
图4和图5 显示,经终浓度为0.1 mmol/L的IPTG诱导6 h后,BPE123和BPE275基因转化菌蛋白的表达量最高。BPE123和BPE275大量诱导表达后,经AKTA蛋白纯化系统纯化,SDS-PAGE分析(图6)表明,纯化后的蛋白条带清晰,杂带较少,表明纯化效果较好,重组融合蛋白BPE123、 BPE275的分子质量分别约为22和31 ku。
2.4重组蛋白的Western-blot鉴定
从图7中可见明显的阳性条带,表明诱导得到的重组蛋白能被HRP 标记的兔抗羊 IgG 抗体识别,且大小与pET-28分子质量加上目标分子蛋白质量的重组蛋白总分子质量相符。

图 2BPE123和BPE275基因序列的同源性分析
Fig.2Gene sequence homology analysis ofBPE123 andBPE275

图 3 pGEM-T-BPE123和pGEM-T-BPE275的SacⅠ/XhoⅠ双酶切鉴定

图 4 诱导时间和诱导剂浓度对 BPE123 蛋白表达的影响
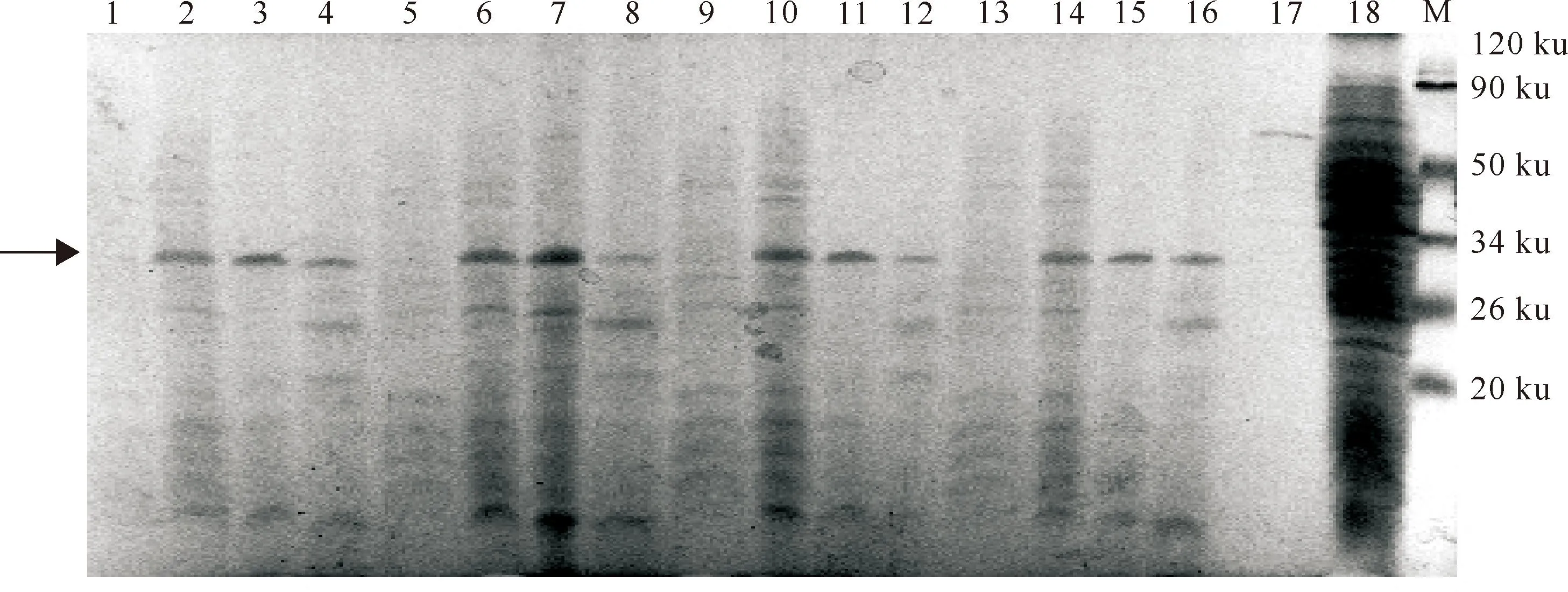
图 5 诱导时间和诱导剂浓度对 BPE275 蛋白表达的影响
3讨论
布鲁氏菌是一种兼性胞内寄生菌,在专业巨噬细胞、非专业巨噬细胞内生存和繁殖是布鲁氏菌致病的重要步骤[1]。病原菌的致病力是细菌入侵机体的先决条件,布鲁氏菌不能产生外毒素,没有质粒、鞭毛、菌毛,不形成芽孢,有毒力的菌株可带菲薄的荚膜[8]。虽然布鲁氏菌缺乏这些经典的致病因子,但其具有较强的侵袭力,并且在宿主细胞内具有较强的生存繁殖能力,因此布鲁氏菌的相关毒力因子研究一直是布病病原学中的重要问题之一。目前已知的布鲁氏菌毒力基因有:Ⅳ型分泌系统(virB)、控制脂多糖合成的基因、H2O2酶基因(抗氧化作用)、高免疫性蛋白基因(groE)、耐高温基因(htrA)、压力蛋白基因(dbaK)、超氧歧化酶基因(SOD)、重组调节基因(rec)、omp25、BvrR/BvrS双组分调控基因[9-10]。Ⅳ型分泌系统(type Ⅳ secretion system,T4SS)是与细菌接合机制有关的一类分泌系统。T4SS 是一种跨膜的多亚单位复合物,通常包括一个由菌毛或其他表面纤维及蛋白质组成的分泌通道。T4SS不但可以转运蛋白质,还可以转运一些核糖核蛋白复合物,这点区别于其他几种分泌系统[11]。布鲁氏菌的T4SS是含有11个可跨越细菌膜的多蛋白复合物,由virB操纵子编码,受感染宿主细胞类型、生长温度、营养条件、pH值等多因素调控,对布鲁氏菌的胞内、外生存有重要影响,因此与布鲁氏菌在宿主细胞内的生存、复制密切相关[5-6]。 细菌的分泌系统能将部分蛋白转运到胞质外环境,这些被分泌的蛋白成为细菌获得营养的重要手段。对于致病性细菌而言,这些分泌性的蛋白帮助细菌发挥定殖、吸附等作用,还可以调理宿主细胞、逃避宿主的免疫机制等[12]。

图 6 纯化后重组蛋白的SDS-PAGE电泳检测
布鲁氏菌的基因组已经完成测序,但其编码的大多数蛋白质尚未确定,尤其是对分泌蛋白的研究知之甚少。杨羽等[13]通过生物学方法预测布鲁氏菌16M 菌株的分泌蛋白,得到了191个具有信号肽的蛋白。张沾等[3]通过对Ⅳ型分泌系统效应子 VceC 的研究表明,VceC 在侵染胚胎滋养层细胞过程中具有毒性作用。王玉飞等[1]通过比较蛋白质组学的方法发现, virB 操纵子通过影响相关蛋白的功能,包括 VjbR、DnaK、htrA、omp25 和 GntR 来调节布鲁氏菌的胞内生存;并发现 T4SS 影响外膜蛋白的特性,这可能与布鲁氏菌适应胞内、外的生存环境是紧密相关的。虽然通过基因工程或蛋白组学的方法对分泌蛋白有了进一步的了解,但有些分泌蛋白只有在侵入宿主细胞发挥致病性时才会分泌出来;而且由于细菌较易裂解,从细胞培养物上清中获得的分泌蛋白可能会存在着一些释放到其中的菌体蛋白,因而通过该方法得到的蛋白不能都确定为分泌蛋白,因此生物信息学手段为筛选和研究分泌蛋白提供了新的研究思路。
布鲁氏菌的 T4SS 对其逃避免疫监视和持续性感染发挥着重要作用。筛选布鲁氏菌 T4SS 的效应蛋白成为当前研究的热点,效应蛋白被认为可以改变经典的内吞降解过程,并在先天免疫和适应性免疫方面发挥重要作用。结合布鲁氏菌目前的功能研究和近亲缘的军团菌的研究现状,笔者推测效应蛋白可能具有更加广泛的作用。
目前对于布鲁氏菌效应蛋白的筛选主要利用 TEM1 报告系统和CyaA报告系统。其中CyaA报告系统则是利用了CyaA(腺苷酸环化酶毒素)能够引起细胞内 cAMP 水平升高的作用,如果融合蛋白能分泌到宿主细胞,cAMP水平会升高,可用 ELISA 方法检测cAMP水平。 研究人员利用CyaA报告系统首次筛选出VceA和VceC 2个 T4SS 效应蛋白,并利用该系统确定BPE865、BPE159、BPE123、BPE005、BPE043 和 BPE275为分泌蛋白,其中前2个蛋白不依赖T4SS;进一步分析显示:BPE123 N-端含25个氨基酸的信号肽决定了其分泌性,氨基酸分析显示这4种 T4SS 效应蛋白C-端富含碱性氨基酸[4]。但是布鲁氏菌如何通过 T4SS 调控效应蛋白来影响细菌的胞内生存和繁殖,以及如何逃避宿主细胞免疫机制和维持持续性感染尚不清楚。本研究以布鲁氏菌T4SS 效应蛋白BPE123和BPE275为研究对象,构建了原核表达载体,并表达了重组融合蛋白,通过Western blot初步验证其免疫原性,这将为筛选布鲁氏菌效应蛋白并研究其对免疫逃逸和维持持续性感染的机制奠定了基础,同时将为防控布鲁氏菌对人类和家畜的巨大危害具有理论指导意义。
[参考文献]
[1]王玉飞,曲勍,乔凤,等.羊布鲁氏菌的分泌蛋白质组分析 [J].微生物学通报,2009,36(8):1150-1157.
Wang Y F,Qu Q,Qiao F,et al.Proteome analysis of secreted proteins ofBrucellamelitensis[J].Microbiology,2009,36(8):1150-1157.(in Chinese)
[2]孙涛,赵宝,冉红志,等.布鲁氏菌病原学研究进展 [J].家畜生态学报,2014,35(1):85-87.
Sun T,Zhao B,Ran H Z,et al.Research progress on nosetiology of brucellosis [J].Acta Ecologae Animalis Domastici,2014,35(1):85-87.(in Chinese)
[3]张沾,陈创夫,张辉,等.布鲁氏菌Ⅳ型分泌系统效应子VceC功能的初步研究 [J].中国预防兽医学报,2011,33(9):685-688.
Zhang Z,Chen C F,Zhang H,et al.Preliminary study on the function ofBrucellatype Ⅳ secretion system (T4SS) effector VceC [J].Chinese Journal of Preventive Veterinary Medicine,2011,33(9):685-688.(in Chinese)
[4]吴同垒,吴清民.布鲁氏菌Ⅳ型分泌系统效应蛋白的研究进展 [C]//中国畜牧兽医学会家畜传染病学分会第八届全国会员代表大会暨第十五次学术研讨会论文集.徐州:中国畜牧兽医学会家畜传染病学分会第八届全国会员代表大会暨第十五次学术研讨会,2013:153-155.
Wu T L,Wu Q M.Research progress on type Ⅳ secretion system inBrucella[C]//Proceedings of the 8th national congress of the members & the 15th academic conference of the branch of infectious diseases science of domestic animals of Chinese association of animal science and veterinary medicine.Xuzhou:China institute of veterinary animal infectious diseases branch,military veterinary institute of military medical sciences,2013:153-155.(in Chinese )
[5]Billard E,Dornand J,Gross A.VirB type Ⅳ secretory system does not contribute toBrucellasuis avoidance of human dendritic cell maturation [J].FEMS Immunol Med Microbiol,2008,53(3):404-412.
[6]Nijskens C,Copin R,De Bolle X,et al.Intracellular rescuing of aB.melitensis16M virB mutant by co-infection with a wild type strain [J].Microb Pathog,2008,45(2):134-141.
[7]Schulein R,Guye P.A bipartite signal mediates the transfer of type Ⅳ secretion substrates ofBartonellahenselaeinto human cells [J].ProC Natl Acad Sci,2005,102:856-861.
[8]刘倩宏.布鲁氏菌的Ⅳ型分泌系统 [J].中国人兽共患病学报,2012,28(9):951-954.
Liu Q H.Type Ⅳ secretion system ofBrucella[J].Chinese Journal of Zoonoses,2012,28(9):951-954.(in Chinese)
[9]曹小安,邱昌庆,秦天达.布鲁氏菌毒力基因的研究状况 [J].中国人兽共患病学报,2009,25(7):689-693.
Cao X A,Qiu C Q,Qin T D.Study on the status ofBrucellavirulence genes [J].Chinese Journal of Zoonoses,2009,25(7):689-693.(in Chinese)
[10]曹涤非,王东凯,王磊,等.布鲁氏菌毒力基因的研究现状 [J].黑龙江科学,2013,4(8):69-70.
Cao D F,Wang D K,Wang L,et al.Advances in the research on theBrucellavirulence gene [J].Heilongjiang Science,2013,4(8):69-70.(in Chinese)
[11]赵岩,李明,胡福泉.细菌的Ⅳ型分泌系统 [J].生命化学,2011,31(1):128-133.
Zhao Y,Li M,Hu F Q.The type Ⅳ secretion system in bacteria [J].Chemistry of Life,2011,31(1):128-133.(in Chinese)
[12]Shrivastava R,Miller J F.Virulence factor secretion and tran-slocation byBrucellaspecies [J].Curr Opin Microbiol,2009,12(1):88-93.
[13]杨羽,吴清民.羊布鲁氏菌16M 基因组分泌蛋白的生物信息学分析 [J].畜牧兽医学报,2009,40(7):1059-1062.
Yang Y,Wu Q M.Analysis of the secreted protein encoding genes in genome ofBrucellamelitensis16M [J].Acta Veterinaria et Zootechnica Sinica,2009,40(7):1059-1062.(in Chinese )
Clone,prokaryotic expression and identification of effector moleculesBPE123 andBPE275 ofBrucellaⅣ secretion system
SUN Zhi-hua,ZHANG Hui,LIU Lai-zhen,LIU Juan,HAN Yu-xia,GUAN Tuan,WANG Hao,CHEN Chuang-fu
(KeyLaboratoryofXinjiangEndemicandEthnicDisease,CollegeofAnimalScience&Technology,ShiheziUniversity,Shihezi,Xinjiang832003,China)
Abstract:【Objective】 This study aimed to clone and express effector molecules BPE123 and BPE275 of Brucella type Ⅳ secretion system.【Method】 The BPE123 and BPE275 genes were obtained from Brucella abortus 2308 genome.Then,they were linked to the vector pGEM-T Easy and cloned to expression vector pET-28a to construct recombinant plasmids pET-28a-BPE123 and pET-28a-BPE275.These constructs were expressed on E.coli BL21 cells,and the immunological characteristics were analyzed using Western blot analysis.【Result】 Full lengths of BPE123 and BPE275 were 462 bp and 762 bp.Prokaryotic expression vector pET-28a-BPE123 and pET-28a-BPE275 were constructed.The BPE123 and BPE275 protein were successfully expressed in E.coli.SDS-PAGE showed proteins with molecular weights of 22 ku and 31 ku.The expressed proteins can be specifically identified by immune serum against Brucella.【Conclusion】 This study successfully cloned BPE123 and BPE275 genes of Brucella abortus 2308 and expressed them.
Key words:Brucella;type Ⅳ secretion system;effector protein
DOI:网络出版时间:2016-04-0709:0010.13207/j.cnki.jnwafu.2016.05.001
[收稿日期]2014-09-29
[基金项目]国家自然科学基金项目(31360610);新疆生产建设兵团国际合作项目(2013BC005);石河子大学杰出青年项目(2012ZRKXJQ02)
[作者简介]孙志华(1989-),男,甘肃张掖人,硕士,主要从事布鲁氏菌致病机制研究。E-mail:zhihuasun918@163.com[通信作者]张辉(1978-),男,山东泰安人,教授,主要从事传染病诊断与致病机制研究。E-mail:allanzhh@yahoo.com
[中图分类号]S855.1+2;Q786
[文献标志码]A
[文章编号]1671-9387(2016)05-0001-07
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160407.0900.002.html

