还原氧化石墨烯/过氧化聚吡咯膜负载氢氧化钴修饰电极检测过氧化氢
乔金丽, 高小玲, 徐 娜, 于 浩
(延安大学 化学与化工学院 陕西省化学反应工程重点实验室, 陕西 延安 716000)
还原氧化石墨烯/过氧化聚吡咯膜负载氢氧化钴修饰电极检测过氧化氢
乔金丽, 高小玲, 徐娜, 于浩*
(延安大学 化学与化工学院 陕西省化学反应工程重点实验室, 陕西 延安716000)
摘要:采用两步电化学方法制备了还原氧化石墨烯(ERGO)/过氧化聚吡咯(OPpy)复合膜负载氢氧化钴(Co(OH)2)修饰电极(Co(OH)2-ERGO-OPpy/CCE).通过电化学方法及EDS能谱技术对该修饰电极进行了表征.在pH 9.0的0.10 mol·L-1B-R缓冲溶液中研究了该修饰电极对过氧化氢(H2O2)的电催化氧化活性.结果表明,RGO/OPpy复合膜增大了电极的有效面积,有利于得到催化活性更高、分散性好的Co(OH)2粒子,同时过氧化聚吡咯提高了电极的选择性.在优化条件下,安培法检测过氧化氢的线性范围为2.0×10-7~ 4.9×10-4mol·L-1,检出限为7.0×10-8mol·L-1(3sb, n=11),灵敏度为163 μA·(mmol·L-1)-1.该电极用于检测过氧化氢时具有检出限低、线性范围宽和选择性好等特点.
关键词:还原氧化石墨烯; 过氧化聚吡咯; 氢氧化钴; 过氧化氢
0引言
过氧化氢(H2O2)的检测在工业生产、食品安全、环境科学、生物分析及临床诊断等领域均具有重要的意义.目前,H2O2的检测方法主要有容量法、光谱法、电化学方法等.其中电化学方法以其操作简单、灵敏度高、选择性好而被认为是较为理想的检测H2O2的方法之一[1].H2O2的电化学检测方法可分为酶法检测和非酶检测两大类.其中,酶传感器最突出的特点是选择性好,但也存在酶价格昂贵、活性受环境干扰大、稳定性较差及使用寿命短等问题[2].非酶电化学检测H2O2时最传统的电极是铂电极,但H2O2在铂电极表面氧化还原时过电位高,易受共存物质的干扰.为此,人们设计了各种化学修饰电极来检测H2O2.如过渡金属铁氰化物[3]、过渡金属(如银、铜、镍、钴和锰等)及其氧化物等修饰电极已用于H2O2的电化学检测[4-9].尤其是过渡金属及其氧化物修饰电极以其价格低廉、修饰程序简单及催化活性高等特点在非酶电化学检测H2O2中受到了广泛的重视.一般情况下,过渡金属及其氧化物修饰电极对H2O2的电还原和电氧化都具有催化活性,但利用电催化还原原理来检测H2O2时易受溶液中溶解氧的影响,检出限高.相反,利用电催化氧化原理来检测H2O2时又存在过电位较高,易受共存物质干扰等不足.
本文以复合陶瓷碳电极为基础电极,采用两步电化学方法制备了氧化石墨烯/聚吡咯复合膜负载氢氧化钴修饰电极.通过电化学方法和EDS能谱技术对该电极性能进行了表征,研究了该修饰电极对H2O2的电催化氧化活性及安培法检测H2O2的分析性能.
1实验部分
1.1仪器与试剂
CHI660D电化学工作站(上海辰华仪器公司),TEM 3000-Quantax 70型环境扫描电子显微镜(日本日立公司)用于记录电极表面的EDS能谱.
单层氧化石墨烯(Graphene Oxide,GO,苏州恒球科技);吡咯(A.R,Pyrrole, Py,国药化学试剂有限公司),使用前连续两次减压蒸馏提纯,置于冰箱中避光保存;30%H2O2(A.R,郑州派尼化学试剂厂);Co(NO)3·6H2O(A.R,西安化学试剂厂);其余试剂均为分析纯,水为去离子水,电阻率为18.25 MΩ·cm.
1.2修饰电极的制备
(1)过氧化聚吡咯/氧化石墨烯复合膜的制备
根据文献[11]的方法将0.20 mg·L-1GO溶液与0.025 mol·L-1的Py溶液混合均匀(高纯氮气除氧),将CCE电极置于该溶液中于0.8 V电位下沉积400 s,得到石墨烯/聚吡咯(GO-Ppy)复合膜电极.将制备好的GO/Ppy电极浸入氮气饱和的0.50 mol·L-1Na2SO4溶液中采用循环伏安法进行电化学还原至电流稳定.取出电极冲洗后再浸入0.10 mol·L-1NaOH溶液中在1.0 V电位下进行过氧化处理,直至电流基本不变,即得石墨烯/过氧化聚吡咯复合膜电极,记为ERGO-OPpy/CCE.
(2)过氧化聚吡咯/氧化石墨烯复合膜负载氢氧化钴修饰电极的制备
先将ERGO-OPpy/CCE电极浸入0.50 mmol·L-1Co(NO)2、0.50 mmol·L-1EDTA、0.10 mol·L-1KCl与0.50 mmol·L-1K3Fe(CN)6(pH=2.0)的混合液中以50 mV·s-1的扫速在0.9~-0.2 V范围内扫描一定圈数,制得亚铁氰化钴/过氧化聚吡咯/石墨烯修饰电极.取出电极冲洗干净后将其置于0.10 mol·L-1NaOH溶液中,控制扫描速度50 mV·s-1于-0.2~0.6 V电位范围内扫描直至得到一稳定的循环伏安图,即得到过氧化聚吡咯/石墨烯复合材料负载纳米氢氧化钴修饰电极,记为Co(OH)2-ERGO-OPpy/CCE.为了对比,制备了氢氧化钴修饰电极(Co(OH)2/CCE).
1.3实验方法
(1)循环伏安法:将制备好的修饰电极表面冲洗干净后置于0.10 mol·L-1B-R缓冲溶液中,记录一定电位范围内的循环伏安图.扫描电镜实验:将制备好的修饰电极端部截取0.5 cm左右,置于扫描电镜仪的样品台上,记录电极表面修饰层的扫描电镜照片.
(2)动力学安培法:控制工作电位为0.60 V,溶液搅拌速度为200 rpm,间隔一定时间加入不同浓度的H2O2,记录电流-时间曲线,并以电流对H2O2浓度绘制标准曲线.
2结果与讨论
2.1修饰电极的制备及表征
是一棵树,确切地说,是一棵千年古樟,在它突然闯入我手机屏幕的那一刻,我的眼睛被定住了,我用大拇指和食指不停地划拉着屏幕,将图片放大,再放大,不想放过其中任何一片树叶,就像不想放过某部精彩小说里的任何一个细节。
钴的氧化物可采用电化学技术方便地从含有钴离子的水溶液中沉积在基础电极表面,但这种方法得到的颗粒易团聚,分布不均匀且电催化活性不高.因此,为了提高此类物质修饰电极的电催化活性就要改进制备方法以控制其形貌及分布的均匀性.根据前期研究结果,本实验中我们采用亚铁氰化钴(CoHCF)化学衍生法制备氢氧化钴修饰电极.同时,为了控制CoHCF的形貌,沉积CoHCF时向沉积液中加入了EDTA[12].
图1为在ERGO-OPpy复合膜上沉积CoHCF时的多扫循环伏安图(a~e:第1、10、20、30、40圈).由图1可见,循环伏安图上于0.3~0.8 V电位范围内出现了两对氧化还原峰,且随着扫描圈数的增加,相应的峰电流均逐渐增大,说明CoHCF逐渐被沉积到了电极表面[12].
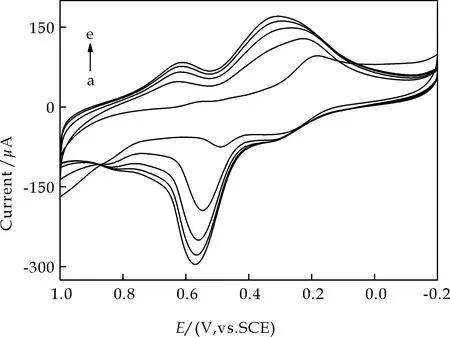
图1 电沉积CoHCF时的循环伏安图
已有文献报道指出,金属铁氰化物在碱性条件下不稳定,会分解生成金属氢氧化物和铁氰根离子[13,14].图2是将Co(OH)2-ERGO-OPpy/CCE电极置于0.1 mol·L-1NaOH溶液中在-0.2~0.6 V电位范围内的多扫循环伏安图.由图2可见,随着扫描圈数的增加,CoHCF的氧化还原峰峰电流逐渐减小,与之同时,在0.2 V和0.5 V附近出现了两对新的峰,且随着扫描圈数的增加,这两对新峰的峰电流逐渐增大至稳定.根据文献报道结果[14],这两对新峰是钴的氧化物发生电极反应时产生的,这说明在上述条件下,CoHCF逐渐分解生成了钴的氧化物并沉积在电极表面.

图2 电化学衍生Co(OH)2时的循环伏安图
图3不同修饰电极表面的EDS能谱(内插图为4~14 KeV范围内局部放大图).由图3可见,单独ERGO-OPpy修饰电极表面层中既无Fe元素,也无Co元素;CoHCF-ERGO-OPpy修饰电极表面层中同时含有Fe和Co元素,说明CoHCF被沉积到了电极表面;而电化学衍生后电极表面的Fe元素消失,只有Co元素.这是由于在碱性溶液中扫描时,CoHCF会逐渐分解生成Co(OH)2和铁氰根离子,Co(OH)2进一步沉积于电极表面,而铁氰根离子则离开电极表面进入溶液[13,14].以上结果说明,采用本文报道的方法成功制备了Co(OH)2-ERGO-OPpy/CCE修饰电极.

图3 不同修饰电极表面的EDS能谱
2.2修饰电极的电化学行为研究
图4是Co(OH)2-ERGO-OPpy/CCE修饰电极在0.10 mol·L-1NaOH溶液中记录的循环伏安图(v=20 mV·s-1).由图4可见,在-0.2~0.6电位范围内,修饰电极可给出三对氧化还原峰.其中-0.07 V处的氧化峰来源于Co(OH)2被氧化成Co3O4的电极反应;0.25 V处的一对氧化还原峰来源于CoOOH/Co3O4电对的电极反应;而0.54 V处的一对氧化还原峰则来源于CoO2/CoOOH电对的电极反应,以上结果与文献报道一致[14,15].进一步考察了扫描速率对峰电流和峰电位的影响,结果表明,在10~100 mV· s-1的扫速范围内,两峰峰电流(1a-1c)均与扫速的一次方成正比,两峰峰电位差值约为40 mV,且几乎不随扫速的变化而变化,说明修饰剂在电极表面负载牢固且电极反应速率快.这是由于ERGO和OPpy复合时可形成三维网状结构,这些网状结构有利于形成颗粒更小、分散更均匀的Co(OH)2粒子,同时ERGO弥补了OPpy导电性的不足,加快了电荷传递速率,使修饰电极表现出高的电化学活性.

图4 修饰电极在0.10 mol·L-1 NaOH溶液中的循环伏安图
2.3修饰电极对H2O2的电催化氧化
图5为Co(OH)2-ERGO-OPpy/CCE电极在0.10 mol·L-1B-R溶液(pH 9.0)中加入1.0×10-3mol·L-1H2O2前(a)后(b)的循环伏安图.由图5可见,加入H2O2后,循环伏安图上0.60 V左右的阳极峰电流迅速增大,而对应的阴极峰电流明显减小,表明该修饰电极对H2O2的电氧化过程具有催化活性.在Co(OH)2/CCE电极上(图5内插图),加入等量H2O2电流变化明显小于Co(OH)2-ERGO-OPpy/CCE电极.同时,在单独ERGO-OPpy/CCE电极上,加入H2O2后的电流也很小.以上结果说明Co(OH)2-ERGO-OPpy/CCE电极对H2O2的电氧化具有更高的电催化活性.催化活性高的原因主要有以下两点:(1)制备CoHCF修饰电极时沉积液中加入的EDTA调节了CoHCF的成核速率和沉积速率,有利于得到粒径小、分散均匀的CoHCF,经化学衍生后,也得到了粒径小、分布均匀的Co(OH)2粒子,催化活性高.(2)三维网状结构的ERGO和OPpy膜也有利于形成颗粒更小、分散更均匀的Co(OH)2粒子,同时ERGO弥补了OPpy导电性的不足,加快了电荷传递速率,使修饰电极表现出高的电催化活性.
采用循环伏安法研究了溶液酸度对修饰电极电催化活性的影响.结果表明,随溶液pH的增大,H2O2的催化氧化峰电位逐渐负移,表明pH增大有利于H2O2的催化氧化,但当溶液pH值过高时,修饰电极稳定性变差.同时,在研究的pH范围内H2O2的催化氧化峰电流随pH值先增大后减小,在pH值为9.0时峰形最好,电流最大,故选pH值为9.0的B-R缓冲溶液为支持电解质溶液.

图5 修饰电极加入1.0×10-3 mol·L-1 H2O2前(a),后(b)的循环伏安图
2.4安培法检测H2O2
2.4.1工作电位的选择
由于安培法具有更高的灵敏度,本实验采用安培法检测H2O2.为了进一步改善修饰电极的分析性能,对安培法的工作电位进行了优化.结果表明,在0.30~0.70 V的电位范围内,随工作电位的增大,修饰电极对H2O2的电流响应先增大后基本不变,至0.60 V时基本达到稳定,故选择0.60 V作为对H2O2的检测电位.
2.4.2线性范围、检出限
图6为Co(OH)2-ERGO-OPpy/CCE修饰电极在加入不同浓度H2O2时的动力学计时安培图(同一浓度系列连续加入3次).结果表明,在优化条件下,电流与H2O2浓度在2.0×10-7~4.9×10-4mol·L-1范围内呈现良好的线性关系,线性方程为:i(μA)=0.663+0.163c(μmol·L-1),相关系数r=0.999 2,检出限为7.0×10-8mol·L-1(3sb),灵敏度为163μA·(mmol·L-1)-1.该修饰电极与AgNPs-CNF[4],Cu/PAA/CNT[5],Nafion/EGO/Co3O4-GC[6],MnO2/GO[7],Ni-NiO/Cu-Cu2O-GC[8],Co(OH)2-GC[9]等已报道的电极相比,具有检出限低,灵敏度高的特点.

图6 连续加入不同浓度H2O2时的动力学电流-时间曲线
2.5修饰电极的稳定性、重现性
在优化条件下,对1.0×10-5mol·L-1H2O2连续进行11次平行测定,其RSD为3.4%,同一批制备的5支修饰电极测定1.0×10-5mol·L-1H2O2的相对标准偏差为5.8%.电极室温下放置30天后再进行测试,其响应电流几乎不变,说明该电极具有很好的稳定性和重复性.
2.6干扰实验
以血清为模拟样品,考察了常见干扰物质对H2O2测定的影响,如图7所示.结果表明,对1.0×10-5mol·L-1H2O2,当测定相对误差不大于±5%时,5倍的抗坏血酸(AA)、L-半胱氨酸(L-Cys),10倍的多巴胺(DA)、尿酸(UA),20倍的柠檬酸(citric acid)、500倍的葡萄糖(Glu)、乙酸(HAc)、乙醇(ethanol)不干扰测定.血清中常见无机离子对测定均不产生干扰,说明该修饰电极具有较好的选择性,有望于用实际样品分析.

图7 干扰物质对H2O2测定的影响
3结论
采用电化学方法制备了氧化石墨烯/过氧化聚吡咯复合膜负载氢氧化钴修饰电极.研究结果表明,石墨烯/过氧化聚吡咯膜利于形成颗粒小,分散均匀的氢氧化钴粒子,且石墨烯弥补了过氧化聚吡咯导电性的不足,加快了电荷传递速率,使修饰电极表现出高的电催化活性.同时,采用电化学衍生亚铁氰化钴的方法也有利于控制氢氧化钴粒子的粒径及分散性,提高了催化活性.该修饰电极检测H2O2时具有检出限低、线性范围宽及稳定性好等特点,有望用于实际样品分析.
参考文献
[1] 何世伟,吴宏伟,习玲玲.离子液体掺杂聚苯胺/纳米铜修饰电极制备及其在过氧化氢测定中的应用[J].分析化学,2013,41(5):766-770.
[2] 汪维维,裘宇,张少鹏,等.聚乙烯亚胺功能化碳纳米管负载铂@金核壳纳米粒子的过氧化氢传感器[J].分析化学,2014,42(6):835-841.
[3] Ricci F,Palleschi G.Sensor and biosensor,preparation,optimisation and application of prussian blue modified electrodes[J].Biosens Bioelectron,2005,21(3):389-407.
[4] 王奕琛,姜秀娥.基于碳载小尺寸银纳米颗粒的过氧化氢电化学传感器[J].分析化学,2014,42(5):689-694.
[5] 强晓玲,王宗花,夏建飞,等.铜纳米粒子在碳纳米管上的原位生长及对过氧化氢电催化性能研究[J].分析试验室,2012,31(10):11-14.
[6] Ensafin Ali A,Jafari Asl M,Rezaei B.A novel enzyme-free amperometric sensor for hydrogen peroxide based on nafion/exfoliated graphene oxide-Co3O4nanocomposite[J].Talanta,2013,103(10):322-329.
[7] Li L M,Du Z F,Liu S,et al.A novel nonenzymatic hydrogen peroxide sensor based on MnO2/graphene oxide nanocomposite[J].Talanta,2010,82(9):1 637-1 641.
[8] 杨阿喜,金根娣.镍-氧化镍/铜-氧化亚铜复合纳米粒子修饰玻碳电极测定过氧化氢[J].应用化学,2009,26(12):1 466-1 470.
[9] 刘有芹,刘六战,沈含熙.氢氧化钴修饰玻碳电极的制备及其电化学行为[J].分析测试学报,2004,23(6):9-13.
[10] Tsionsky M,Gun J,Glezer V,et al.Sol-gel derived ceramic-carbon composite electrode:Introduction and scope of application[J].Anal Chem,1994,66(10):1 753-1 754.
[11] Zhu C Z,Zhai J F,Wen D,et al.Graphene oxide/polypyrrole nanocomposites:One-step electrochemical doping,coating and synergistic effect for energy storage[J].J Mater Chem,2012,22(2):6 300-6 306.
[12] Yu H,Wang Y,Lian Y Y,et al.Electrochemical preparation of cobalt hexacyanoferrate nanoparticles under the synergic action of EDTA and overoxidized polypyrrole film[J].Electrochim Acta,2012,57(12):650-658.
[13] Ganesh V,Maheswari D L,Berchmans S.Electrochemical behaviour of metal hexacyanoferrate converted to metal hydroxide films immobilized on indium tin oxide electrodes-catalytic ability towards alcohol oxidation in alkaline medium[J].Electrochim Acta,2011,56(1):1 197-1 207.
[14] Yu H,Jin J,Jian X,et al.Preparation of cobalt oxide nanoclusters/overoxidized polypyrrole composite film modified electrode and its application in nonenzymatic glucose sensing[J].Electroanalysis,2013,25(7):1 665-1 674.
[15] Barbero C,Planes G A,Miras M C.Redox coupled ion exchange in cobalt oxide films[J].Electrochem Commun,2001,3(3):113-116.
【责任编辑:蒋亚儒】
Determination of hydrogen peroxide using a modified electrode composed of Co(OH)2loaded on the reduced graphene and overoxidized polypyrrole film
QIAO Jin-li, GAO Xiao-ling, XU Na, YU Hao*
(College of Chemistry and Chemical Engineering, Shaanxi Province Key Laboratory of Chemical Reaction Engineering, Yan′an University,Yan′an 716000, China)
Abstract:A chemically modified electrode composed of Co(OH)2 loaded on reduced graphene and overoxidized polypyrrole composite film (Co(OH)2-ERGO-OPpy/CCE) was fabricated by two steps electrochemical method.The electrochemical behavior and element composition of this modified electrode was studied carefully by using electrochemical and EDS techniques.Furthermore,the electrocatalytic activity of this modified electrode1 for the oxidation of hydrogen peroxide was also investigated in 0.10 mol·L-1B-R buffer (pH 9.0).The results showed that a strong electrocatalytic activity and good selectivity was obtained under the synergic action of Co(OH)2,ERGO and OPpy.Under the optimum conditions,the linear range for the determination of hydrogen peroxide by amperometry was in the range of 2.0×10-7~4.9×10-4mol·L-1.The detection limit and sensitivity was 7.0×10-8mol·L-1(3sb,n=11) and 163 μA·(m mol·L-1)-1,respectively.This modified had some attractive analytical features such as low detection limit,wide linear range,as well as good selectivity.
Key words:reduced graphene oxide; overoxidized polypyrrole; Co(OH)2; hydrogen peroxide
中图分类号:O657.1
文献标志码:A
文章编号:1000-5811(2016)03-0055-05
作者简介:乔金丽(1990-),女,陕西靖边人,在读硕士研究生,研究方向:化学修饰电极 通讯作者:于浩(1971-),男,陕西岐山人,副教授,研究方向:化学修饰电极,yananyh2013@163.com
基金项目:陕西省教育厅专项科研计划项目(14JK1832); 延安市科技局工业攻关项目(2014KG-01)
收稿日期:2016-03-14

